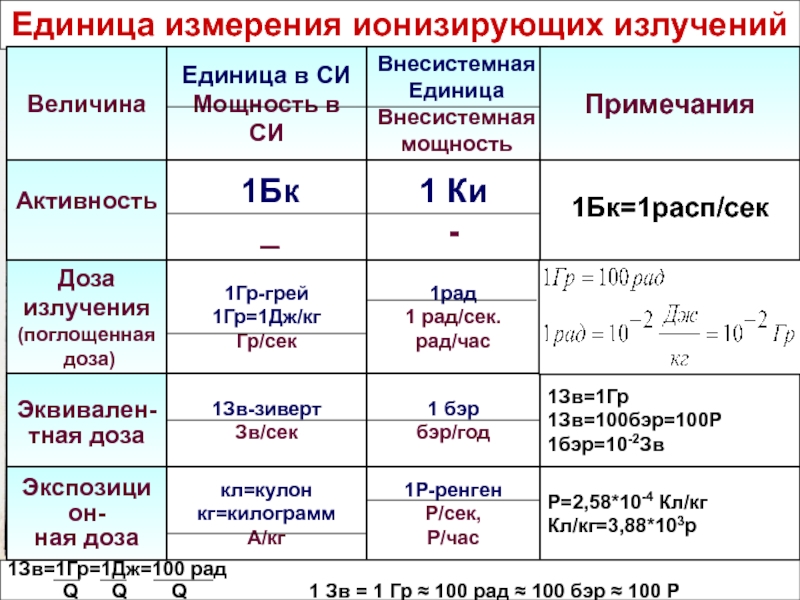
Дозы облучения при проведении компьютерной томографии
Вы знали, что на рентгеновском аппарате нет встроенного дозиметра для контроля дозы облучения пациента, фактически полученной им во время исследования?
Как же тогда узнать дозу облучения, полученную во время исследования?
Вы знали, что на рентгеновском аппарате нет встроенного дозиметра для контроля дозы облучения пациента, фактически полученной им во время исследования?
Как же тогда узнать дозу облучения, полученную во время исследования?
Чтобы оценивать радиационные риски в результате диагностических рентгенологических исследований, существует такая характеристика как Радиационный выход (DAP). Он определяется как поглощённая доза, умноженная на площадь потока, и выражается в [Гр см2]. DAP отражает не только дозу в поле излучения, но и площадь облученной ткани. Следовательно, он может быть лучшим показателем общего риска возникновения злокачественных образований, чем просто информация о поглощенной дозe.
Сегодня в медицине руководствуются принципом ALARA (сокр. As Low As Reasonably Achievable) — один из основных критериев, сформулированный в 1954 году Международной Комиссией по Радиологической Защите с целью минимизации вредного воздействия ионизирующего излучения. Этот принцип предусматривает поддержание доз на возможно низком и достижимом уровне ниже пределов, установленных действующими нормами).
Более того, в стоматологии запрещены скрининговые рентгеновские исследования.
Руководствуясь значением DAP, врач может либо уменьшить силу тока и напряжение, чтобы снизить мощность потока, либо выбрать меньшую область обзора (FOV), чтобы уменьшить площадь облучения.
Так каковы же дозы облучения, полученные во время исследования, и от чего они зависят?
Информация об уровне DAP сохраняется в DICOM файлах и может быть считана в программах EzDent-i и Ez3D-i. Более точная информация предоставляется дозиметристами при лицензировании рентгеновского кабинета.
Какова доза облучения при ОПТГ, ТРГ снимках ?
При использовании компьютерного томографа Vatech PaX-i3D с полем обзора 12х9 см верхней границей эффективной дозы будет 60 мкЗв. Для поля 5х5 см 40 мкЗв.
Верхней границей панорамного снимка будет значение 10 мкЗв.
Обратимся к СанПиНу 2.6.1.1192-03 и СанПиН 2.6.1.2523-09, чтобы узнать допустимую дозу облучения за год.
Какова допустимая доза облучения за год?
Для персонала группы А (работают непосредственно с источниками) установлены следующие предельные дозы:
В среднем 20 мЗв за год в течение любых последовательных 5-ти лет. При этом годовой показатель облучения не должен превышать 50 мЗв.
Для персонала группы Б (непосредственно не работают с источниками, но подвергаются их воздействию):
В среднем 5 мЗв за год в течение любых последовательных 5-ти лет. При этом годовой показатель облучения не должен превышать 12,5 мЗв.
От чего зависит доза облучения?
От параметров управления рентгеновской установкой (сила тока, напряжение, время экспозиции) и от площади облучения. И конечно же от того какие ткани и органы были подвержены этому облучению.
Одни органы и ткани человека более чувствительны к действию изучения, чем другие: например, при одинаковой эквивалентной дозе возникновение рака в лёгких более вероятно, чем в щитовидной железе, а облучение половых желез особенно опасно из-за риска генетических повреждений.
*(1 мЗв =1000 мкЗв)
Ученые установили: малые дозы радиации повреждают ДНК проростков семян лука
Специалисты двух российских институтов (Институт биофизики ФИЦ «Красноярский научный центр СО РАН» – ИБФ СО РАН; ФИЦ «Институт цитологии и генетики СО РАН» – ИЦиГ СО РАН) исследовали влияние гамма-излучения на степень повреждения ДНК проростков семян лука. Сравнив параметры ДНК растений с контрольными образцами, ученые впервые установили, что даже малые дозы радиации могут привести к различным хромосомным нарушениям, в то время как ранее считалось, что только большие дозы могут давать подобные эффекты.
Эксперименты по облучению проростков проводились в отделе радиационных исследований Института ядерной физики им. Г. И. Будкера СО РАН (ИЯФ СО РАН). Результаты опубликованы в журнале «Доклады Академии наук» и в Journal of Environmental Radioactivity. Работа частично поддержана грантом РФФИ и Красноярского краевого фонда науки № 18–44–240001.
На сегодняшний день достаточно подробно изучено влияние больших доз радиации на человека и живые организм вообще, в то время как проблема малых доз радиации, которая также имеет глобальное значение, пока исследована в меньшей степени. Международная комиссия по радиационной защите (International commission on radiological protection – ICRP/МКРЗ) приняла так называемую линейную беспороговую модель зависимости, согласно которой негативные последствия облучения проявляется даже при небольшой дозе радиации. Однако к настоящему моменту накоплено довольно много данных, противоречащих данной гипотезе, поэтому специалисты разработали также пороговую модель этой зависимости. Она говорит о том, что малые дозы радиации не оказывают негативного влияния, но при увеличении дозы эффекты проявляются скачкообразно, после прохождения определенного порога, который индивидуален для каждого живого организма.
Команда сибирских ученых исследовала, как различные дозы гамма-излучения влияют на степень повреждения ДНК проростков семян лука. Серию соответствующих экспериментов провели в ИЯФ СО РАН на источнике гамма-излучения на основе цезия-137: образцы облучались в течение 24 часов, поглощенная доза радиации составила 0,02; 0,05; 0,1; 1; 3 и 5 Гр, значения мощности доз гамма-излучения определялись расстоянием от проростков до источника.
Серию соответствующих экспериментов провели в ИЯФ СО РАН на источнике гамма-излучения на основе цезия-137: образцы облучались в течение 24 часов, поглощенная доза радиации составила 0,02; 0,05; 0,1; 1; 3 и 5 Гр, значения мощности доз гамма-излучения определялись расстоянием от проростков до источника.
«Мы проанализировали полученные данные и зафиксировали повреждения ДНК проростков, получивших малые дозы облучения (0,02 – 0,1 Гр), сравнив их с контрольными образцами, – рассказывает заведующий лабораторией радиоэкологии ИБФ СО РАН, доктор биологических наук, кандидат физико-математических наук
Александр Болсуновский. – Кроме того, мы установили, что в области больше 0,02 Гр количество повреждений нарастает практически линейно, однако, рост прекращается при увеличении дозы облучения выше 1 Гр, и даже наблюдается некоторое снижение уровня повреждений, поэтому можно говорить о дозонезависимом плато в диапазоне доз от 1 до 5 Гр».
По словам Александра Болсуновского, такой эффект можно объяснить существованием своеобразного порога повреждений. Малые дозы радиации наносят клеткам сравнительно небольшой урон, поэтому механизм репарации запускается только когда количество нарушений достигает некой критической отметки. Нужно отметить, что в такой ситуации существует опасность неправильной репарации разрывов ДНК, а это может привести к серьезным хромосомным нарушениям, которые могут проявиться только в последующих поколениях. Поэтому влияние малых доз радиации ни в коем случае не стоит недооценивать – механизмы влияния такого облучения на живые организмы требуют более тщательного изучения.
Данный эксперимент проводился в Отделе радиационных исследований и радиационной безопасности ИЯФ СО РАН.
«Наша основная задача — обеспечение радиационной безопасности при работе научных установок, — рассказывает руководитель Отдела Михаил Петриченков.
– Мы также занимаемся настройкой и калибровкой различных дозиметров, а для этого нужны соответствующие источники ионизирующего излучения. Однако эти источники можно использовать и для других целей, например, для работы с биологическими объектами. Облучение проростков лука – это не первый наш подобный опыт, ранее мы проводили серию аналогичных экспериментов с ветвистоусыми рачками, также совместно с научной группой из ИБФ СО РАН. Биологи привозят нам готовые образцы, а мы обеспечиваем необходимые условия и следим за ходом эксперимента».
Эксперты ответили на сообщения о риске облучиться при полете в США :: Общество :: РБК
Длительные авиаперелеты не несут никакой опасности для жизни человека в отношении получения дозы облучения. Об этом сообщил РБК доктор наук, заведующий лабораторией радиоизотопного комплекса Института ядерных исследований РАН Борис Жуйков, комментируя информацию о возможности облучиться на трансполярных рейсах.
«Человек может получить дозу [облучения], но это не имеет никакого значения», — заявил Жуйков, объяснив, что в случае с малыми дозами важны общие показатели радиации, полученной по меньшей мере за год.
«Человек получит в 100 раз [превышающую] дневную дозу, но летит-то он полдня. Это будет, грубо говоря, одна семисотая часть обычной дозы», — отметил ученый.
Ученый предупредил о риске облучиться при полете в СШАРанее замдиректора по научной работе Института прикладной геофизики им.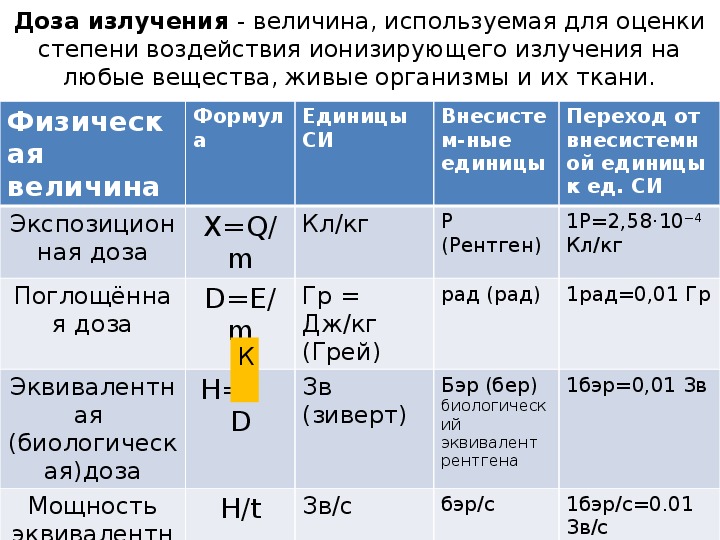 Е.К. Федорова Владимир Минлигареев сообщил, что доза облучения, которую получают пассажиры длительных трансполярных авиарейсов в случае мощной солнечной вспышки, может в сто раз превышать годовую. Таким образом, человек может получить значительную дозу облучения во время перелета из России в США или из США в Японию.
Е.К. Федорова Владимир Минлигареев сообщил, что доза облучения, которую получают пассажиры длительных трансполярных авиарейсов в случае мощной солнечной вспышки, может в сто раз превышать годовую. Таким образом, человек может получить значительную дозу облучения во время перелета из России в США или из США в Японию.
СРАВНИТЕЛЬНЫЙ АНАЛИЗ ДОЗ ОБЛУЧЕНИЯ ПАЦИЕНТОВ ПРИ КОМПЬЮТЕРНОЙ ТОМОГРАФИИ В ФЕДЕРАЛЬНОМ ЛЕЧЕБНОМ УЧРЕЖДЕНИИ | Маткевич
1. Morin R.L., Seibert J.A., Boone J.M. Radiation dose and safety: Informatics standards and tools. J. Am. Coll. Radiol. 2014; 11 (12 Pt B): 1286–97.
2. Государственный доклад Роспотребнадзора «О состоянии сани- тарно-эпидемиологического благополучия населения в Российской Федерации в 2011 году». М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора; 2012: 268–9.
3. МУ 2.6.1.2944-11. 2.6.1. Ионизирующее излучение, радиационная безопасность. Контроль эффективных доз облучения пациентов при проведении медицинских рентгенологических исследований. Методические указания (утв. Роспотребнадзором 19.07.2011). М.; 2011.
4. Синицын В.Е., Глазкова М.А., Мер- шина Е.А., Архипова И.М. Возможности снижения лучевой на- грузки при проведении МСКТ- коронарографии: использование адаптивной статистической итеративной реконструкции. Ангио- логия и сосудистая хирургия. 2012; 18 (3): 44–9.
5. Вишневская А.В., Кондратьев Е.В. Снижение эффективной дозы об- лучения при МСКТ-перфузии головного мозга с использованием итеративных реконструкций. Медицинская визуализация. 2013; 3: 41–51.
6. Smith-Bindman R. Environmental causes of breast cancer and radiation from medical imaging: findings from the Institute of Medicine report. Arch. Intern. Med. 2012; 172 (13): 1023–7.
Smith-Bindman R. Environmental causes of breast cancer and radiation from medical imaging: findings from the Institute of Medicine report. Arch. Intern. Med. 2012; 172 (13): 1023–7.
7. European guidelines on quality criteria for computed tomography. Report EUR 16262. Brussels, Belgium: European Commission; 1999.
8. Hayton A., Wallace A., Marks P. et al. Australian diagnostic reference levels for multi detector computed tomography. Australas Phys. Eng. Sci. Med. 2013; 36 (1): 19–26.
9. Van der Molen A.J., Schilham A., Stoop P. et al. National survey on radiation dose in CT in the Netherlands. Insights Imaging. 2013; 4 (3): 383–90.
10. Tsapaki V., Aldrich J.E., Sharma R. et al. Dose reduction in CT while maintaining diagnostic confidence: diagnostic reference levels at routine head, chest, and abdominal CT – IAEA-coordinated research project. Radiology. 2006; 240 (3): 828–34.
11. International Atomic Energy Agency. Radiological protection for medical exposure to ionizing radiation safety guide. IAEA safety Standarts Series No. RS-G-1.5, Vienna, Austria: International Atomic Energy Agency; 2002.
12. МР 2.6.1.0066-12. 2.6.1. Ионизирующее излучение, радиационная безопасность. Применение референтных диагностических уровней для оптимизации радиационной защиты пациента в рентгенологических исследованиях общего назначения: Методические рекомендации (утв. Роспотребнадзором 23.07.2012). М.; 2012.
13. Goldschmidt F., De Gelder P. , Beraha D. An approach to knowledge management for EUROSAFE projects: EUROSAFE 2005 «Safety Improvements – Reasons, Strategies, Implementation». Brussels, November 7-8, 2005, Seminar 2. Available at http:// www.eurosafe-forum.org/sites/ default/files/pe_390_24_1_seminar2 _10_2005.pdf.
, Beraha D. An approach to knowledge management for EUROSAFE projects: EUROSAFE 2005 «Safety Improvements – Reasons, Strategies, Implementation». Brussels, November 7-8, 2005, Seminar 2. Available at http:// www.eurosafe-forum.org/sites/ default/files/pe_390_24_1_seminar2 _10_2005.pdf.
Частота рака щитовидной железы и ее эпидемиологические детерминанты: роль ионизирующего излучения | Тронько
В результате аварии на Чернобыльской АЭС значительная часть территорий Украины оказалась загрязненной радионуклидами. По данным НКДАР ООН [57], активность материала, выброшенного в окружающую среду из разрушенной активной зоны реактора, составила около 50 МКи, среди которого доля радионуклидов йода, цезия и теллурия составила 10—20 %. Несмотря на то что оперативное проведение йодной профилактики позволило снизить дозовую нагрузку на щитовидную железу [1, 3], все же значительная часть детского и взрослого населения получила дозы облучения щитовидной железы, представляющие серьезную опасность в развитии возможных отдаленных онкологических последствий. На основании расчетов доз по наиболее консервативной модели «однократного поступления» радиоактивного йода число детей, проживающих в 8 наиболее пострадавших от облучения радионуклидами йода районах Украины и подвергшихся воздействию доз, превышающих 200 сГр, оценивается 12 000 и более, в области доз до 200 сГр — 79 500, до 30 сГр — 38 000 [2].
Имеющаяся информация о дозах облучения щитовидной железы у населения Украины, с одной стороны, и сведения о канцерогенных эффектах облучения этого органа, накопленные к настоящему времени в мире,— с другой, свидетельствуют о необходимости проведения тщательно спланированных эпидемиологических исследований, направленных на оценку риска возникновения этой патологии у пострадавших. Вместе с тем эффективность подобных исследований, а следовательно, и разработка профилактических мероприятий по снижению последствий облучения в будущем будут в значительной степени зависеть от учета особенностей эпидемиологического изучения роли радиационного фактора в развитии рака щитовидной железы.
В связи с вышеизложенным целью настоящей работы было обобщение накопленных к настоящему времени в мире сведений, отражающих недостатки в изучении эпидемиологии радиационно обусловленного рака щитовидной железы, а также подтверждающих необходимость дальнейшего развития и совершенствования этих исследований.
Современная информация об этиологической роли факторов риска в развитии рака щитовидной железы у человека основана на результатах ряда аналитических и описательных эпидемиологических исследований, проведенных в мире,с начала 50-х годов [48]. Показано, что наряду с такими этиологическими факторами, как питание, наличие предшествующей патологии щитовидной железы, гормональные нарушения и генетическая предрасположенность, в развитии данного заболевания наиболее существенна роль ионизирующей радиации. Изучению именно радиационного фактора посвящено наибольшее количество работ, хотя некоторые из них и носят описательный или корреляционный характер.
В 1950 г. В. Duffy и Р. Fitzgerald [17] сообщили о 28 больных раком щитовидной железы, зарегистрированных среди лиц в возрасте до 18 лет, из которых 10 были подвержены терапевтическому рентгеновскому облучению в период новорожденно- сти по поводу увеличения тимуса. Несколькими годами позже D. Е. Clark [11] опубликовал результаты собственных наблюдений за 15 пациентами, лечившимися по поводу рака. У всех обследуемых в анамнезе был установлен факт облучения в детском возрасте. В 1966 г. Т. Winship, R. Rosvoll [62] на основании обзора мировой литературы и собственных данных обнаружили, что более 70 % всех лиц с диагностированным раком щитовидной железы подвергались в детстве облучению головы и шеи. Результаты этих описательных эпидемиологических исследований в дальнейшем были подтверждены установлением причинной связи между облучением и развитием заболевания [7, 12, 14, 19, 21, 22, 24, 32, 43, 47, 60, 61].
Основные группы наблюдаемых в этих исследованиях составили лица, подвергшиеся облучению в результате атомных бомбардировок японских городов, получившие в детстве терапевтическое рентгеновское облучение по поводу различных заболеваний, подвергшиеся воздействию радиационных осадков в результате испытания ядерного оружия, облученные препаратами |3‘1 с диагностической и терапевтической целью.
Рак щитовидной железы и внешнее облучение
Наблюдение за пострадавшими в результате атомных бомбардировок показало наиболее значительное повышение частоты рака щитовидной железы среди лиц, облученных в возрасте до 20 лет. Полученные при этом дозы облучения составили 0,5 Гр и более [32, 38, 43, 52].
С 1926 г. по 1957 г. в Рочестере, штат Нью-Йорк, широкое распространение получило проведение терапевтического рентгеновского облучения новорожденных в связи с увеличением тимуса. Диапазон доз облучения щитовидной железы колебался от 0,05 до 10 Гр, однако в 62 % случаев они составили менее 0,5 Гр. Результаты 29-летнего наблюдения за 2650 пациентами, подвергшимися облучению, и 4800 необлученными братьями и сестрами, отобранными в качестве контрольной группы, показали статистически достоверное превышение частоты рака щитовидной железы и аденомы среди облученных. Относительный риск при этом составил 45 для рака и 15 для аденомы щитовидной железы [55].
Большой интерес представляют проспективные наблюдения (1948—1960 гг.) за 10 842 израильскими детьми, подвергавшимися в возрасте 1 — 15 лет терапевтическому облучению черепа по поводу стригущего лишая [40—42, 47, 49]. Дозы рентгеновского облучения черепа при этом составляли около 4 Гр в течение 5 дней, а щитовидной железы от 4,3 до 16,9 сГр со средней дозой 9 сГр. Первую контрольную группу составили 10 842 здоровых и необлученных ребенка, подобранных по полу, возрасту и месту жительства. Вторая группа состояла из 5400 здоровых и необлученных братьев и сестер того же пола и возраста (в пределах 5 лет), что и облученные. Относительный риск для возрастных групп 0—5, 6—8 и 9—15 лет соответственно составил 8,1, 5,0 и 3,4. При анализе достаточно высоких значений риска при умеренных дозах облучения щитовидной железы было обращено внимание на тот факт, что у облученных большую долю составляли лица, прибывшие в Израиль из североафриканского региона. Относительный риск для них был равен 14,1, а для прибывших, в частности, из Марокко и Туниса,— 25,1. Наблюдаемые значения относительного риска в этой группе авторы связывали с возможностью дополнительного предшествующего облучения. В то же время среди марокканских эммигрантов зарегистрирована высокая частота встречаемости атаксии-телеангэктазии — аутосомного рецессивного нарушения с высокой чувствительностью к острому воздействию ионизирующего излучения [39].
Наблюдаемые значения относительного риска в этой группе авторы связывали с возможностью дополнительного предшествующего облучения. В то же время среди марокканских эммигрантов зарегистрирована высокая частота встречаемости атаксии-телеангэктазии — аутосомного рецессивного нарушения с высокой чувствительностью к острому воздействию ионизирующего излучения [39].
Аналогичные результаты были получены в наблюдениях за пациентами, облученными в возрасте от 1 года до 15 лет по поводу того же заболевания, проведенные в Нью-Йоркском медицинском центре [4]. Исследование состояло из двух этапов: на первом этапе в течение 15 лет наблюдалось 2043 пациента, на втором в течение 20 лет — 1981. Контрольную группу составили на первом этапе 1413 детей, на втором — 1258 детей, подобранных по полу и возрасту, имеющих такое же заболевание, но не подвергавшихся облучению. Средняя доза облучения щитовидной железы составляла 6 сГр. Среди облученных было обнаружено статистически значимое превышение частоты аденом, при этом ни одного случая рака железы зарегистрировано не было. Существенными недостатками этих исследований были относительно небольшая численность наблюдаемых когорт и малое количество лиц женского пола (13%) среди облученных.
Результаты, основанные на наблюдениях за пациентами, получившими различные дозы терапевтического облучения на область головы и шеи по поводу опухолевых и неопухолевых заболеваний [37, 53], также могут быть использованы при оценке эффектов облучения щитовидной железы.
- DeGroot, Е. Paloyan [14] привели наблюдения за пациентами, лечившимися по поводу рака щитовидной железы, из них 40 % в прошлом получили терапевтическое облучение шеи. Возраст больных на момент обследования был около 35 лет. Опухоли развились в среднем через 20 лет после облучения.
- Favus и соавт. [18] обследовали 1056 пациентов, подвергшихся рентгеновскому облучению по поводу инфекционных и воспалительных заболеваний верхних дыхательных путей. В результате у 27,2 % обследуемых были обнаружены узловые образования в щитовидных железах (у 16,5 % при пальпации).
 Более ‘/з (33%) этих узлов оказались злокачественными. Анализ потенциальных факторов риска показал высокую степень корреляции (р<0,001) между радиационным воздействием и узловыми образованиями. К сожалению, в приведенном исследовании авторы не имели контрольной группы, однако, согласно предыдущим работам этой же группы ученых, частота пальпируемых узлов среди необлученных пациентов составила не более 0,8—2,7 %.
Более ‘/з (33%) этих узлов оказались злокачественными. Анализ потенциальных факторов риска показал высокую степень корреляции (р<0,001) между радиационным воздействием и узловыми образованиями. К сожалению, в приведенном исследовании авторы не имели контрольной группы, однако, согласно предыдущим работам этой же группы ученых, частота пальпируемых узлов среди необлученных пациентов составила не более 0,8—2,7 %.
Данные других исследований, касавшихся изучения этой патологии, были основаны на скрининговом выявлении изменений в щитовидной железе среди лиц, подвергавшихся облучению в относительно больших дозах. Однако большинство .из этих исследований имели методические погрешности и были проведены без контрольной группы. Поэтому полученные оценки риска заболевания являются весьма неопределенными. Кроме того, эти исследования характеризовались низким уровнем участия наблюдаемых в специальных скрининговых программах [55].
Рак щитовидной железы и внутреннее облучение
Имеется значительно меньше сведений об эпидемиологических данных, касающихся развития рака щитовидной железы при внутреннем облучении. В основном они были получены при наблюдении за лицами, подвергшимися воздействию радиоактивных осадков в результате испытания ядерного оружия на Маршалловых островах, и пациентами, подвергшимися облучению 13|1 с терапевтической или диагностической целью.
В 1954 г. более 200 жителей Маршалловых островов подверглись действию радиоактивных осадков при испытании ядерного оружия на атолле Бикини. В результате 77 детей в возрасте до 10 лет, проживавших на островах Утирик и Рон- гелап, получили дозы облучения щитовидной железы |311 в дозах от 60—95 сГр (58 человек) до 8,1 — 11,5 Гр (19 человек). К 1981 г. количество лиц с заболеванием щитовидной железы среди пострадавших детей составило 22. Контрольная группа состояла из родственников (229) облученных, не подлежавших эвакуации с островов. До 1981 г. в контрольной группе заболевания щитовидной железы обнаружены у 6 человек.
Наблюдение за пострадавшими в возрасте старше 10 лет на момент облучения также показало превышение частоты заболеваний щитовидной железы по сравнению с контрольной группой. Доза облучения органа в среднем составила 3,35 Гр [13].
Риск узловых образований в щитовидной железе был наибольшим у детей в возрасте до 10 лет на момент облучения и составил 29 случаев на 1 млн человек/рад в год, а у лиц старше 10 лет — 14 случаев на 1 млн человек/рад в год.
М. Rallison и соавт. [46] провели наблюдение за лицами в возрасте 11 —18 лет, подвергавшимися облучению 1311 в результате испытания ядерного оружия в штатах Невада и Юта. Когорту облученных составили 1378 школьников, родившихся в период наибольшего выпадения радиационных осадков. Контроль был представлен двумя когортами: первая — 1313 детей, посещавших те же школы, что и облученные, но переехавшие в эту местность после периода наибольшего выпадения осадков; вторая — 2140 детей, проживавших в штате Аризона, где радиационные осадки были относительно небольшими. Оценка доз облучения щитовидной железы проводилась ретроспективно и для когорты подвергшихся воздействию радиационных осадков в среднем составила 120 сГр. В результате наблюдения авторы не обнаружили достоверного превышения частоты рака среди облученных. Однако, как отметили J. Boice, С. Land [8], отсутствие прироста частоты рака щитовидной железы и узлов среди 1378 облученных детей могло объясниться тем, что: а) не является биологически эффективным в индукции опухолей щитовидной железы по сравнению с внешним рентгеновским облучением, вероятнее всего потому, что при низких уровнях облучения биологическое восстановление происходит более интенсивно, или же потому, что большая часть энергии бета-частиц реализуется в коллоиде и не достигает фолликулярных клеток; б) фактические дозы облучения щитовидной железы были значительно меньше рассчитанных; в) дети, которые имели серьезные заболевания щитовидной железы, не посещали общественные школы; г) заболевания щитовидной железы наблюдались в избытке среди 14 % школьников, отказавшихся от медицинского осмотра; д) период наблюдения (в среднем 14 лет) между облучением и медицинским осмотром мог быть недостаточным для того, чтобы зарегистрировать избыток изменений в щитовидной железе.
Результаты исследования, проведенного М. Rallison и соавт., были дополнены С. Johnson [33], который изучил заболеваемость раком щитовидной железы среди мормонов, проживавших в 1951 —1962 гг. на территориях юго-западной части штата Юта и отдельных регионах Аризоны и Невады. Когорта облученных состояла из 4125 человек. Контрольная группа была представлена всеми мормонами штата Юта (781 735 человек). Информация о наличии рака щитовидной железы была получена путем интервьюирования наблюдаемых. И хотя результаты показали статистически значимое превышение частоты заболеваний среди облученных, они были подвергнуты критике со стороны J. Lyon и К. Schuman [36], по мнению которых в данном исследовании не в полной мере было учтено влияние систематических ошибок отбора и информации.
Относительно высокий уровень заболеваемости раком щитовидной железы, зарегистрированный в Норвегии, послужил основанием для проведения эпидемиологического исследования с целью оценки возможного влияния облучения 1311, выпавшего с радиоактивными осадками при испытаниях ядерного оружия. Показатели сравнивались с данными других скандинавских стран, в частности Дании. Наибольший показатель заболеваемости раком был установлен у женщин, пребывавших в возрасте 8—18 лет в период наибольшего накопления 1311 в молоке после выпадения радиоактивных осадков. Кумулятивная доза облучения щитовидной железы для этих лиц в среднем составила около 0,02 Гр. Однако, как отмечают сами авторы, это исследование носило описательный характер и поэтому полученные данные не могут служить основой для каких-либо окончательных выводов о связи между заболеваемостью и выпадением 1311.
Результаты изучения влияния терапевтического облучения щитовидной железы радиоизотопами йода на возникновение рака не позволяют установить наличие четкой причинной связи [15, 25, 26, 28, 30, 51]. Так, в исследованиях В. Dobyns и соавт. [15] терапевтические дозы облучения 1311 19 186 пациентов (средний возраст 48 лет), лечившихся по поводу гипертиреоза, составляли около 88 Гр. В течение 8 лет наблюдения учащения случаев рака у облученных пациентов не обнаружено. Последние наблюдения за пациентами, получавшими терапевтическое облучение |311 по поводу гипертиреоза, в Швеции [30] также не показали увеличения частоты рака щитовидной железы. Общее число наблюдавшихся составило 10 552, средняя активность введенного радиоактивного йода в щитовидной железе 506 МБк, период наблюдения 15 лет. Отсутствие увеличения частоты опухолей, по мнению авторов, связано с тем обстоятельством, что дозы облучения были достаточно высокими, и это в результате приводило к гибели клеток железы. Кроме того, на оценку риска определенное влияние могло оказать и то, что период наблюдения за пациентами был все же коротким и практически все больные на момент облучения находились в старшем возрасте.
В течение 8 лет наблюдения учащения случаев рака у облученных пациентов не обнаружено. Последние наблюдения за пациентами, получавшими терапевтическое облучение |311 по поводу гипертиреоза, в Швеции [30] также не показали увеличения частоты рака щитовидной железы. Общее число наблюдавшихся составило 10 552, средняя активность введенного радиоактивного йода в щитовидной железе 506 МБк, период наблюдения 15 лет. Отсутствие увеличения частоты опухолей, по мнению авторов, связано с тем обстоятельством, что дозы облучения были достаточно высокими, и это в результате приводило к гибели клеток железы. Кроме того, на оценку риска определенное влияние могло оказать и то, что период наблюдения за пациентами был все же коротким и практически все больные на момент облучения находились в старшем возрасте.
Таким образом, оценка канцерогенного риска при облучении щитовидной железы |3|1 возможна лишь при наличии низких или умеренных доз облучения, т. е. в случае проведения диагностических процедур. Однако следует при этом учитывать и то, что само состояние щитовидной железы, по поводу которого была проведена диагностика, могло способствовать возникновению рака. К настоящему времени существует немного исследований, касающихся оценки эффектов диагностического облучения железы. Одно из них было проведено в Швеции |27] и представляло собой ретроспективное когортное исследование среди 10 133 пациентов, получивших |3|1 при диагностических процедурах в количестве 2,2 МБк. Все наблюдаемые были лицами старшего возраста и только 5 % из них были в .возрасте до 20 лет. Через 5 лет у 9 пациентов был обнаружен рак щитовидной железы. Однако статистически значимого увеличения частоты заболевания не было отмечено (ожидаемое число случаев для когорты составило 8,3). Исследоавание было продолжено, и группа наблюдаемых составила 35 000 человек [29]. Возрастной состав остался тот же. Приняв во внимание 5-летний латентный период и исключив 31 % наблюдаемых, которые были осмотрены в связи с подозрением на рак щитовидной железы, исследователи обнаружили 16 случаев рака по сравнению с 25,8 ожидаемыми.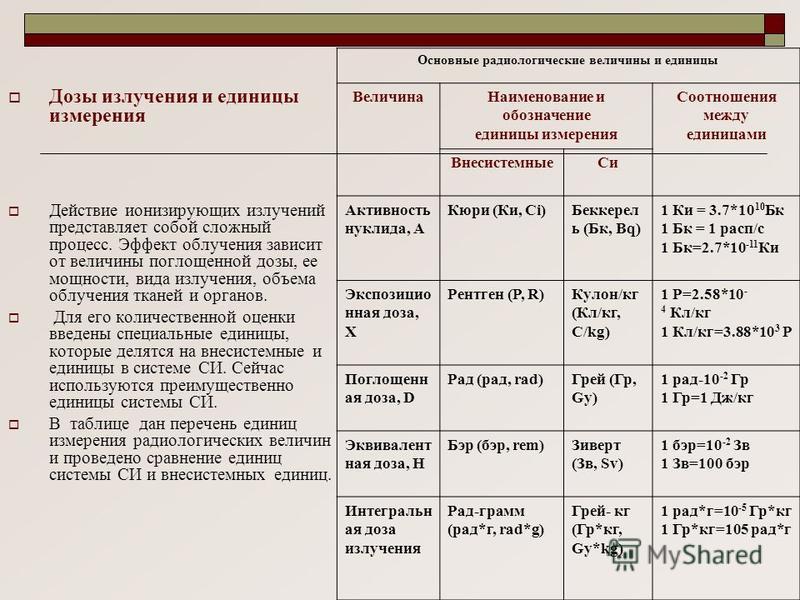 Несмотря на то что относительный риск для пациентов, облученных в возрасте до 20 лет, составил 1,8, статистическая мощность исследования для установления значимого увеличения частоты рака среди молодых пациентов была низкой.
Несмотря на то что относительный риск для пациентов, облученных в возрасте до 20 лет, составил 1,8, статистическая мощность исследования для установления значимого увеличения частоты рака среди молодых пациентов была низкой.
Рак щитовидной железы и облучение от техногенного и природного радиационного фона
Наряду со сведениями о радиационно обусловленном раке щитовидной железы, основанными на результатах наиболее серьезных эпидемиологических исследований, определенный интерес могут представлять данные исследований, касающихся облучения населения, проживающего на территориях, прилегающих к местам ядерного производства, а также с повышенным природным радиационным фоном.
Одним из таких исследований было изучение заболеваемости раком щитовидной железы среди населения, проживавшего поблизости Денвера, штат Колорадо. Исследование носило характер экологического. Население, подлежавшее изучению, было разделено на 4 группы в зависимости от плотности загрязнения местности радионуклидами плутония. Проживающие на наиболее загрязненной территории с наибольшей плотностью загрязнения 1800—30 МБк/км составили 1-ю группу, с плотностью 30—7 МБк/км — 2-ю группу, 7— 3,7 МБк/км — 3-ю группу и <3,7 МБк/км — 4-ю группу, выбранную в качестве контрольной. Сравнение показателей заболеваемости не обнаружило статистически значимых различий. Другим, подобным исследованием было изучение смертности от рака щитовидной железы, проведенное Н. Sauer среди населения, проживавшего поблизости с ядерным заводом Саванна Ривер (штат Южная Каролина). В этом исследовании население, подлежавшее изучению, было разделено на 4 группы в зависимости от расстояния между местом проживания и заводом. Статистически значимых различий в заболеваемости также не установлено.
Основываясь на данных одного из наиболее крупного популяционного канцер-регистра штата Коннектикут (США), который содержит информацию о злокачественных новообразованиях с 1935 г., С. Walter и соавт. [58] изучили заболеваемость раком щитовидной железы среди населения, проживающего в населенных пунктах с повышенным природным радиационным фоном.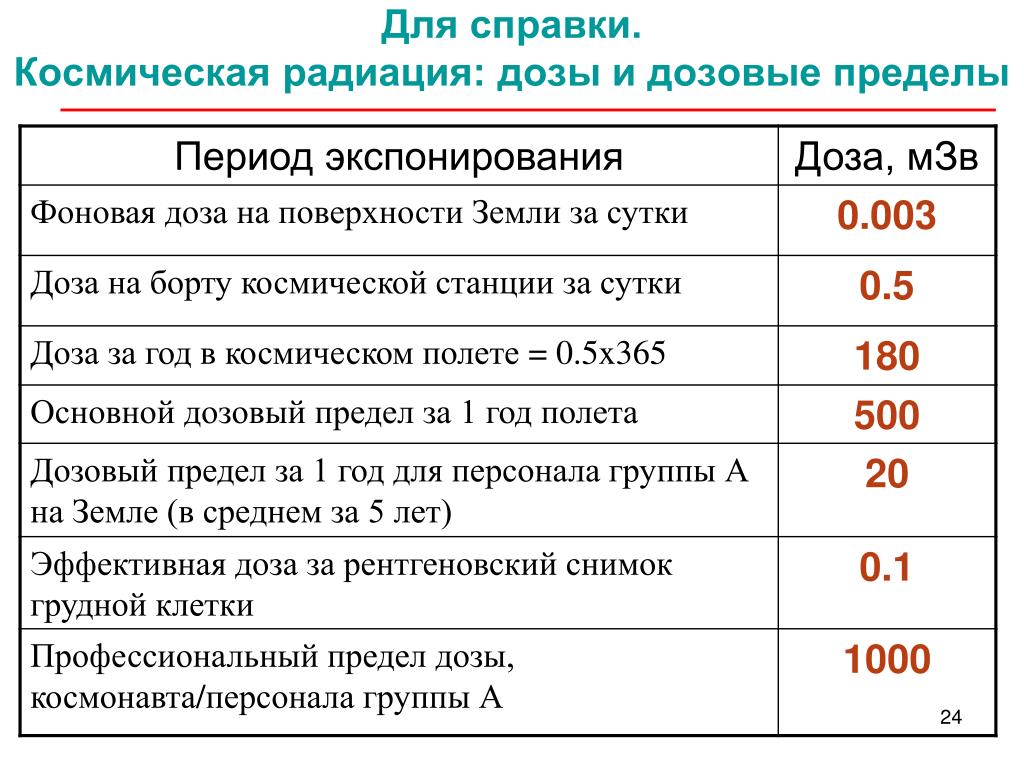 Общая численность населения в этом исследовании составила около 3 млн. человек. Значение мощности гамма-фона находилось в пределах 0,38—0,85 мГр/год. В результате 9-летнего наблюдения (1965—1974) было установлено увеличение заболеваемости раком среди женщин. Однако в силу относительно низкой вариабельности в уровнях мощности гамма-фона и наличия других неконтролированных переменных, таких, как механическая миграция населения, полученные результаты не позволили установить связь роста заболеваемости с облучением.
Общая численность населения в этом исследовании составила около 3 млн. человек. Значение мощности гамма-фона находилось в пределах 0,38—0,85 мГр/год. В результате 9-летнего наблюдения (1965—1974) было установлено увеличение заболеваемости раком среди женщин. Однако в силу относительно низкой вариабельности в уровнях мощности гамма-фона и наличия других неконтролированных переменных, таких, как механическая миграция населения, полученные результаты не позволили установить связь роста заболеваемости с облучением.
Подобное исследование несколько позднее было проведено во Франции. Исследователи провели сравнительный анализ смертности от рака щитовидной железы населения, проживающего в регионах с повышенным и нормальным (в целом по стране) уровнем гамма-фона. Мощность гаммафона в изучаемом регионе составляла 0,9—1,15 мГр/год, тогда как в сравниваемом — около 0,6 мГр/год. Расчет стандартизованного отношения смертности показал отсутствие достоверных различий в смертности среди мужского населения и статистически значимое превышение смертности в изучаемых регионах среди женского населения. Комментируя данный факт, авторы считают, что некоторые локальные, эндемические характеристики регионов, подлежавших изучению, помимо природного радиационного фона, с могли оказать влияние на повышение показателя смертности женщин от рака и требуют отдельного изучения.
Изучение распространенности опухолей щитовидной железы было проведено и в Индии, штате Керала, известном высоким уровнем природного радиационного фона [44]. Изучаемая группа включала 12 936 человек, проживающих в условиях мощности гамма-фона 6,4 мГр/год. Контрольная популяция была отобрана на сопредельных территориях, где гамма-фон составлял около 1 мГр/год. Около 95 % семей проживали на данных территориях много поколений. Обнаружено снижение частоты встречаемости патологии щитовидной железы среди облученных.
Аналогичные данные были получены в Китае [59], где группу облученных составила 1001 женщина в возрасте 50—65 лет, проживающая на территории с уровнем природного гамма-фона 3,3 мГр/год, и контрольную — 1005 женщин, экспонированных к гамма-фону 1,14 мГр/год. Кумулятивные дозы облучения щитовидной железы были оценены на уровне 14 и 5 сГр соответственно. Анализ полученных результатов указал на отсутствие различий в содержании гормонов щитовидной железы и частоте узловых образований. Однако женщины, проживающие в регионах с высоким природным фоном, имели значительно меньшие концентрации йода в моче и большую частоту устойчивых и неустойчивых хромосомных аберраций в лимфоцитах крови. В исследуемой группе было также обнаружено повышенное потребление чеснока и лука, что, согласуясь с экспериментальными данными [6], по мнению авторов, могло способствовать понижению риска возникновения узлов в щитовидной железе.
Кумулятивные дозы облучения щитовидной железы были оценены на уровне 14 и 5 сГр соответственно. Анализ полученных результатов указал на отсутствие различий в содержании гормонов щитовидной железы и частоте узловых образований. Однако женщины, проживающие в регионах с высоким природным фоном, имели значительно меньшие концентрации йода в моче и большую частоту устойчивых и неустойчивых хромосомных аберраций в лимфоцитах крови. В исследуемой группе было также обнаружено повышенное потребление чеснока и лука, что, согласуясь с экспериментальными данными [6], по мнению авторов, могло способствовать понижению риска возникновения узлов в щитовидной железе.
Сравнение канцерогенных эффектов облучения щитовидной железы при внешнем и внутреннем 1311-облучении
Поскольку оценки биологической эффективности 1311 по сравнению с острым облучением рентгеновскими лучами могут находиться в интервале от 0,1 до 1 [10, 16, 35] и основываются главным образом на экспериментальных данных, вопрос о сравнительной канцерогенности внутреннего и внешнего облучения щитовидной железы человека требует дальнейшего изучения.
Обобщив имеющийся опыт, НКРЗ США [31] приняла фактор эффективности для 1311, составляющий не более чем 1/з- Вместе с тем Комитет по биологическим эффектам радиации Академии наук США (БЭИР) в докладе V сообщает, что отношение рисков рака при внутреннем облучении щитовидной железы радионуклидом 1311 и облучении рентгеновскими лучами составило 0,66 с 95 % доверительным интервалом 0,14—3,15 [23].
Характер кривой доза — эффект и прогнозирование рака радиоиндуцированного рака щитовидной железы
Несмотря на то что к настоящему времени проведено достаточно большое количество исследований радиационно обусловленного рака щитовидной железы, лишь отдельные из них позволяют судить о характере кривой доза — эффект. По мнению R. Shore и соавт. [55], такими исследованиями являются проспективное наблюдение за лицами, подвергшимися терапевтическому облучению в связи с увеличением тимуса, наблюдение за пострадавшими в результате бомбардировок в Японии и наблюдения за пациентами, подвергшимися терапевтическому облучению по поводу стригущего лишая в Израиле, где количество наблюдаемых и диапазон доз облучения были достаточными для оценки кривой доза — эффект. Результаты же других исследований имеют серьезные ограничения, которые в первую очередь сводятся [/ к небольшому диапазону рассматриваемых доз облучения, количеству наблюдаемых, относительно коротким срокам наблюдения и зачастую требуют более адекватных дозовых оценок.
Результаты же других исследований имеют серьезные ограничения, которые в первую очередь сводятся [/ к небольшому диапазону рассматриваемых доз облучения, количеству наблюдаемых, относительно коротким срокам наблюдения и зачастую требуют более адекватных дозовых оценок.
Наблюдения R. Shore и соавт. [55] свидетельствуют о четкой линейной зависимости между дозой облучения и частотой возникновения опухолей. К аналогичным выводам пришли и Е. Ron, В. Modan [50]. Авторы не обнаружили какого-либо статистически значимого подтверждения в пользу нелинейности зависимости. Вместе с тем, учитывая, что диапазон доз в данном исследовании был все-таки уже по сравнению с приведенными выше, авторы могли и не обнаружить нелинейность, если даже она на самом деле существует.
В связи с тем что ни одна когорта облученных не была полностью прослежена в течение их жизни, временная оценка риска рака щитовидной железы является затруднительной. Имеющиеся литературные данные о развитии радиационно индуцированного рака щитовидной железы у человека позволяют предположить, что минимальный латентный период развития опухоли после облучения может составлять приблизительно 5 лет [47, 53, 54]. Максимальный же период в настоящее время четко не определен. Так, G. Beebe и соавт. [5], основываясь на результатах японских исследований, пришли к выводу, что повышение риска развития рака может сохраняться до 30 лет после облучения. A. Schneider и соавт. [53] указывают на более чем 34-летний период развития опухоли. Эти данные согласуются с результатами наблюдения за пациентами, облученными с терапевтической целью по поводу увеличения тимуса, и с оценками, приведенными в работе [20]. В последнее время на основании результатов отдельных исследований высказано предположение о существовании в течение 50 лет и даже более избытка риска возникновения рака облученных [56].
Поскольку уровни заболеваемости раком щитовидной железы увеличиваются с возрастом, важным является выбор наиболее подходящей модели в оценке прогноза. Как известно, в настоящее время для этого используются две модели — абсолютного и относительного риска [9]. По мнению С. Land [34], при сравнении риска между популяциями модель абсолютного риска является более предпочтительной, тогда как для прогноза частоты заболевания в пределах одной популяции более подходящей будет модель относительного риска. В последние годы становится все более очевидным, что даже по истечении необходимого латентного периода абсолютный риск для большинства видов рака непостоянный во времени. Подобное предположение сделано и в отношении относительного риска для некоторых солидных опухолей [45]. Следовательно, если учесть эти обстоятельства, то, как отмечает автор, действительной разницы между двумя моделями нет и в таком случае выбор той или иной модели должен зависеть от поставленной цели.
Как известно, в настоящее время для этого используются две модели — абсолютного и относительного риска [9]. По мнению С. Land [34], при сравнении риска между популяциями модель абсолютного риска является более предпочтительной, тогда как для прогноза частоты заболевания в пределах одной популяции более подходящей будет модель относительного риска. В последние годы становится все более очевидным, что даже по истечении необходимого латентного периода абсолютный риск для большинства видов рака непостоянный во времени. Подобное предположение сделано и в отношении относительного риска для некоторых солидных опухолей [45]. Следовательно, если учесть эти обстоятельства, то, как отмечает автор, действительной разницы между двумя моделями нет и в таком случае выбор той или иной модели должен зависеть от поставленной цели.
В докладах НКРЗ [31] и НКДАР ООН [57] оценки риска возникновения рака щитовидной железы у лиц, подвергшихся облучению этого органа, основаны на модели абсолютного риска. В то же время БЭИР V [23] использовал модель относительного риска. Согласно оценкам НКРЗ США/НКДАР ООН, увеличение абсолютного риска для лиц в возрасте до 18 лет за год составляет 2,5 случая на 10 000 человек, облученных в дозе 1 Гр. Для учета половых различий в оценках риска НКРЗ США рекомендует умножать избыток абсолютного риска на 4/з для женщин и на 2/з для мужчин. Увеличение абсолютного риска для лиц старше 18 лет составляет половину такового для лиц до 18 лет, т. е. 1,68-10000 человеко-лет-Гр для женщин и 0,84-10 000 человеко-лет-Гр для мужчин.
Основываясь на модели относительного риска, прирост на 1 Гр для лиц в возрасте до 18 лет на момент облучения составляет 7,3, старше 18 лет — 3,65.
Таким образом, проведенный анализ данных литературы свидетельствует о том, что, несмотря на достаточно большой объем имеющихся результатов эпидемиологических исследований канцерогенных эффектов облучения щитовидной железы, существует немало вопросов, требующих дальнейшего детального изучения. В целом они могли бы быть сведены к получению более полной информации о канцерогенной роли облучения щитовидной железы лиц молодого возраста 3‘1 в умеренных дозах. В этой связи проведение эпидемиологических исследований среди населения, подвергшегося облучению в результате аварии на ЧАЭС, приобретает особую актуальность.
В целом они могли бы быть сведены к получению более полной информации о канцерогенной роли облучения щитовидной железы лиц молодого возраста 3‘1 в умеренных дозах. В этой связи проведение эпидемиологических исследований среди населения, подвергшегося облучению в результате аварии на ЧАЭС, приобретает особую актуальность.
1. Ледощук Б. А. // Проблемы радиационной медицины.— Киев, 1991,— С. 87—91.
2. Романенко А. Е., Лихтарев И. А., Шандала Н. К- и др. // Мед. радиол.— 1991.— № 2.— С. 41—49.
3. Шандала Н. К., Гулько Г. М., Кайро И. А. // Медицинские последствия аварии на Чернобыльской атомной электростанции: Информ, бюл.— Киев, 1991.— С. 100—105.
4. Albert R. Е., Omran A. R. // Arch. Environm. Hlth.— 1968,- Vol. 17, N 7,- P. 899-918.
5. Beebe G. W., Kato H., Land С. E. 11 Radiat. Res.— 1977,— Vol. 75.— P. 138—201.
6. Belman S. 11 Carcinogenesis.— 1983.— Vol. 8.— P. 1063— 1065.
7. Block M. A., Miller M. J., Horn R. C. Jr. et al. // Amer. J. Surg.— 1969,— Vol. 118,— P. 764—769.
8. Boice J. D., Land С. E. // Cancer Epidemiology and Prevention / Ed. D. Schottenfeld.— Philadelphia, 1982.— P. 231—253.
9. Breslow N. E., Day N. E. Statistical Methods in Cancer Research: The Analysis of Case-Control Studies. Vol. 1. (IARC Scient. Publ. N 32).— Lyon, 1980.
Vol. 1. (IARC Scient. Publ. N 32).— Lyon, 1980.
10. Chrisiov K. // Cancer Res.— 1975.— Vol. 35,— P. 1256— 1262.
11. Clark D. E. // J. A. M. A.— 1955,— Vol. 159.— P. 1007— 1009.
12. Conard R. A. // Radiation-Associated Thyroid Carcinoma / Ed. L. DeGroot.— New York, 1977.— P. 241—257.
13. Conard R. A. // Radiation Carcinogenesis: Epidemiology and Biological Significance / Eds J. D. Boice Jr., J. R. Fraumeni Jr.— New York, 1984.— P. 57—71.
14. DeGroot L., Paloyan E. // J. A. M. A.— 1973.— Vol. 225, N 5,— P. 487—491.
15. Dobyns В. M., Sheline G. E., Workman J. B. et al. // J. clin. Endocr.— 1974.— Vol. 38, N 6,— P. 976—998.
16. Doniach I. // Hlth Phys.— 1963,— Vol. 9, N H.- Р. 1357—1362.
17. Duffy B. J., Fitzgerald P. J. // Cancer (Philad.).— 1950,— Vol. 3,— P. 1018—1032.
18. Favus M. J., Schneider A. B., Stachura M. E. et al. // New Engl. J. Med.— 1976,— Vol. 294, N 19,— P. 1019— 1024.
19. Fetterman G. H. // Amer. J. Dis. Child.— 1956.— Vol. 92.— P. 581—587.
20. Fogelfeld L., Nivioti M. В. T., Shore-Freedman E. et al. // New Engl. J. Med.— 1989.— Vol. 320, N 13,— P. 835—840.
21. Greenspan F. S. // J. A. M. A.— 1977,— Vol. 237, N 19.— P. 2089-2091.
22. Harness J. K-, Thompson N. W., Nishiyama R. H. // Arch. Surg.— 1971.— Vol. 102.— P. 278—284.
23. Health Effects of Exposure to Low Levels of Ionizing Radiation (BEIR V).— Washington, 1990.
24. Hempelmann L. H., Hall W. J., Phillips M. et al. // J. nat. Cancer Inst.— 1975.— Vol. 55.— P. 519—530.
25. Hoffman D. A. // Radiation Carcinogenesis: Epidemiology and Biological Significance / Eds J. D. Boice Jr., J. F. Fraumeni Jr.— New York, 1984.— P. 273—280.
26. Holm L. E., Dahlqvist Israellson A., Lundell G. // New Engl. J. Med.— 1980,— Vol. 303, N 4,— P. 188—191.
27. Holm L. E., Lundell G., Walinder G. // J. nat. Cancer Inst.— 1980,- Vol. 64, N 5,- P. 1055-1059.
28. Holm L. E. // Radiation Carcinogenesis: Epidemiology and Biological Significance / Eds J. D. Boice, Jr., J. F. Fraumeni, Jr.— New York, 1984,— P. 263—272.
29. Holm L. E., Wiklund K., Lundell G. et al. // J. nat. Cancer Inst.— 1988.— Vol. 80.— P. 1132—1138.
30. Holm L. E., Hall P„ Wiklund K. et al. // Ibid.— 1991 — Vol. 83, N 15.— P. 1072—1077.
31. Induction of Thyroid Cancer by Ionizing Radiation: Recommendation of the National Council on Radiation Protection and Measurements (NCRP Report N80).— Bethesda, 1985.
32. Jablon S., Tachikawa K., Belsky J. L. // Lancet.— 1971.— Vol. 1,— P. 927—931.
33. Johnson C. J. 11 J. A. M. A.— 1984,— Vol. 251,— P. 230— 236.
34. Land С. E. // Risk Estimates for Radiation Carcinogenesis.— Bad Munstereifel, 1990,— P. 42—49.
35. Lee W., Chiacchierini R. P., Shleien B., Telles N. C. // Radiat. Res.— 1982,— Vol. 92, N 2 — P. 307—319.
36. Lyon J. L„ Schuman K. L. 11 J. A. M. A — 1984,— Vol. 252.— P 1855
37. Maxon H. R. 11 Med. Clin. N. Amer.— 1980.— Vol. 69.— P. 1049—1041.
38. Miller R. W. // Nat. Cancer Inst. Monogr.— 1972.— Vol. 49, N 52,— P. 1221-1227.
39. Miller R. W.. Boice J. D. 11 Radiation Carcinogenesis / Eds A. C. Upton et al.— New York, 1986,— P. 381—386.
40. Modan B., Baidatz D., Mart H. et al. // Lancet.— 1974.— Vol. 1, N 2,— P. 277-279.
41. Modan B., Ron E., Werner A. 11 Radiology.— 1977.— Vol. 123, N 3,- P. 741-744.
42. Modan B., Gheirit A., Alfandary E., Katz L. // Lancet.— 1989,— Vol. 1, N 8639,— P. 629.
43. Parker L. N., Belsky J. L., Yamamoto T. et al. // Ann. intern. Med.— 1974,— Vol. 80, N 5,— P. 600—604.
44. Pillai N. K., Thangavelu M., Ramalingaswami V. // Indian J. med. Res.— 1976.— Vol. 64,— P. 537—544.
45. Preston D. // Radiat. Res.— 1990.— Vol. 124.— P. 343— 343.
46. Rallison M. L., Dobyns В. M., Keating F. R. et al. // Amer. J. Med.— 1974,— Vol. 56, N 4,— P. 457—463.
47. Ron E., Modan B. // J. nat. Cancer Inst.— 1980.— Vol. 65,— P. 7—11.
48. Ron E., Modan B. // Cancer Epidemiology and Prevention / Eds D. Schottenfeld, F. Fraumeni.— Philadelphia, 1982.— P. 837—854.
49. Ron E., Modan В. 11 Radiation Carcinogenesis: Epidemiology and Biological Significance / Eds J. D. Boice, Jr., J. F. Fraumeni, Jr.— New York, 1984,— P. 139—151.
50. Ron E., Modan B., Preston D. et al. // Radiat. Res.— 1989,— Vol. 120,— P. 516—531.
51. Safa A. M., Schumacher О. P., Rodriguez-Antunez A. // New Engl. J. Med.— 1975.— Vol. 292,— P. 167—171.
52. Sampson R. J., Key C. R., Buncher C. R., lijima S. // J. A. M. A.— 1969,- Vol. 209,- P. 65-70.
53. Schneider A. B., Favus M. J., Statchura M. E. et al. // Amer. J. Med.— 1978.— Vol. 64,— P. 243—252.
54. Shore R. E., Woodard E. D., Pasternack B. S. et al. // Hlth Phys.— 1980,— Vol. 38,— P. 451—465.
55. Shore R. E., Woodard E., Hildreth N. et al. // J. nat. Cancer Inst.— 1985,— Vol. 74, N 6,— P. 1177—1184.
56. Shore R. E. // Radiat. Res.— 1992,— Vol. 131.—P. 98—111.
57. Sources, Effects and Risks of Ionizing Radiation. UNSCEAR Report.— New York, 1988.
58. Walter C. D., Meigs J. M., Heston J. F. // Amer. J. Epidem.— 1986,— Vol. 123, N 1— P. 1 — 13.
59. Wang Z.. Boice J. D., Wei L. et al. // J. nat. Cancer Inst.— 1990,— Vol. 82, N 6,— P. 478—485.
60. Wilson E. H., Asper S. P. Jr. // Arch, intern. Med.— I960,- Vol. 105,- P. 244-250.
61. Wilson G. M., Kilpatrick R., Eckert H. et al. // Brit. med. J.— 1958 — Vol. 2.— P. 929—934.
62. Winship T.. Rosvoll R. V. // Tumors of the Thyroid
Методика определения эффективной дозы внешнего облучения населения, проживающего на территории с техногенно измененным радиационным фоном Текст научной статьи по специальности «Физика»
РАДИОЭКОЛОГИЯ И РАДИАЦИОННЫЙ КОНТРОЛЬ
МЕТОДИКА ОПРЕДЕЛЕНИЯ
ЭФФЕКТИВНОЙ ДОЗЫ ВНЕШНЕГО ОБЛУЧЕНИЯ НАСЕЛЕНИЯ, ПРОЖИВАЮЩЕГО НА ТЕРРИТОРИИ С ТЕХНОГЕННО ИЗМЕНЕННЫМ РАДИАЦИОННЫМ ФОНОМ
А.В. Хотулёва
Экологический факультет Российский университет дружбы народов Подольское шоссе, 8/5, Москва, Россия, 113093
Предложена методика расчета годовой эффективной дозы внешнего облучения населения по результатам прямых измерений мощности дозы излучения с многократными независимыми наблюдениями.
Ключевые слова: эффективная доза, внешнее облучение, радиационный фон, мощность дозы, цезий-137.
Для населения, проживающего на радиоактивно загрязненной территории, одним из факторов радиационного воздействия является внешнее облучение фотонным излучением, испускаемым радионуклидами.
Результаты радиационного контроля радиоактивно загрязненной территории показали, что население подвергается хроническому внешнему облучению в малых дозах. При облучении организма в малых дозах (не более 25 сЗв) воздействие радиационного фактора принято оценивать по значению эффективной дозы [1—2].
Эффективная доза равна сумме эквивалентных доз в 12 наиболее радиочувствительных органах и тканях человека, «взвешенных» с определенными тканевыми коэффициентами WТ, показывающими проявление рака в той или иной форме при оценке суммарного риска смерти от рака в результате облучения. Значения коэффициентов WТ для различных органов и тканей приведены в [1]. При равномерном облучении всего тела, что характерно для проживания населения на радиоактивно загрязненной местности, сумма коэффициентов WТ равна 1.
Цезий-137 является бета-гамма-излучающим радионуклидом. Согласно [1] взвешивающий коэффициент излучения WR для гамма-излучения равен 1.
Введение понятия эффективной дозы породило ряд проблем при организации радиационного контроля. Главная проблема заключается в том, что эту величину принципиально нельзя измерить, так как для этого необходимо измерить дозу
в разных частях тела человека. При этом значения дозы излучения требуется соотносить с разными значениями тканевых коэффициентов ЖТ, также, в свою очередь, зависящих от энергии излучения. В то же время эффективную дозу можно рассчитать на основании данных о мощности дозы излучения и продолжительности облучения. В случае только внешнего гамма-облучения всего организма эффективная доза Е может быть определена из зависимости
Е =
КНЕНТ КШЬ Т КХЕХТ
к ,Е Н *(10) т,
(1)
Е ‘
где КНЕ, Кш, КХЕ, К*Е — коэффициент перехода к эффективный дозе от эквивалентной, поглощенной в воздухе, экспозиционной и амбиентной доз соответственно; Н *(10) — мощность амбиентного эквивалента дозы (мощность амбиентной дозы).
Числовое значение коэффициентов КНЕ, КЛЕ, КХЕ, К*Е зависит от вида и энергии излучения, а также от геометрии облучения. В [1] приведены значения коэффициентов перехода от кермы (поглощенной дозы) в воздухе к эффективной дозе для широкого диапазона энергий излучения и двух наиболее вероятных геометрий облучения: для фронтального облучения человека (облучение параллельным пучком в передне-задней геометрии) как наиболее опасного и для облучения в изотропном поле (2п или 4п) как наиболее часто реализуемом. Можно было бы рассчитать эффективную дозу с запасом по максимуму для фронтального облучения. Однако ужесточение пределов доз облучения приводит к тому, что оценка с большим запасом вынуждает накладывать ограничения на деятельность населения, что в свою очередь приводит к необоснованным дополнительным финансовым затратам. Следовательно, значения коэффициентов КНЕ, Кш, КХЕ, К*Е будем находить для условия облучения населения, находящегося на открытой радиоактивно загрязненной местности, как находящегося в изотропном поле излучения.
В таблице 1 приведены средние значения коэффициентов перехода от эквивалентной, поглощенной и экспозиционной доз излучения к эффективной дозе для энергии гамма-фотонов 0,66—1 МэВ в случае изотропного облучения взрослого населения. Значения коэффициентов систематизированы по данным работ [1; 3—9; 12—15; 17].
Таблица 1
Коэффициент перехода от амбиентной, эквивалентной, поглощенной и экспозиционной доз к эффективной дозе излучения (изотропное поле излучения)
Единица измерения дозы излучения
эффективной эквивалентной, амбиентной поглощенной в воздухе экспозиционной
Зв мЗв мкЗв Гр мГр мкГр * р Г н Р мР мкР
Зв 1 1 10-3 1 10-6 0,7 0,7 10-3 0,7 10-6 0,7 10-9 6,1 10-3 6,1 10-6 6,1 10-9
мЗв 1 1 10-3 0,7 0,7 10-3 0,7 10-6 6,1 6,1 10-3 6,1 10-6
мкЗв 1 0,7 0,7 10-3 6,1 103 6,1 6,1 10-3
нЗв 0,7 6,1 106 6,1 103 6,1
-9
*н (нано-) имеет множитель 10 .
При расчете дозы излучения на местности, загрязненной радионуклидами цезия и стронция, в [17] с учетом публикаций Международной Комиссии по радиологической защите № 60, 67 и 74 рекомендуется использовать следующие значения КОЕ:
[0,75 мЗв/мГр — для взрослого населения;
°Е [0,85 мЗв/мГр — для детей.
Единицы измерения коэффициентов перехода зависят от единицы измерения мощности дозы излучения и соответствующей единицы эффективной дозы (Зв или дольная единица: мЗв, мкЗв). Например, если измерена мощность экспозиционной дозы излучения X, мкР/ч и потребуется получить значение эффективной дозы в мкЗв/ч, то формула (1) примет вид
Е = КхЕХТ, (2)
где КХЕ — коэффициент перехода от экспозиционной дозы к эффективной; согласно
_3
табл. 1 он равен 6,1-10 мкЗв/мкР.
Годовая эффективная доза внешнего облучения Е жителей населенного пункта определяется по результатам измерений мощности дозы гамма-излучения в жилых и общественных зданиях, а также на открытой местности на территории населенного пункта и рассчитывается по формуле
Е = Еот +ЕзД, (3)
где Еот, Езд — эффективная доза излучения, получаемая на открытой местности и в жилых (общественных) зданиях.
Эффективная доза излучения, получаемая на открытой местности Еот равна
Еот = КРЕРотТот’ (4)
где КРЕ — коэффициент перехода от эквивалентной (амбиентной, поглощенной, экспозиционной) дозы к эффективной дозе; Рот — среднее значение за период облучения мощности эквивалентной (поглощенной, экспозиционной) дозы гамма-излучения на открытой местности населенного пункта, обусловленное техногенным загрязнением; Тот — время нахождения жителей на открытой местности.
Эффективная доза излучения, получаемая в зданиях равна
Езд = КРЕ РздТзд. (5)
Время пребывания жителей на открытой местности так и в зданиях найдем из зависимостей:
Тот = «от Т; (6)
Тзд = «зд Т, (7)
где аот, азд — доля времени нахождения жителей на открытой местности и в помеще-
ниях соответственно.
Для городских жителей (поселка городского типа) доля времени нахождения на открытой местности и в зданиях равна [5]
[0,2 — на открытой местности;
а =
0,8
в помещениях.
Подставив формулы (4) и (5—8) в (3), получим
Е = 0,2 КРЕР Т + 0,8КреРздТ.
После приведения имеем
Е = К Т(0,2Р + 0,8Р
РЕ \ от :
Е = 0,2 КрЕТ (Ро, + 4 Р,д).
зд
(8)
(9)
(10)
(11)
В формуле (11) мощность дозы гамма-излучения на открытой местности Рот и в помещениях Рзд должна определяться только с учетом воздействия техногенного загрязнения, т.е. за вычетом природного гамма-фона на обследуемой территории Рф. С учетом этого формула (11) по расчету годовой эффективной дозы примет вид
Е = 0,2 К„Т
Ротиз Рф ) + 4 (Рздиз Рф )
(12)
где Т — продолжительность облучения в течение года (число часов в году), Т = 8800 ч; Рот из, Рзд из — среднегодовая мощность дозы гамма-излучения на открытой местности, измеренная на высоте 1 м над поверхностью почвы и в помещении соответственно.
После подстановки значения продолжительности облучения в течение года и приведения имеем
Е = 1,76 -103КрС [( — Рф) + (Рздиз — Рф )
(13)
При отсутствии результатов измерений в помещениях годовую эффективную дозу найдем из выражения
Е = 1,76 -103 КР]
(
К
\ осл
ф
(14)
где Ко
коэффициент ослабления гамма-излучения зданием.
Коэффициент ослабления гамма-излучения зданием (помещением) может быть рассчитан теоретически исходя из конструктивных особенностей сооружения, энергии гамма-фотонов и геометрии облучения помещения, или заимствован из справочной литературы [7; 9].
Коэффициент ослабления гамма-излучения зданием зависит от его типа (табл. 2). Подвальные помещения и защитные сооружения обладают лучшими защитными свойствами.
Таблица 2
Коэффициент ослабления гамма-излучения жилыми, административными и производственными зданиями [7]
Тип здания (помещения) Число Среднее
измерении значение Косл
1. Административные четырехэтажные кирпичные здания:
первый этаж 3 7,2 ± 2
второй этаж 3 11,2 ± 3
третий этаж 3 11,2 ± 3
четвертыи этаж 3 10 ± 3
2. Жилые двухэтажные кирпичные дома:
первый этаж 18 17 ± 3
торой этаж 3 11 ± 3
3. Жилые одноэтажные рубленые деревянные дома: — 2,0 ± 1,0
В формулы (11—14) входят значения мощности дозы излучения, которые получают путем выполнения прямых измерений с многократными независимыми наблюдениями. При статистической обработке группы результатов наблюдений согласно [10—11] необходимо выполнить следующие операции:
— исключить известные систематические погрешности из результатов наблюдений;
— вычислить среднее арифметическое исправленных результатов наблюдений;
— вычислить оценку среднего квадратического отклонения результатов наблюдений;
— проверить предположение о том, что результаты наблюдений принадлежат нормальному распределению случайной величины;
— вычислить доверительные границы случайной погрешности результата измерения;
— вычислить границы неисключенной систематической погрешности результата измерения;
— вычислить доверительные границы погрешности результата измерения. Технические средства радиационного контроля должны быть поверены и допущены к проведению измерений. Погрешность технических средств радиационного контроля не должна превышать ±20—30%.
ЛИТЕРАТУРА
[1] Нормы радиационной безопасности (НРБ-99/2009): Санитарно-эпидемиологические правила и нормативы. — М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2009.
[2] Основные санитарные правила обеспечения радиационной безопасности (ОСПОРБ-99): санитарные правила СП 2.6.1.799-99. — М.: Минздрав России.
[3] Порядок заполнения и ведения радиационно-гигиенических паспортов организаций и территорий: Методические указания МУ-177-112 (Утв. Заместителем Главного государственного санитарного врача Российской Федерации 30.12.1997).
[4] Гигиенические требования по ограничению облучения за счет природных источников ионизирующего излучения: санитарные правила СП 2.6.1.1292-03. — М.: Минздрав России.
[5] Оценка индивидуальных эффективных доз облучения населения за счет природных источников ионизирующего излучения: Методические указания МУ 2.6.1.1088—02. — М.: ФЦ ГСЭН Минздрава России, 2002.
[6] Санитарные правила по обеспечению радиационной безопасности на объектах нефтегазового комплекса России: санитарные правила СП 2.6.1.1291-03. — М.: Минздрав России, 2003.
[7] Оценка поглощенных и эффективных доз ионизирующих излучений у населения, постоянного проживающего на радиоактивных следах атмосферных ядерных взрывов: методические указания МУ 2.6.1.1001-00. — М.: ФЦ ГСЭН Минздрава России, 2001.
[8] Моисеев А.А., Иванов В.И. Справочник по дозиметрии и радиационной гигиене. — 4-е изд., перераб. и доп. — М.: Энергоатомиздат, 1990.
[9] Методические указания для разработки мероприятий по защите населения в случае аварии ядерного реактора: сборник правил и норм по радиационной безопасности в атомной энергетике. Т. 2. — М.: Минздрав, 1989.
[10] Рекомендация. Методики радиационного контроля. Общие требования: МИ 2453-2000. — Менделеево, 2000.
[11] ГОСТ 8.207-76. Прямые измерения с многократными наблюдениями. Методы обработки результатов наблюдений. — Введ. 01.01.1977; переиздание. — М.: Изд-во стандартов, 1979 (Государственная система обеспечения единства измерений).
[12] Проведение радиационно-гигиенического обследования жилых и общественных зданий: Методические указания МУ 2.6.1.715-98. — М.: ФЦ ГСЭН Минздрава России, 1998.
[13] Федоров Г.А. Оценка радиационной обстановки по результатам гамма-спектрометрического обследования местности // АНРИ. — 1996/97. — № 4. — С. 24—33.
[14] Прокофьев О.Н., Ершов Э.Б., Смирнов О.А., Ломов О.П. Определение условий безопасной работы с точечным источником гамма-излучения // Военно-медицинский журнал. — 2001. — № 5. — С. 52—56.
[15] Данные для использования при защите от внешнего излучения: Публикация 51 МКРЗ. — М.: Энергоатомиздат, 1993.
[16] Определение индивидуальных эффективных и эквивалентных доз и организация контроля профессионального облучения в контролируемых условиях обращения с источниками излучения. Общие требования: методические указания МУ 2.6.1.016-2000. — М.: ВНИИФТРИ, 2001.
[17] Прогноз доз облучения населения радионуклидами цезия и стронция при их попадании в окружающую среду: методические указания МУ 2.6.1.2222-07. — М.: ФЦ ГСЭН Минздрава России, 2008.
METHODS OF EFFECTIVE DOSE DEFINITION OF THE EXTERNAL IRRADIATION OF THE POPULATION, LIVING IN TERRITORY WITH TECHNOGENETICAL CHANGED RADIATING BACKGROUND
А.V. Khotuleva
Ecological Faculty Peoples’ Friendship University of Russia
Podolskoye shosse, 8/5, Moscow, Russia, 113093
Methods of annual efficient dose calculation of the external irradiation of the population is offered on result of the direct measurements to powers of the dose of the radiation with frequentative independent observations.
Key words: effective dose, external irradiation, radiating background, powers of the dose, caesium-137.
CDC Радиационные аварийные ситуации | Радиационный термометр
[1] CDC. Острый лучевой синдром: информационный бюллетень для врачей [онлайн]. 2013. Доступно по адресу: http://emergency.cdc.gov/radiation/arsphysicianfactsheet.htm
[2] Национальный исследовательский совет национальных академий, Комитет по оценке рисков для здоровья от воздействия низких уровней ионизирующего излучения. Риски для здоровья от воздействия низких уровней ионизирующего излучения: BEIR VII, Phase 2 [онлайн]. 2006. Доступно по URL: http: // www.nap.edu/openbook.php?record_id=11340&page=R1внешний значок
[3] Национальный совет по радиационной защите и измерениям (NCRP). Ионизирующее излучение населения США. НКРЗ 2009; 160.
[4] Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). Тенденции в дозе облучения и качестве изображений при маммографии, 1974–2009 гг. [Онлайн]. 2014. Доступно по адресу: http://www.fda.gov/Radiation-EmittingProducts/MammographyQualityStandardsActandProgram/FacilityScorecard/ucm326264.htmeвнешний значок
[5] Gibbs SJ. Эффективный эквивалент дозы и эффективная доза: сравнение общих прогнозов в оральной и челюстно-лицевой радиологии. Oral Surg Oral Med Oral Path Oral Radiol Endod 2000; 90 (4): 538-545.
[6] Эйзенбуд М., Гезелл Т. Радиоактивность окружающей среды. 4-е изд. Оксфорд (Великобритания): Academic Press; 1997.
[7] Меттлер Ф., Аптон А. Медицинские эффекты радиации. 2-е изд. Филадельфия: W.B. Сондерс; 1995.
[8] Агентство по охране окружающей среды США (EPA).Руководство PAG: Руководства по защитным действиям и руководство по планированию радиационных инцидентов (проект для временного использования и общественного обсуждения) [онлайн]. 2013. Доступно по адресу: http://www.epa.gov/sites/production/files/2015-06/documents/pag-manual-interim-public-comment-4-2-2013.pdfpdf iconexternal icon
[9] Министерство транспорта США (DOT), Консультативный циркуляр Федерального управления гражданской авиации. Радиационное облучение членов экипажа авиаперевозчика — FAA AC 120-52 [онлайн]. 1990. Доступно по URL: http: // www.solarstorms.org/FAAAirlines.htmвнешний значок
Радиационный риск от медицинских изображений
Mayo Clin Proc. 2010 Dec; 85 (12): 1142–1146.
Из отделения радиологии, Медицинский центр Вирджинии Мейсон, Сиэтл, штат Вашингтон
Отдельные оттиски этой статьи недоступны. Адресная корреспонденция Юджину К. Линю, доктору медицины, отделение радиологии, Медицинский центр Вирджинии Мейсон, 1100 Девятая авеню, Сиэтл, Вашингтон 98111 (gro.cmmv@lcedaR). © 2010 Mayo Foundation for Medical Education and Research Эта статья цитируется в других статьях в PMC.Abstract
В этом обзоре представлен практический обзор избыточных рисков рака, связанных с радиацией при медицинской визуализации. Врачи первичного звена должны иметь общее представление об этих рисках. Из-за того, что к этому вопросу в последнее время обращают внимание, пациенты с большей вероятностью выражают озабоченность по поводу радиационного риска. Кроме того, врачи могут сыграть роль в снижении радиационного риска для своих пациентов, учитывая эти риски при направлениях к специалистам для визуализации. В этом обзоре дается краткий обзор доказательств, относящихся к низкому уровню радиации и повышенному риску рака, а также рассматриваются дозы облучения и риски, полученные в результате обычных исследований медицинской визуализации.Определенные группы пациентов могут подвергаться большему риску от радиационного облучения, и у этих пациентов следует тщательно учитывать радиационный риск. Последние технические инновации способствовали снижению дозы облучения от компьютерной томографии, и лечащий врач должен знать об этих нововведениях при направлении к специалистам по визуализации.
ASIR = адаптивная статистическая итерационная реконструкция; ИМТ = индекс массы тела; КТ = компьютерная томография; МРТ = магнитно-резонансная томография
Доза излучения от медицинской визуализации в последнее время стала предметом пристального внимания медицинской и непрофессиональной прессы.Это результат недавних статей о повышенных рисках рака, связанных с компьютерной томографией (КТ), 1-3 , а также недавних случаев избыточного радиационного облучения при КТ-сканировании перфузии головного мозга. 4 Berrington de Gonzalez et al. 3 подсчитали, что 29 000 будущих раковых заболеваний (примерно 2% рака, диагностируемых ежегодно в Соединенных Штатах) могут быть связаны с компьютерной томографией, выполненной в Соединенных Штатах в 2007 году. Это сопоставимо с недавними оценками 1,5–2,0% по Бреннер и Холл. 1 В этом обзоре представлен практический обзор дополнительных рисков рака, связанных с радиацией при медицинской визуализации, и предложено, как клиницисты могут сыграть роль в снижении этих рисков для своих пациентов.
Доза излучения
Поглощенная доза, измеряемая в серых тонах (Гр), определяет количество энергии, выделяемой на единицу массы. Вложение энергии в 1 Дж / кг ткани эквивалентно 1 Гр. Поскольку не все виды излучения производят одинаковый биологический эффект, вместо поглощенной дозы часто используется эквивалент дозы.Эквивалент дозы представляет собой произведение поглощенной дозы и весового коэффициента излучения и выражается в зивертах (Зв). Поскольку весовой коэффициент излучения для рентгеновских лучей и гамма-лучей равен 1,0, 1 Гр эквивалентен 1 Зв в медицинской визуализации. 5 Дозы излучения при медицинской визуализации обычно выражаются в миллизивертах (мЗв). Для справки, средняя годовая доза фонового излучения (в основном от радона в доме) составляет около 3 мЗв. 6
Избыточный риск рака от излучения: доказательства
Соответствующий биологический эффект рентгеновских лучей и гамма-лучей вторичен по отношению к ионизации.Ионизация молекул воды может создавать гидроксильные радикалы, которые могут взаимодействовать с ДНК, вызывая разрывы цепей или повреждение оснований; ДНК также можно ионизировать напрямую. Хотя большая часть радиационно-индуцированных повреждений быстро восстанавливается, неправильное восстановление может привести к точечным мутациям, транслокациям хромосом и слиянию генов, которые связаны с индукцией рака. 1 Этот эффект обычно считается стохастическим, т. Е. Он может возникать при любом уровне радиационного облучения, причем вероятность возрастает с увеличением дозы.Типичный период задержки между облучением и диагностикой рака составляет не менее 5 лет, 3 , и в большинстве случаев период задержки может составлять 1 или 2 десятилетия или больше. 7
Большинство данных о риске радиационно-индуцированного рака поступает из 4 групп: японские выжившие после атомной бомбардировки, группы населения, подвергшиеся медицинскому облучению, группы, подвергшиеся профессиональному облучению, и группы, подвергшиеся воздействию окружающей среды. 8 Из этих групп японцы, выжившие после атомной бомбардировки, предоставляют наиболее надежные данные. 9 Эти данные представляют собой четкое свидетельство радиационно-индуцированного риска рака при дозах выше 100 мЗв, 10 , но они не имеют большого отношения к медицинской визуализации, за исключением случаев множественных высокодозных исследований (КТ, ядерная кардиология и комплексные исследования). интервенционная радиология и кардиологические процедуры с использованием рентгеноскопии) в короткие сроки.
Риск, индуцированный радиацией, является более спорным при дозах от 10 до 100 мЗв, диапазоне доз, относящемся к медицинской визуализации и, в частности, КТ.Одна компьютерная томография брюшной полости может иметь дозу около 10 мЗв, и пациенты, перенесшие несколько компьютерных томографий или одну многофазную компьютерную томографию, попадают в этот диапазон доз. Ядерная кардиология также обычно попадает в этот диапазон доз. Некоторые исследователи предполагают, что прямые эпидемиологические данные выживших после атомных бомбардировок и работников ядерной промышленности указывают на повышенный риск рака в этом диапазоне доз 9,11,12 , в то время как другие утверждают, что нет данных, подтверждающих повышенный риск рака ниже 100 мЗв и что нейтронное облучение и другие смешивающие факторы могут объяснить предполагаемый канцерогенный эффект при низких дозах, наблюдаемый у выживших после атомной бомбы. 13,14
Ниже 10 мЗв, что является диапазоном доз, имеющим отношение к радиографии и некоторым исследованиям ядерной медицины и компьютерной томографии, нет прямых эпидемиологических данных, подтверждающих повышенный риск рака. Однако это не означает, что этот риск отсутствует, поскольку даже крупные эпидемиологические исследования не будут иметь статистической мощности для выявления повышенного риска, если таковой присутствует, при низкой дозе радиации. 5
Учитывая скудность прямых эпидемиологических данных, риски рака, связанные с низкими дозами радиации, были оценены с использованием моделей, основанных на линейной беспороговой теории.Эта теория утверждает, что избыточный риск рака, связанный с низкими дозами облучения, прямо пропорционален дозе. Эта модель используется для экстраполяции избыточного риска рака при низких дозах из известного риска при более высоких дозах. Однако некоторые ставят под сомнение обоснованность линейной беспороговой теории 14 и считают, что канцерогенез ниже определенного порога перестает быть проблемой.
Несмотря на некоторые разногласия по поводу повышенного риска рака, связанного с низкими дозами облучения, линейная беспороговая теория широко используется, поскольку отсутствует альтернативный метод оценки потенциальных рисков, связанных с низкими дозами облучения.Кроме того, по мнению автора, эпидемиологические данные прямо указывают на повышенный риск рака в диапазоне от 10 мЗв до 100 мЗв, что актуально для ядерно-кардиологических и многих исследований компьютерной томографии. Широко используемый показатель — это 5% превышение риска смерти от рака при дозе 1 Зв (1000 мЗв). 15,16 Это линейно экстраполируется для более низких доз. Сравнение этого числа с дозами из исследований показывает, что абсолютный риск избыточной смертности от рака при любом индивидуальном медицинском визуализирующем обследовании очень низок, особенно по сравнению с естественной частотой смертности от рака, составляющей приблизительно 25%. 5
ТАБЛИЦА.
Сравнение доз радиации с помощью медицинских визуализационных исследований и фонового излучения a
Доза радиации от визуальных обследований
Полезный способ понять дозы облучения от диагностических обследований — сравнить их со средним естественным фоновым излучением (3 мЗв в год) (). 2,6,17
Дозы облучения иногда выражаются как дозы на входе через кожу. Входные дозы на коже используются в обычной рентгенографии: оценка дозы в одной точке луча позволяет оценить дозы на органы и эффективную дозу.Для оценки риска для здоровья от низких доз ионизирующего излучения Международная комиссия по радиационной защите использует концепцию эффективной дозы . 5 Эффективная доза не измеряется, но представляет собой теоретически рассчитанную дозу, основанную на органах, подвергшихся облучению, умноженных на весовые коэффициенты для тканей. Поскольку весовые коэффициенты ткани могут изменяться с появлением новых данных и продолжающимся анализом существующих данных, оценки эффективных доз могут изменяться со временем.Следует отметить, что оценки дозы обычно даются для взрослого человека типичного роста и могут существенно различаться в зависимости от размера пациента и техники визуализации. Оценки эффективных доз лучше всего использовать для оценки общего уровня радиационного риска, а не для определения точной дозы радиации по результатам визуализационного исследования. Оценки эффективных доз для отдельных пациентов подвержены значительному уровню неопределенности.
Несколько интересных наблюдений можно сделать на основе данных, представленных в.Компьютерная томография и некоторые исследования ядерной медицины связаны с гораздо более высокими дозами облучения, чем рентгенография. В частности, дозы облучения в некоторых исследованиях компьютерной томографии и ядерной медицины попадают в диапазон, который, как показывают прямые эпидемиологические данные, связан с повышенным риском рака. Следует также отметить, что недавние данные свидетельствуют о том, что дозы облучения от компьютерной томографии могут сильно различаться в разных учреждениях. 2 Дозы при рентгенографии попадают в диапазон, для которого не существует эпидемиологических данных о повышенном риске рака (но может присутствовать очень небольшой повышенный риск рака, если линейная беспороговая гипотеза верна).При рентгенографии позвоночника и живота дозы облучения значительно выше, чем при рентгенографии грудной клетки и конечностей.
Еще один полезный способ выразить радиационный риск — сравнить его с обычной повседневной деятельностью. Например, дозы облучения от 0,1 до 1,0 мЗв несут дополнительный риск смерти от рака, сравнимый с риском смерти, связанной с перелетом на 4500 миль, тогда как дозы в диапазоне от 1 до 10 мЗв имеют более высокий риск, сравнимый с вождением. 2000 миль. 5
Снижение дозы облучения пациента
Дозу облучения от визуализационного исследования можно уменьшить тремя способами.Во-первых, можно решить вообще не проводить исследование. Такое решение должно основываться на правильном понимании показаний исследования, анализе любых предыдущих изображений, которые могли уже дать разумный ответ на клинический вопрос, и оценке любых особых соображений пациента, которые увеличивают или уменьшают риск. Во-вторых, можно выбрать альтернативное исследование, в котором не используется ионизирующее излучение. В-третьих, для создания изображений можно использовать меньше излучения.
Крайне важно, чтобы все визуализационные тесты, особенно те, которые потенциально могут нанести вред пациенту, проводились только по показаниям.Хотя абсолютный радиационный риск любого отдельного исследования с медицинской визуализацией невелик, эти риски могут быть клинически значимыми по сравнению с очень низкими или не установленными преимуществами. Например, преимущества КТ-скрининга всего тела у бессимптомных лиц не определены. Радиационный риск этих исследований (и возможных последующих исследований, полученных в результате первоначального скрининга) может быть клинически значимым по сравнению с неопределенной пользой, особенно с учетом дополнительных рисков ложноположительных результатов и гипердиагностики.Использование опубликованных критериев уместности для различных состояний пациента (возможно, в качестве поддержки принятия клинических решений, интегрированной в электронные системы заказов) может быть полезным в этой оценке соотношения риска и пользы. 18 В недавнем исследовании 26% амбулаторных исследований КТ и магнитно-резонансной томографии (МРТ) в одном академическом медицинском центре не были сочтены подходящими на основе критериев соответствия, основанных на доказательствах. 19 Из этих исследований 24% дали положительные результаты по сравнению с 58% исследований, которые были сочтены подходящими.Если существует неуверенность в выборе наиболее подходящего метода визуализации, следует проконсультироваться с рентгенологом.
Обзор истории визуализации важен, когда рассматривается возможность визуализации любого пациента, потому что иногда это может устранить необходимость в дополнительной визуализации или позволить более сфокусированное текущее обследование с более низкой дозой облучения. Обзор истории визуализации также должен выявить высокие кумулятивные дозы облучения, которые могут повлиять на будущие решения о визуализации. В недавнем исследовании 20 многие пациенты с хроническими и рецидивирующими состояниями, такими как почечная колика, получили общие эффективные дозы более 50 мЗв по данным визуализации в течение 3-летнего периода.
Еще большие сомнения заслуживает использование умеренно высоких доз радиации у беременных или молодых пациентов, у женщин, которым проводится КТ грудной клетки, у пациентов с высоким индексом массы тела (ИМТ) или у тех, кто проходит многофазную КТ. И наоборот, учитывая типичный период задержки от 1 до 2 десятилетий или более 7 между облучением и диагностикой рака, доза облучения может не вызывать беспокойства у некоторых очень больных или очень пожилых пациентов.
Полное обсуждение радиационного воздействия во время беременности выходит за рамки этого обзора, но потенциальные биологические эффекты внутриутробного облучения включают детский рак, внутриутробную смерть, ограничение внутриутробного развития, небольшой размер головы, умственную отсталость и пороки развития органов. 21 Визуализирующие обследования головы, шеи, груди и периферических конечностей матери могут выполняться с незначительным риском для концептуального развития. Хотя абсолютный риск для концепции при визуализирующих исследованиях брюшной полости и таза матери невелик, этих исследований следует избегать, если нет другого варианта.
Более молодые пациенты подвергаются значительно более высокому риску радиации, поскольку у них остается больше лет жизни, в течение которых может развиться радиационно-индуцированный рак.Например, Смит-Биндман и др. 2 подсчитали, что по сравнению с пациентом в возрасте 40 лет риск рака от теста радиационной визуализации удваивается для пациента в возрасте 20 лет и на 50% ниже для пациента в возрасте 60 лет. В этом обзоре не будут обсуждаться педиатрические пациенты, но очень маленькие дети подвергаются дополнительному риску, потому что они по своей природе более радиочувствительны, 1 , возможно, в 3-4 раза более чувствительны, чем взрослые. 5
Прогнозируемый риск для женщин, проходящих исследования при обнажении грудной клетки, выше, чем для мужчин, из-за дополнительного риска рака груди и высоких коэффициентов риска рака легких. 3 Например, Смит-Биндман и др. 2 подсчитали, что у 1 из 270 женщин, перенесших КТ-коронарную ангиографию в возрасте 40 лет, в результате этого сканирования разовьется рак, по сравнению с 1 из 600 мужчин.
Пациенты с высоким ИМТ часто получают более высокую дозу облучения. По мере увеличения толщины визуализируемой области требуется большее проникновение рентгеновских лучей для создания приемлемых изображений, что увеличивает дозу облучения. Эффективная доза облучения от рентгенографических и рентгеноскопических исследований для пациентов с высоким ИМТ может быть намного выше. 22,23 Для пациентов, проходящих КТ, высокий ИМТ часто ограничивает то, какие методы снижения дозы облучения могут быть использованы. Если пациентов с высоким ИМТ сканировать с помощью той же техники, что и пациентов с более низким ИМТ, количество падающего излучения будет неоптимальным, и полученные изображения обычно будут зернистыми или «зашумленными». Даже если падающее излучение увеличивается, шум изображения все равно может ухудшить качество сканирования у пациентов с очень высоким ИМТ. Многие методы снижения дозы облучения при компьютерной томографии приводят к большему шуму изображения.У пациентов с низким или средним ИМТ эти методы часто можно использовать без существенного влияния на качество изображения, но это часто не относится к пациентам с высоким ИМТ, исследования которых уже более шумны. К сожалению, пациенты с высоким ИМТ обычно не подходят для ультразвукового исследования. Магнитно-резонансная томография (МРТ) возможна, но пациентам с очень высоким ИМТ может потребоваться открытая МРТ, которая часто имеет более низкое качество изображения. Обратите внимание, что высокий ИМТ не оказывает существенного влияния на дозу облучения при исследованиях в области ядерной медицины. 24
При многофазной компьютерной томографии один и тот же орган сканируется несколько раз на разных этапах повышения контрастности. Например, при многофазной компьютерной томографии печени ее можно сканировать до 4 раз. По сравнению со стандартной компьютерной томографией многофазная компьютерная томография печени может улучшить обнаружение и характеристику поражений печени. Однако в исследовании Smith-Bindman et al., 2 доза облучения при многофазных КТ-исследованиях была почти в 4 раза выше, чем при однофазных КТ-исследованиях. Магнитно-резонансная томография часто может заменить многофазные исследования со сравнимой, если не большей диагностической точностью. 25,26 Радиолог — хороший источник вопросов о том, когда МРТ может заменить КТ.
Направляющие врачи могут сыграть роль в обеспечении минимальной дозы облучения для всех их пациентов, учитывая снижение дозы облучения при выборе места направления своих пациентов для визуализации. Смит-Биндман и др. 2 обнаружили в среднем 13-кратную вариацию внутри и между учреждениями между самой высокой и самой низкой дозировками для конкретных исследований компьютерной томографии. Направляющим врачам трудно определить, какие радиологические учреждения работают на нижнем конце диапазона дозы излучения.Важно узнать, аккредитовано ли учреждение для КТ Американским колледжем радиологии, потому что аккредитованные учреждения должны проходить периодические оценки дозы облучения 27 и, скорее всего, рассмотрели изменения протокола для снижения дозы. Еще один важный фактор, который следует учитывать, — это то, использует ли объект метод адаптивной статистической итеративной реконструкции (ASIR) 28 для обеспечения КТ с малой дозой. Этот новый метод реконструкции изображений позволяет создавать менее зашумленные изображения, что позволяет существенно снизить дозу облучения для широкого спектра КТ-исследований.Эти методы снижения дозы могут существенно снизить радиационный риск. Например, 40-летняя женщина, проходящая КТ-коронарную ангиографию, имеет шанс 1 из 270 развития рака при дозе облучения приблизительно 20 мЗв 2 ; с использованием ASIR (в сочетании с другими методами снижения дозы) такое же обследование можно было провести с дозой менее 1 мЗв. 29 В настоящее время только некоторые учреждения инвестируют в ASIR и другие технологии снижения дозы, но стимул для этих инвестиций возрастает, когда направление врачей учитывает это в структуре их направлений.
ЗАКЛЮЧЕНИЕ
Базовые знания о радиационном риске полезны при консультировании пациентов, которые выражают озабоченность по этому поводу. В большинстве случаев преимущества показанной медицинской визуализации перевешивают относительно небольшой избыточный риск рака, и лечение пациентов не должно изменяться на основе радиационного риска. Однако для некоторых групп пациентов радиационный риск должен вызывать большее беспокойство у клинициста. Кроме того, клиницисты могут сыграть роль в минимизации радиационного риска для своих пациентов, направляя своих пациентов в центры с обязательством минимизировать дозу радиации.
Примечания
По завершении этой статьи вы должны быть в состоянии (1) распознать дозы обычных медицинских исследований изображений, (2) определить, какие пациенты могут подвергаться повышенному риску от радиации, и (3) ознакомиться с Доказательная база для определения повышенного риска рака от малых доз радиации.
CME Вопросы о радиационном риске
Какой один из из следующих является средней годовой фоновой дозой облучения?
0.001 мЗв
0,7 мЗв
3 мЗв
10 мЗв
50 мЗв
Какая эффективная доза для из из эффективной дозы излучения фазовая компьютерная томография (КТ) брюшной полости и таза?
0,001 мЗв
0,7 мЗв
3 мЗв
10 мЗв
50 мЗв
50 мЗв
- Среднее значение эффективное излучение доза от скрининговой маммографии (2 просмотра)?
0.001 мЗв
0,7 мЗв
3 мЗв
10 мЗв
50 мЗв
Какое из следующих из является ложным из ?
Линейная беспороговая теория обычно используется для оценки радиационных рисков от малых доз радиации
Прямые эпидемиологические данные подтверждают повышенный риск рака от облучения при низких дозах 10 мЗв
A 5% Риск избыточной смерти от рака от дозы 1 Зв (1000 мЗв) — широко используемый индекс радиационного риска
Наиболее прямые эпидемиологические данные о радиационном риске получены от японцев, переживших атомную бомбу
Стохастический эффект возможен при любом уровень облучения с вероятностью усиления эффекта с увеличением дозы
Какая одна из из следующих групп пациентов, , а не , будет подвергаться повышенному относительному риску от радиационного воздействия?
Пациенты молодого возраста
Пациенты женского пола
Пациенты с высоким индексом массы тела
Пациенты пожилого возраста
Пациенты, перенесшие многофазную КТ
, были назначены для 1 AMA
Поскольку краткий обзор для клиницистов теперь является мероприятием НМО, ответы на вопросы больше не будут публиковаться в печатном журнале. Для получения информации об оценке CME и ответов см. Ссылку на нашем веб-сайте mayoclinicproceedings.com.
СПИСОК ЛИТЕРАТУРЫ
1. Brenner DJ, Hall EJ. Компьютерная томография: растущий источник радиационного облучения. N Engl J Med. 2007; 357 (22): 2277-2284 [PubMed] [Google Scholar] 2. Смит-Биндман Р., Липсон Дж., Маркус Р. и др.Доза облучения, связанная с обычными компьютерными томографическими исследованиями, и связанный с этим пожизненный риск рака. Arch Intern Med. 2009; 169 (22): 2078-2086 [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Беррингтон де Гонсалес А., Махеш М., Ким К.П. и др. Прогнозируемые риски рака по результатам компьютерной томографии, выполненной в США в 2007 году. Arch Intern Med. 2009; 169 (22): 2071-2077 [Бесплатная статья PMC] [PubMed] [Google Scholar]4. Исследование безопасности Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) при КТ-сканировании перфузии головного мозга: обновление от 08.12.2009.http://www.fda.gov/medicaldevices/safety/alertsandnotices/ucm185898.htm По состоянию на 26 августа 2010 г.
5. Verdun FR, Bochud F, Gudinchet F, et al. Радиационный риск: что вы должны знать своему пациенту. Радиография . 2008; 28: 1807-1816. [PubMed] [Google Scholar]6. Радиационное облучение от рентгеновских исследований. Веб-сайт RadiologyInfo.org. http://www.radiologyinfo.org/en/safety/index.cfm?pg=sfty_xray По состоянию на 26 августа 2010 г.
7. Эмис Э. С., Батлер П. Ф., Эпплгейт К. Э. и др.Официальный документ Американского колледжа радиологии о дозах облучения в медицине. J Am Coll Radiol. 2007; 4: 272-284. [PubMed] [Google Scholar] 8. Литтл депутат, Уэйкфорд Р., Таун Э. Дж. И др. Риски, связанные с низкими дозами и мощностью дозы ионизирующего излучения: почему линейность может быть (почти) лучшим, что мы можем сделать. Радиология . 2009; 251 (1): 6-12. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Пирс Д.А., Престон Д.Л. Риск рака, вызванного радиацией, при низких дозах у выживших после атомной бомбардировки. Radiat Res. 2000; 154: 178-186 [PubMed] [Google Scholar] 10. Национальная академия наук США. Национальный научно-исследовательский совет. Комитет по оценке рисков для здоровья от воздействия низких уровней ионизирующего излучения Риски для здоровья от воздействия низких уровней ионизирующего излучения. BEIR VII Этап 2 . Вашингтон, округ Колумбия: Национальная академия прессы; 2006 г. [Google Scholar] 11. Престон Д.Л., Рон Э., Токуока С. и др. Заболеваемость солидным раком у выживших после атомной бомбардировки: 1598–1998. Radiat Res. 2007; 168 (1): 1-64 [PubMed] [Google Scholar] 12.Кардис Э., Вриджхайд М., Блеттнер М. и др. Совместное исследование риска рака среди радиационных работников в атомной промышленности, проведенное в 15 странах: оценка риска рака, связанного с радиацией. Radiat Res. 2007; 167: 396-416 [PubMed] [Google Scholar] 13. Тубиана М., Ауренго А., Авербак Д. и др. Зависимость эффекта от дозы и оценка канцерогенных эффектов малых доз ионизирующего излучения . Париж, Франция: Академия наук и Национальная академия медицины; 2005 г. [PubMed] [Google Scholar] 14.Тубиана М, Файнендеген Л.Е., Ян Ц., Камински Дж. Линейная беспороговая зависимость не согласуется с радиационными биологическими и экспериментальными данными. Радиология . 2009; 251 (1): 13-22. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Международная комиссия по радиологической защите, 1990 г. Рекомендации Международной комиссии по радиологической защите. Энн МКРЗ . 1991; 21 (1-3): 1-201. [PubMed] [Google Scholar] 16. Национальный совет по радиационной защите и измерениям Ограничение воздействия ионизирующего излучения .Бетесда, Мэриленд: Национальный совет по радиационной защите и измерениям: 1993. [Google Scholar]17. Облучение при медицинских диагностических процедурах визуализации. Веб-сайт Общества физиков здоровья. www.hps.org/documents/meddiagimaging.pdf, по состоянию на 26 августа 2010 г.
18. Sistrom CL. Критерии соответствия ACR: перевод на практику и исследования. J Am Coll Radiol. 2005; 2 (1): 61-67 [PubMed] [Google Scholar] 19. Ленерт Б.Е., Бри Р.Л. Анализ целесообразности амбулаторных КТ и МРТ, направленных из клиник первичной медико-санитарной помощи в академический медицинский центр: насколько критична потребность в улучшенной поддержке принятия решений [опубликованное исправление появляется в J Am Coll Radiol. 2010; 7 (6): 466]? J Am Coll Radiol. 2010; 7 (3): 192-197 [PubMed] [Google Scholar] 20. Штейн Э.Г., Харамати Л.Б., Беллин Э. и др. Облучение пациентов с хроническими и рецидивирующими заболеваниями с помощью медицинских изображений. J Am Coll Radiol. 2010; 7 (5): 351-359 [PubMed] [Google Scholar] 21. McCollough CH, Schueler BA, Atwell TD, et al. Радиационное облучение и беременность: о чем следует беспокоиться? Радиография . 2007; 27 (4): 909-917. [PubMed] [Google Scholar] 22.Янч Дж. К., Берман Р. Х., Хендрикс М. Дж., МакКолл Дж. Х. Повышенная доза облучения пациентов с избыточным весом и ожирением при рентгенологических исследованиях. Радиология . 2009; 252 (1): 128-139. [PubMed] [Google Scholar] 23. Ector J, Dragusin O, Adrriaenssens B и др. Ожирение является основным фактором, определяющим дозу облучения у пациентов, которым выполняется изоляция легочной вены по поводу фибрилляции предсердий. J Am Coll Cardiol. 2007; 50 (3): 234-242 [PubMed] [Google Scholar] 24. Кларк Л.Д., Стабин М.Г., Фернальд М.Дж., Брилл А.Б.Изменения дозы облучения в зависимости от анатомии человека: взрослые с умеренным и тяжелым ожирением. J Nucl Med. 2010; 51 (6): 929-932 [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Питтон М.Б., Клочнер Р., Гербер С. и др. МРТ в сравнении с 64-рядным MDCT для диагностики гепатоцеллюлярного рака. World J Gastroenterol. 2009; 15 (48): 6044-6051 [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Парк Х.С., Ли Дж. М., Чой Х. К. и др. Предоперационная оценка рака поджелудочной железы: сравнение динамической МРТ с усилением гадолиния с МР-холангиопанкреатографией и МДКТ. Дж. Магнитно-резонансная томография . 2009; 30 (3): 586-595. [PubMed] [Google Scholar]27. Компьютерная томография [программа аккредитации]. Веб-сайт Американского колледжа радиологии. http://www.acr.org/accreditation/computed.aspx Проверено 26 августа 2010 г.
28. Silva AC, Lawder HJ, Hara A, et al. Нововведения в стратегии снижения дозы КТ: применение алгоритма адаптивной статистической итеративной реконструкции. AJR Am J Roentgenol. 2010; 194 (1): 191-199 [PubMed] [Google Scholar] 29.Heilbron BG, Leipsic J. Submillisievert коронарная компьютерная томографическая ангиография с использованием адаптивной статистической итеративной реконструкции: новая реальность. Can J Cardiol. 2010; 26 (1): 35-36 [Бесплатная статья PMC] [PubMed] [Google Scholar]доз радиации и риски при скрининге груди | Журнал визуализации груди
Абстрактные
В этой статье описаны дозы облучения и риски рака, связанные с технологиями цифровой визуализации груди, используемыми для обнаружения рака груди.К ним относятся цифровая маммография (DM), цифровой томосинтез груди (DBT) и новые технологии, такие как цифровая или спектральная маммография с контрастным усилением (CEM), компьютерная томография всей груди, гамма-визуализация груди (BSGI), молекулярная визуализация груди ( MBI) и позитронно-эмиссионной маммографии (PEM). В этой статье описывается основа для оценки радиационного риска, сравниваются дозы облучения и риски, а также приводятся соотношения пользы и радиационного риска для различных методов визуализации груди, в которых используется ионизирующее излучение.
Современные методы скрининга, основанные на рентгеновских лучах, такие как DM и DBT, имеют небольшой или незначительный риск вызвать радиационно-индуцированный рак у женщин нормального скринингового возраста. Возможные новые методы скрининга, такие как CEM, имеют аналогичный небольшой риск рака. Возможные методы скрининга, которые включают инъекции радионуклидов, такие как BSGI, MBI и PEM, имеют значительно более высокий риск рака, если не используются эффективные системы обнаружения и сниженные вводимые дозы. Оценка соотношения пользы к радиационному риску очень благоприятна для скрининга на СД и других методов, имеющих сопоставимые (или более высокие) показатели выявления рака и сравнительно низкие дозы облучения.
Ключевые сообщения
Текущая средняя доза для желез на среднюю грудь при цифровой маммографии (DM) с двумя экранами составляет около 3 миллиГрей, что имеет такой же риск развития рака, как и около 6 недель естественного фонового излучения.
Цифровой томосинтез молочной железы (DBT) имеет дозы, примерно в два раза превышающие дозы DM, в зависимости от того, получены ли двухмерные изображения или синтетически реконструированы из данных DBT, с риском, в два раза превышающим риски DM.
Радионуклидная визуализация с использованием гамма-визуализации молочной железы, молекулярной визуализации молочной железы и позитронно-эмиссионной маммографии подвергает все органы тела воздействию ионизирующего излучения и, следовательно, представляет значительно более высокий риск радиационно-обусловленного рака и смерти от рака, чем DM и DBT.
Отношение пользы к радиационному риску очень благоприятно для текущего скрининга груди на DM и DBT.
Введение
Ионизация тканей может происходить из-за воздействия твердых частиц или электромагнитного излучения соответствующей энергии.Излучение твердых частиц (заряженные частицы, такие как альфа-частицы, бета-частицы [электроны], протоны и нейтроны) являются компонентами космического излучения, большая часть которого фильтруется атмосферой Земли. Излучение твердых частиц также происходит из-за земных источников: урана и продуктов его распада, таких как торий, радий и радон. Среднестатистический человек в Соединенных Штатах получает около 3,1 миллизивертов (мЗв) естественного фонового излучения в год, около 70% этого количества поступает от вдыхаемого газообразного радона в воздухе домов и около 10% от каждого из них — от космической радиации, приема пищи и воды. и наземные наземные источники (1).
Ионизация тканей может происходить из-за электромагнитного излучения (фотонов) с энергией выше нескольких электрон-вольт (эВ). Этот энергетический порог возникает в ультрафиолетовой области электромагнитного спектра (рис. 1). Рентгеновские лучи определяются как область электромагнитного спектра над ультрафиолетовой областью с энергией фотонов от 100 до 100 000 эВ (100 кэВ), поэтому все рентгеновские лучи могут вызывать ионизацию тканей (2). Радиоволны, используемые в МРТ, являются частью электромагнитного спектра, но падают ниже порогового значения энергии фотонов, вызывая ионизацию тканей.Высокочастотные звуковые волны, используемые для ультразвука, также не вызывают ионизации тканей.
Рисунок 1.
Электромагнитный спектр. Выше нескольких электрон-вольт (эВ) фотоны могут ионизировать ткань.
Рисунок 1.
Электромагнитный спектр. Выше нескольких электрон-вольт (эВ) фотоны могут ионизировать ткань.
В среднем по всему населению США диагностические медицинские процедуры дают среднюю дозу для всего тела примерно 3 мЗв в год, что сравнимо со средней дозой естественного фонового излучения, получаемой каждый год.Большая часть этой диагностической популяционной дозы поступает от компьютерной томографии (КТ) и процедур ядерной медицины (1).
Процедуры скрининга груди, в которых используется ионизирующее излучение, включают цифровую маммографию (DM) и цифровой томосинтез груди (DBT), а также потенциальные новые методы скрининга груди, такие как маммография с контрастным усилением (CEM), КТ всей груди (WBCT), специфическая гамма груди визуализация (BSGI), молекулярная визуализация груди (MBI) и позитронно-эмиссионная маммография (PEM). Большинство этих технологий ограничивают радиационное воздействие в первую очередь на ткани груди, но процедуры, включающие инъекции радионуклидов, таких как BSGI, MBI и PEM, подвергают все органы тела ионизирующему излучению, и эти дополнительные облученные ткани должны приниматься во внимание при оценке. радиационные риски (3).Как в государственных СМИ, так и в рецензируемых статьях поднимался вопрос о воздействии ионизирующего излучения на другие органы из-за DM и DBT (4-6), но как измерения, так и оценки Монте-Карло показали, что воздействие и риск для органов за пределами груди от DM и DBT незначительны (7, 8).
Эта статья начинается с обзора доз облучения при различных процедурах скрининга груди, затем описывается научная основа оценки риска и продолжается оценка рисков от различных процедур скрининга груди на основе линейной беспороговой модели радиационного риска.
Единицы дозы облучения
Дозы облучения при рентгенографии груди обычно выражаются в виде средней железистой дозы (MGD) — дозы, поглощенной фиброгландулярными тканями груди, усредненной по всей длине фиброгландулярной ткани (9). Усреднение по груди важно, потому что при рентгеновских лучах маммографии каждые 1-2 см ткани груди уменьшают количество рентгеновских лучей на 50%, поэтому доза на фиброгландулярные ткани падает в 10–100 раз от входа. поверхность к выходной поверхности груди.Единицами MGD обычно являются миллигрей (мГр), единица поглощенной дозы (9, 10).
One Gray определяется как поглощение одного джоуля энергии излучения на килограмм ткани, таким образом, миллиГрей — это поглощенная доза, равная 1/1000 джоуля энергии излучения на кг (10). Старыми единицами поглощенной дозы являются рад и миллирад (мрад, одна тысячная рад), при этом 100 рад = 1 Гр (или 100 мрад = 1 мГр). Поскольку дозы облучения измеряются в единицах энергии, вложенной на единицу массы, нецелесообразно комбинировать дозы облучения на разные ткани груди, например, складывать дозы на левую и правую грудь, как это сделали некоторые авторы.Он — подходит для комбинирования доз облучения от разных воздействий на одну и ту же ткань груди, например доз облучения от медиолатерального косого (MLO) и краниокаудального (CC) изображений, чтобы получить дозу груди с двух точек зрения.
Иногда используются две другие единицы дозы облучения (10). Один из них — эквивалентная доза, которая учитывает биологический эффект конкретного типа излучения путем умножения поглощенной дозы на весовой коэффициент излучения. Например, альфа-частицы и протоны имеют весовые коэффициенты излучения 20 и 2 соответственно, в то время как рентгеновские лучи и электроны имеют весовые коэффициенты излучения 1.Эквивалентная доза измеряется в единицах зивертов (Зв), поэтому для рентгеновских лучей и электронов эквивалентная доза в Зв равна поглощенной дозе в Гр.
Другой полезной величиной дозы является эффективная доза, также измеряемая в Зв, которая учитывает радиочувствительность различных тканей путем умножения эквивалентной дозы на весовой коэффициент ткани. В таблице 1 перечислены весовые коэффициенты для различных тканей, установленные Международной комиссией по радиологической защите (ICRP) в Отчете 103 (11).Сумма этих весовых коэффициентов равна единице для всех органов тела, что позволяет грубо сравнивать пагубные эффекты (в первую очередь с точки зрения индукции рака) для различных органов и различных радиологических процедур. Эффективная доза определяется как доза для всего тела, имеющая эквивалентный риск нанесения ущерба как более ограниченное воздействие на один или несколько органов, и это величина дозы, которая используется для описания естественного фонового излучения. Чтобы определить эффективную дозу при маммографическом обследовании, нужно умножить среднюю дозу на железы (в мГр) на весовой коэффициент излучения (который равен 1 для рентгеновских лучей), чтобы получить эквивалентную дозу (в мЗв), а затем умножить эту эквивалентную дозу на Весовой коэффициент ткани груди (который равен 0.12), чтобы получить эффективную дозу на все тело (в мЗв).
Таблица 1. Весовые коэффициенты тканиМеждународной комиссии по радиологической защите
| Ткань тела . | Весовой коэффициент . | |
|---|---|---|
| Костный мозг, легкое, толстая кишка, желудок, грудь | 0,12 каждый | |
| Гонады | 0,08 | |
| Мочевой пузырь, пищевод, печень, щитовидная железа | 0.04 каждый | |
| Поверхность кости, мозг, слюнные железы, кожа | 0,01 каждый | |
| Все остальные ткани | 0,12 | |
| Всего | 1,00 | Весовой коэффициент . |
| Костный мозг, легкое, толстая кишка, желудок, грудь | 0,12 каждый | |
| Гонады | 0.08 | |
| Мочевой пузырь, пищевод, печень, щитовидная железа | 0,04 каждый | |
| Поверхность кости, мозг, слюнные железы, кожа | 0,01 каждый | |
| Все остальные ткани | 0,12 | 1,00 |
Международной комиссии по радиологической защите
| Ткани тела . | Весовой коэффициент . | |
|---|---|---|
| Костный мозг, легкое, толстая кишка, желудок, грудь | 0,12 каждый | |
| Гонады | 0,08 | |
| Мочевой пузырь, пищевод, печень, щитовидная железа | 0,04 каждый мозг, слюнные железы, кожа | 0,01 каждая |
| Все остальные ткани | 0,12 | |
| Всего | 1.00 |
| Ткань тела . | Весовой коэффициент . | |
|---|---|---|
| Костный мозг, легкое, толстая кишка, желудок, грудь | 0,12 каждый | |
| Гонады | 0,08 | |
| Мочевой пузырь, пищевод, печень, щитовидная железа | 0,04 каждый мозг, слюнные железы, кожа | 0,01 каждая |
| Все остальные ткани | 0.12 | |
| Всего | 1,00 |
Дозы облучения от процедур визуализации груди
По состоянию на 1 декабря 2019 г. из 21 305 маммографических аппаратов в 8668 сертифицированных учреждениях в США 61% являются аппаратами DM, 39% — цифровыми аппаратами с возможностью DBT, и только 26 аппаратов (0,12%) являются маммографами с экранной пленкой. (SFM) единиц (12). Внедрение цифровых технологий в визуализацию груди в США практически завершено, а распространение DBT широко распространено и продолжает расти.
Измеренные дозы облучения груди от DM или DBT лучше всего измерять на реальной ткани груди, а не на фантомах, и лучше всего измерять усреднением по репрезентативной популяции женщин. Это было сделано примерно у 10% из 49 528 женщин, участвовавших в скрининговом исследовании цифровой маммографии (DMIST) Американского колледжа радиологической сети визуализации (ACRIN), в ходе которого в парном исследовании сравнивались клинические показатели DM в начале (2001–2003 гг.) И SFM. , в котором каждая женщина сдала оба экзамена (13, 14).
Дозы ДМ
Дозы цифровой маммографии зависят от пяти факторов: толщины сжатой груди, плотности груди, качества рентгеновского луча (слой с половинным значением, HVL), выходной мощности рентгеновской трубки (миллиамперы) и времени экспозиции, причем последние два определяют миллиамперы. второй (мАс). Толщина сжатой груди зависит от пациента, его положения и силы сжатия, применяемой технологом. Плотность груди является неотъемлемой характеристикой пациента, а HVL и мА определяются оборудованием (мишень, фильтр и энергия луча) и схемой автоматического управления экспозицией.
Результаты ACRIN по дозе DMIST, усредненные по пяти различным типам систем DM, основанные на 19 923 изображениях 5021 женщины, привели к получению средней дозы в железах с двумя экранами, равной 3,72 мГр для DM по сравнению с дозой 4,74 мГр для SFM ( 14). В этом сравнении использовались устройства DM первого поколения, в том числе 8% прототипов устройств с зарядовой связью, которые никогда не поступали в продажу, 21% устройств производителя, больше не продающего устройства DM (Fischer, Wheat Ridge, CO), и 18% устройств. аппараты компьютерной радиографии (КР).На основе данных Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), собранных в 2007–2014 гг. На стандартизированных фантомах, блоки CR неизменно давали более высокий MGD, чем блоки прямого цифрового или SFM, в то время как качество изображения CR, основанное на показателях фантома, было оценено как ниже, чем у прямого цифрового ед. (рисунок 2).
Рисунок 2.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США, тенденции в дозе маммографии и качестве изображений, 1974–2014 гг. На рисунке показаны тенденции как средней дозы на железистые железы, так и для стандартизованного фантома, представляющего 4.50% железистая / 50% жировая грудь толщиной 5 см (сплошные символы и левая шкала) и оценка фантомного изображения (сумма волокон, групп пятен и масс, открытые символы и правая шкала). Сокращения: CR — компьютерная рентгенография, FFDM, полноформатная цифровая маммография; SF, экранно-пленочная маммография. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США, доступно по адресу: https://wayback.archive-it.org/7993/20170406072231/https://www.fda.gov/Radiation-EmittingProducts/MammographyQualityStandardsActandProgram/FacilityScorecard/ucm326264.htm. Последний доступ 07.02.2020. Разрешение предоставлено Дэвидом С. Спеликом, доктором наук, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США.
Рис. 2.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США, тенденции в дозе маммографии и качестве изображений, 1974–2014 гг. На рисунке показаны тенденции как средней железистой дозы для стандартизованного фантома, представляющего грудь толщиной 4,5 см с 50% железистой / 50% жировой ткани (сплошные символы и левая шкала), так и оценки фантомного изображения (сумма волокон, групп пятен и масс. , открытые символы и правая шкала).Сокращения: CR — компьютерная рентгенография, FFDM, полноформатная цифровая маммография; SF, экранно-пленочная маммография. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США, доступно по адресу: https://wayback.archive-it.org/7993/20170406072231/https://www.fda.gov/Radiation-EmittingProducts/MammographyQualityStandardsActandProgram/FacilityScorecard/ucm326264.htm. Последний доступ 07.02.2020. Разрешение предоставлено Дэвидом С. Спеликом, доктором наук, Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США.
Коллективные дозы DM из исследования ACRIN DMIST больше не являются репрезентативными для доз DM в настоящее время в полевых условиях, поскольку текущие единицы представляют собой системы DM второго и третьего поколения, работающие с более низкими дозами на экспозицию, чем те, которые используются в DMIST.Например, в данных клинического скрининга, собранных в Великобритании в период с 2010 по 2012 год на 25 408 женщинах, Янг и Одуко обнаружили, что средний MGD на исследование с двумя проекциями составлял 3,03 мГр для прямой цифровой рентгенографии (DR) и 4,69 мГр для CR по сравнению с 4,01 мГр для SFM (15). Эта работа также предоставила данные о дозах по производителям и моделям, подтвердив, что в целом недавно выпущенные системы DM работают при более низких уровнях доз, чем системы первого поколения. Как и в исследовании DMIST, которое показало, что доза для цифровых систем (включая CR) на 22% ниже, чем для экранных пленок, данные скрининга в Великобритании показали, что доза для DM была на 25% ниже, чем для SFM.
Аналогичным образом, в статье Дженнаро и др., Опубликованной в 2018 году, измерялись дозы в груди путем просмотра 4780 цифровых изображений у 1208 женщин, полученных в системе одного производителя (Selenia Dimensions, Hologic, Бедфорд, Массачусетс), и было обнаружено, что среднее значение MGD для просмотра CC составляет 1,366 мГр, а средняя MGD обзора MLO составляет 1,374 мГр для дозы в два обзора 2,74 мГр (16). Работая с той же системой, Skaane et al. В сравнении DM и DBT в 2013 году сообщили о двукратной ЦРТ 3,16 мГр для DM (17).
Дозы ДБТ
Дозы для цифрового томосинтеза молочной железы зависят от количества полученных изображений под разными углами и дозы на каждый угол обзора, но основным определяющим фактором доз DBT является протокол, используемый для получения.Первоначальное одобрение FDA систем DBT Hologic и Siemens (Эрланген, Германия) включало сбор двухмерных (2D) DM-изображений CC и MLO вместе с многоугольными наборами данных CC и MLO, которые позволили DBT реконструировать десятки плоских изображений через всю грудь. в проекциях CC и MLO (DM с двумя ракурсами + DBT с двумя ракурсами). Впоследствии производители добавили программное обеспечение (и получили одобрение FDA) для сбора только многоугловых наборов данных DBT в каждой проекции обзора (CC и MLO) и восстановления синтетических (SDM) 2D CC и MLO изображений из каждого набора данных DBT (двухкамерный DBT + SDM).Компания GE Healthcare (Чикаго, Иллинойс) изначально была одобрена для получения DBT в виде MLO, а CC-вид был получен как 2D-изображение. Впоследствии они получили одобрение на получение как CC, так и MLO DBT-ракурсов, с симулированными 2D CC и MLO-ракурсами, реконструированными из каждого 2D-набора данных.
Обычно набор данных многоракурсной ДБТ получают при дозах от тех, что равны дозам 2D DM, до 1,5x выше, чем дозы 2D DM (18). Например, в большом исследовании, упомянутом выше, с использованием системы Hologic Dimension DBT, Дженнаро и др. Обнаружили, что средняя доза DBT при двух просмотрах была равна 3.74 мГр по сравнению с 2,74 мГр для DM, что на 36% выше дозы DBT (16). В ходе скринингового исследования в Осло, используя ту же систему DBT, Skaane et al. Сообщили, что средняя доза DBT на 23% выше, чем средние дозы DM (17). Обзор литературы 2015 года, проведенный Svahn et al., Показал, что протоколы, добавляющие DBT с двумя экранами к DM, имели MGD в 2,0-2,23 раза выше, чем только DM (18). Когда синтетические 2D-изображения заменили 2D-изображения, доза на грудь была уменьшена на 45%.
Производители, такие как GE Healthcare, получают изображения DBT примерно с тем же MGD, что и изображения DM (19).В исследовании, проведенном на системе ДБТ Siemens Inspiration с использованием обследованных пациентов со средней толщиной груди 53 мм, сообщалось о ДГД 1,06 мГр для СД по сравнению с 2,39 мГр для ДПТ (20). На рисунке 3 показано сравнение доз DBT и DM в зависимости от смоделированной толщины груди с использованием акриловых фантомов для устройств GE Healthcare, Hologic и Siemens с поддержкой DBT (19).
Рисунок 3.
Сравнение MGD между режимами 2D и DBT для трех систем с поддержкой DBT.Полиметилметакрилат (ПММА) — это прозрачный пластиковый акриловый материал. Контрольное значение — это контрольные пределы Европейского Союза для 2D-дозы в зависимости от толщины груди. Источник: N.W. Маршалл и Х. Босманс (19). Разрешение предоставлено доктором философии Хильде Босманс от имени Бельгийской ассоциации госпитальных физиков. Сокращения: DBT, цифровой томосинтез груди; MGD, средняя железистая доза.
Рисунок 3.
Сравнение MGD между режимами 2D и DBT для трех систем с поддержкой DBT. Полиметилметакрилат (ПММА) — это прозрачный пластиковый акриловый материал.Контрольное значение — это контрольные пределы Европейского Союза для 2D-дозы в зависимости от толщины груди. Источник: N.W. Маршалл и Х. Босманс (19). Разрешение предоставлено доктором философии Хильде Босманс от имени Бельгийской ассоциации госпитальных физиков. Сокращения: DBT, цифровой томосинтез груди; MGD, средняя железистая доза.
Дозы ЦЕМ
Маммография с контрастным усилением получает пару 2D-изображений в течение 1-2 секунд во время одного и того же сжатия груди, при этом одно изображение получено с энергией рентгеновского излучения ниже энергии k-края йода (33.2 кэВ), а другой — с энергией рентгеновского излучения в основном выше k-края. Эти двухэнергетические изображения получены через несколько минут после инъекции неионного йодированного контрастного вещества. Низкоэнергетическое изображение обычно получается с той же рентгеновской мишенью, фильтрацией и энергией луча (и при той же дозе излучения), что и обычное 2D-изображение. Высокоэнергетические изображения обычно получают при 45–49 кВп, с дополнительной фильтрацией для усиления рентгеновского луча, при дозе облучения груди 20–45% от дозы низкоэнергетического изображения.Два полученных изображения комбинируются с соответствующими весовыми коэффициентами для получения изображения, максимально увеличивающего заметность поражений, поглощающих йодированный контрастный агент, и минимизирующего структурированный шум фиброгландулярных тканей. Таким образом, результирующая доза CEM на 20–45% выше, чем доза DM. На рисунке 4 показаны MGD для системы GE Healthcare Senobright CEM в сравнении с дозами DM в той же системе (21). Используя другую систему (Hologic Selenia Dimensions), способную выполнять DM, DBT и CEM, Джеймс и др. Определили дозы для 6214 пациентов, перенесших DM, 3662 пациентов, перенесших DBT, и 173 пациентов, перенесших CEM (22).При той же толщине сжатой груди (в среднем для CEM: 63 мм) MGD для DM составлял 2,1 мГр, для DBT — 2,5 мГр (на 19% выше, чем DM), а для CEM — 3,0 мГр (на 43% выше, чем для DM).
Рисунок 4.
Дозы для цифровой маммографии с контрастным усилением (CEDM или CEM) по сравнению с цифровой маммографией (MX или DM) на системе GE Senobright для 50% железистой груди. Источник: Dromain C и др. (21). Исследования рака груди — журнал с открытым доступом.
Рисунок 4.
Дозы для цифровой маммографии с контрастным усилением (CEDM или CEM) по сравнению с цифровой маммографией (MX или DM) на системе GE Senobright для 50% железистой груди. Источник: Dromain C и др. (21). Исследования рака груди — журнал с открытым доступом.
Дозы WBCT
В отличие от получения DBT под ограниченным углом, WBCT предназначен для получения набора данных 360 o рентгеновских лучей через грудь, когда пациентка лежит на животе, с восстановлением истинных трехмерных изображений груди.Несколько прототипов WBCT были изучены в клинических испытаниях для диагностического использования. Lindfors et al. Сообщили о среднем MGD 6,0 мГр (диапазон: 2,5–10,3 мГр) для раннего прототипа WBCT (23). Используя другой прототип системы WBCT, О’Коннелл и др. Сообщили о среднем MGD 8,2 мГр (диапазон: 4–12,8 мГр) для WBCT, по сравнению со средним MGD диагностической маммографии, равным 6,5 мГр (диапазон: 2,2-15 мГр), 26 % выше для WBCT (24). Система одного производителя, установка конической лучевой компьютерной томографии груди Konig, была одобрена для диагностических приложений в качестве дополнения к маммографии с двумя проекциями.По данным клинических испытаний, средний MGD для Konig WBCT был 10,6 мГр (на 10% выше) по сравнению с 9,6 мГр для доз диагностической маммографии у тех же субъектов (25).
Дозы BSGI и MBI
Гамма-визуализация молочной железы и MBI основаны на инъекции радионуклида: 99m Tc-sestamibi. Рекомендованные на этикетке дозы для визуализации груди составляют 740–1110 МБк (20–30 мКи), такая же доза рекомендуется для однодневных кардиологических стресс-тестов (26). В отличие от рентгеновских снимков груди, радионуклиды подвергают все органы тела, включая грудь, ионизирующему излучению.Из-за того, как 99m Tc-сестамиби поглощается и выводится организмом, самые высокие дозы в органах приходятся на стенку толстой кишки (40,0–55,5 мГр или мЗв), стенку тонкой кишки (30 мГр) и почки, мочевой пузырь. стенка и стенка желчного пузыря (по 20 мГр) для введенной дозы 1110 МБк (26).
В течение последнего десятилетия были разработаны новые устройства с более эффективными двухголовыми детекторами, встроенными в компрессионные лопатки, что позволяет использовать введение малых доз 99m Tc-сестамиби (27).Эти более эффективные устройства известны под названием «молекулярная визуализация груди» (MBI) и продемонстрировали хорошие клинические результаты при вводимых дозах 300 МБк (8 мКи) (28). Исследование 2013 года показало, что для набранных доз 150–300 МБк 99m Tc-сестамиби примерно 20% радионуклида удерживалось шприцем и трубкой (29). Для полученных доз BSGI 300 мБк это означает, что полученная доза составляла 80% от полученной дозы или 240 МБк (6,4 мКи) 99m Tc-сестамиби. В таблице 2 показаны расчетные дозы на органы как для рекомендованной на этикетке дозы 1110 МБк (30 мКи) (26), так и для полученной дозы 300 МБк (с полученной дозой 240 МБк [6.4 мКи]), предполагая 2-часовую пустоту.
Таблица 2.Расчетные дозы на органы для полученной дозы 240 МБк (6,4 мКи) (низкая доза MBI) и рекомендованной на этикетке дозы 1110 МБк (30 мКи) (максимальная указанная доза BSGI) 99m Tc Sestamibi, Предполагая двухчасовую пустоту
| Орган . | мГр / 240 МБк . | мГр / 1110 МБк . | |||||
|---|---|---|---|---|---|---|---|
| Грудь | 0.4 | 2,0 | |||||
| Стенка желчного пузыря | 4,3 | 20,0 | |||||
| Тонкая кишка | 6,5 | 30,0 | |||||
| Верхняя стенка толстой кишки | нижняя стенка толстой кишки | 9048 | 8,6 | 40,0 | |||
| Стенка желудка | 1,3 | 6,1 | |||||
| Стенка сердца | 1,1 | 5.1 | |||||
| Почки | 4,3 | 20,0 | |||||
| Печень | 1,3 | 5,8 | |||||
| Легкие | 0,6 | 2,8 | 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 Щитовидная железа | 1,5 | 7,0 | ||
| Яичники | 3,4 | 15,5 | |||||
| Семенники | 0,7 | 3.4 | |||||
| Красный костный мозг | 1,1 | 5,1 | |||||
| Стенка мочевого пузыря | 4,3 | 20,0 | |||||
| Все тело | 1,0 | 9047 9047 | 9048 . | мГр / 240 МБк . | мГр / 1110 МБк . | ||
| Грудь | 0,4 | 2,0 | |||||
| Стенка желчного пузыря | 4.3 | 20,0 | |||||
| Тонкая кишка | 6,5 | 30,0 | |||||
| Верхняя стенка толстой кишки | 12,0 | 55,5 | |||||
| Стенка нижней толстой кишки | 1,3 | 6,1 | |||||
| Стенка сердца | 1,1 | 5,1 | |||||
| Почки | 4,3 | 20.0 | |||||
| Печень | 1,3 | 5,8 | |||||
| Легкие | 0,6 | 2,8 | |||||
| Поверхности костей | 1,5 | 6,8 | 9048 9048 9048 9048 9048 9048 | 9048 Яичники | 3,4 | 15,5 | |
| Семенники | 0,7 | 3,4 | |||||
| Красный костный мозг | 1,1 | 5.1 | |||||
| Стенка мочевого пузыря | 4,3 | 20,0 | |||||
| Все тело | 1,0 | 4,8 |
Расчетные дозы на органы для полученной дозы 240 МБк (низкая мбк (низкая) -доза MBI) и рекомендованная на этикетке доза 1110 МБк (30 мКи) (максимальная указанная доза BSGI) 99m Tc Sestamibi, предполагая 2-часовую пустоту
| Орган . | мГр / 240 МБк . | мГр / 1110 МБк . | ||
|---|---|---|---|---|
| Грудь | 0,4 | 2,0 | ||
| Стенка желчного пузыря | 4,3 | 20,0 | ||
| Тонкая кишка | 6,5 | 9048 9048 Стенка толстой кишки 9048 9048 9048 55,5|||
| Нижняя стенка толстой кишки | 8,6 | 40,0 | ||
| Стенка желудка | 1.3 | 6,1 | ||
| Стенка сердца | 1,1 | 5,1 | ||
| Почки | 4,3 | 20,0 | ||
| Печень | 1,3 | |||
| Костные поверхности | 1,5 | 6,8 | ||
| Щитовидная железа | 1,5 | 7,0 | ||
| Яичники | 3.4 | 15,5 | ||
| Семенники | 0,7 | 3,4 | ||
| Красный костный мозг | 1,1 | 5,1 | ||
| Стенка мочевого пузыря | 4,3 20488 9048 9048 9048 9048 9048 9048 9048 9048 | 4,8 |
| Орган . | мГр / 240 МБк . | мГр / 1110 МБк . | ||||
|---|---|---|---|---|---|---|
| Грудь | 0.4 | 2,0 | ||||
| Стенка желчного пузыря | 4,3 | 20,0 | ||||
| Тонкая кишка | 6,5 | 30,0 | ||||
| Верхняя стенка толстой кишки | нижняя стенка толстой кишки | 9048 | 8,6 | 40,0 | ||
| Стенка желудка | 1,3 | 6,1 | ||||
| Стенка сердца | 1,1 | 5.1 | ||||
| Почки | 4,3 | 20,0 | ||||
| Печень | 1,3 | 5,8 | ||||
| Легкие | 0,6 | 2,8 | 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 Щитовидная железа | 1,5 | 7,0 | |
| Яичники | 3,4 | 15,5 | ||||
| Семенники | 0,7 | 3.4 | ||||
| Красный костный мозг | 1,1 | 5,1 | ||||
| Стенка мочевого пузыря | 4,3 | 20,0 | ||||
| Всего тела | 1,0 | 4,8 |
| Ткань . | Доза (мЗв) . | ||
|---|---|---|---|
| Стенка мочевого пузыря | 32,0 | ||
| Стенка сердца | 22,0 | ||
| Селезенка | 14.0 | ||
| Поджелудочная железа | 9,6 | ||
| Почки | 7,4 | ||
| Мозг | 7,0 | ||
| Легкие | 6,4 | 9048 9048 9048 9048 9048 9048 9048 9048 9048 | |
| Яичники | 5,3 | ||
| Нижняя стенка толстой кишки | 5,1 | ||
| Стенка желчного пузыря | 4.9 | ||
| Надпочечники | 4,8 | ||
| Желудок | 4,7 | ||
| Стенка тонкой кишки | 4,7 | ||
| Красный костный мозг | 9047 | 9048 верхняя стенка толстой кишки 9048Тимус | 4,4 |
| Костные поверхности | 4,1 | ||
| Щитовидная железа | 3,9 | ||
| Мышцы | 3.9 | ||
| Грудь | 3,4 | ||
| Кожа | 3,0 | ||
| Другие ткани | 4,2 |
| Ткань . | Доза (мЗв) . | |||||
|---|---|---|---|---|---|---|
| Стенка мочевого пузыря | 32,0 | |||||
| Стенка сердца | 22,0 | |||||
| Селезенка | 14,0 | |||||
| Поджелудочная железа 9.6 | ||||||
| Почки | 7,4 | |||||
| Мозг | 7,0 | |||||
| Легкие | 6,4 | |||||
| Матка | 6,2 | 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 | ||||
| Нижняя стенка толстой кишки | 5,1 | |||||
| Стенка желчного пузыря | 4,9 | |||||
| Надпочечники | 4.8 | |||||
| Желудок | 4,7 | |||||
| Стенка тонкой кишки | 4,7 | |||||
| Красный костный мозг | 4,7 | |||||
| Стенка верхней толстой кишки | 4,6 | 9048 | Костные поверхности | 4,1 | ||
| Щитовидная железа | 3,9 | |||||
| Мышцы | 3,9 | |||||
| Грудь | 3.4 | |||||
| Кожа | 3,0 | |||||
| Другие ткани | 4,2 |
Расчетные дозы органов для дозы 370 МБк (10 мКи) 18 F-FDG из маркировки 6
904| Ткань . | Доза (мЗв) . | |||||
|---|---|---|---|---|---|---|
| Стенка мочевого пузыря | 32,0 | |||||
| Стенка сердца | 22,0 | |||||
| Селезенка | 14,0 | |||||
| Поджелудочная железа 9.6 | ||||||
| Почки | 7,4 | |||||
| Мозг | 7,0 | |||||
| Легкие | 6,4 | |||||
| Матка | 6,2 | 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 | ||||
| Нижняя стенка толстой кишки | 5,1 | |||||
| Стенка желчного пузыря | 4,9 | |||||
| Надпочечники | 4.8 | |||||
| Желудок | 4,7 | |||||
| Стенка тонкой кишки | 4,7 | |||||
| Красный костный мозг | 4,7 | |||||
| Стенка верхней толстой кишки | 4,6 | 9048 | Костные поверхности | 4,1 | ||
| Щитовидная железа | 3,9 | |||||
| Мышцы | 3,9 | |||||
| Грудь | 3.4 | |||||
| Кожа | 3,0 | |||||
| Другие ткани | 4,2 |
Научное обоснование оценки риска
Риски радиационно-индуцированного рака и смерти основаны на долгосрочных исследованиях субъектов, получивших значительные дозы радиации. Исследователи отслеживали заболеваемость раком и уровень смертности в каждой исследуемой когорте, подвергшейся воздействию, и сравнивали эти показатели с аналогичными показателями в сопоставимых когортах, не подвергавшихся воздействию, или в группах с низким уровнем воздействия.Важной когортой является группа из 120 000 выживших после атомной бомбардировки японцев из Хиросимы и Нагасаки, за которыми наблюдали более 60 лет (Исследование продолжительности жизни [LSS]) (32–36). Другие включают пациентов, подвергшихся диагностическому облучению при доброкачественных состояниях (повторная рентгеноскопия больных туберкулезом и рентгенография больных сколиозом) (37, 38) и терапевтическому облучению при раке (лечение болезни Ходжкина) (39, 40). На основе избыточной заболеваемости раком среди этих когорт с высокими дозами, оценки радиационно-индуцированного риска рака были сделаны двумя основными группами: VII группа по биологическим эффектам ионизирующего излучения Национальной академии наук США (BEIR) (35) , который оценил радиационные риски для U.S., и МКРЗ (11). Эти исследования обнаружили линейную зависимость между дозой облучения и риском радиационно-индуцированного солидного рака, включая рак груди, для расчетных доз на органы выше 0,1 Гр (100 мГр). Существуют разногласия по поводу экстраполяции линейной беспороговой модели на дозы ниже 100 мГр (41, 42). Поскольку во всех скрининговых и диагностических исследованиях с визуализацией груди используются дозы органов, значительно ниже этого порогового значения, тесты с визуализацией груди являются предметом споров.
Недавно обновленный анализ риска рака груди из LSS включал 397 новых случаев рака груди, диагностированных с 1998 г., 75% из которых были выявлены в возрасте до 20 лет (43).Только 139 (9,5%) из 1470 случаев рака груди в полном анализе LSS произошли у женщин старше 40 лет (43). Эти новые данные подтверждают примерно линейную зависимость между риском рака груди и дозой облучения для доз выше 250 мГр с разбросанными данными как выше, так и ниже линии линейного тренда для доз облучения груди ниже 250 мГр (Рисунок 5) (43). Исследование подтвердило, что «воздействие радиации может быть особенно канцерогенным, если оно происходит в периоды чувствительного развития груди, такие как внутриутробный период, половое созревание и беременность, которые характеризуются быстрым размножением недифференцированных клеток.Они обнаружили, что «для определенного возраста менархе воздействие во время менархе приводит к самым сильным радиационным эффектам». С точки зрения расчетного относительного риска (относительно нерадиационной заболеваемости раком молочной железы), риски возрастали по мере приближения возраста воздействия к менархе, а затем уменьшались по мере того, как возраст воздействия увеличивался после наступления менархе (рис. 6). Более ранний возраст начала менархе повышает риск радиационно-индуцированного рака груди на протяжении всей жизни женщины. Рисунок 7 из более ранней публикации LSS показывает, что пожизненный риск индуцирования радиационно-обусловленного рака груди неуклонно снижается для более старшего возраста облучения (44).Оценки низкого избыточного относительного риска и широкие планки ошибок для женщин в возрасте 40 лет и старше отражают ограниченное количество случаев рака груди, вызванного радиацией, в этой возрастной группе.
Рисунок 5.
Избыточный относительный риск рака груди (ERR) у женщин по отношению к взвешенной поглощенной дозе DS02R1 в груди. Эти оценки относятся к 70-летним женщинам, подвергшимся облучению в возрасте 15 лет с возрастом начала менархе 15 лет. Линейный ERR (сплошная черная линия) составляет 1,40 на Гр (95% ДИ: 0,85–2,15).Источник: Бреннер и др. (43). Перепечатано с разрешения Radiation Research © 2020 Radiation Research Society.
Рисунок 5.
Избыточный относительный риск рака груди (ERR) у женщин по отношению к взвешенной поглощенной дозе DS02R1 в груди. Эти оценки относятся к 70-летним женщинам, подвергшимся облучению в возрасте 15 лет с возрастом начала менархе 15 лет. Линейный ERR (сплошная черная линия) составляет 1,40 на Гр (95% ДИ: 0,85–2,15). Источник: Бреннер и др. (43). Перепечатано с разрешения Radiation Research © 2020 Radiation Research Society.
Рисунок 6.
Расчетный избыточный относительный риск (ERR) заболеваемости раком груди у женщин в исследовании «Продолжительность жизни» при дозе 1 Гр по возрасту на момент воздействия для выбранных достигнутых возрастов (30, 50 и 70 лет) и возраста менархе 12 (твердый кривые), 14 (штриховые кривые), 16 (штрихпунктирные кривые) и 18 (пунктирные кривые) лет. Оценки взяты из линейной модели доза-реакция с модификацией эффекта в зависимости от достигнутого возраста, возраста менархе и возраста воздействия. Источник: Бреннер и др. (43).Перепечатано с разрешения Radiation Research © 2020 Radiation Research Society.
Рис. 6.
Расчетный избыточный относительный риск (ERR) заболеваемости раком груди у женщин в исследовании «Продолжительность жизни» при дозе 1 Гр по возрасту на момент воздействия для выбранных достигнутых возрастов (30, 50 и 70 лет) и возраста менархе 12 ( сплошные кривые), 14 (штриховые кривые), 16 (штрихпунктирные кривые) и 18 (пунктирные кривые) лет. Оценки взяты из линейной модели доза-реакция с модификацией эффекта в зависимости от достигнутого возраста, возраста менархе и возраста воздействия.Источник: Бреннер и др. (43). Перепечатано с разрешения Radiation Research © 2020 Radiation Research Society.
Рисунок 7.
Избыточный относительный риск рака груди из-за воздействия 1 зиверта (или 1 Гр) для пятилетних возрастных групп. Сплошная кривая экспоненциально соответствует данным избыточного относительного риска как функции возраста. Пунктирные кривые — 90% доверительные интервалы. Источник: Исследование продолжительности жизни, Лэнд и др. (44). Перепечатано с разрешения Radiation Research © 2020 Radiation Research Society.
Рис. 7.
Избыточный относительный риск рака груди из-за воздействия 1 зиверта (или 1 Гр) для пятилетних возрастных групп. Сплошная кривая экспоненциально соответствует данным избыточного относительного риска как функции возраста. Пунктирные кривые — 90% доверительные интервалы. Источник: Исследование продолжительности жизни, Лэнд и др. (44). Перепечатано с разрешения Radiation Research © 2020 Radiation Research Society.
Оценка риска
Оценки риска возникновения рака и смерти от рака могут быть сделаны с использованием ICRP или BEIR VII (11, 35).Оба используют линейную беспороговую модель зависимости дозы от риска как для низких, так и для высоких доз ионизирующего излучения. Используя весовые коэффициенты ICRP 103 (0,12 для груди, как показано в таблице 1), можно сравнить дозу облучения данной процедуры на груди с другими диагностическими процедурами или с естественным фоновым излучением, используя эффективную дозу (определенную ранее). Например, скрининг с использованием современного DM дает средний поглощенный MGD около 3,0 мГр. Преобразование MGD в единицах поглощенной дозы (мГр) в эквивалентную дозу (в мЗв) для рентгеновских лучей просто включает в себя умножение MGD на 1 мЗв / мГр, поскольку весовой коэффициент излучения для рентгеновских лучей равен 1, поэтому эквивалентная доза для каждого грудь примерно 3.0 мЗв. Преобразование эквивалентной дозы в эффективную дозу осуществляется путем умножения эквивалентной дозы на безразмерный весовой коэффициент ткани для ткани груди, равный 0,12, что дает эффективную дозу 0,36 мЗв. В таблице 4 сравниваются эффективные дозы нескольких различных процедур радиологической и ядерной медицины, включая маммографию с двумя проекциями (45).
Таблица 4. Расчетные эффективные дозыот различных радиологических процедур и расчетная эквивалентность продолжительности естественного фонового излучения
| Процедура . | Эффективная доза (мЗв) . | Эквивалентное радиационное воздействие естественного фона . |
|---|---|---|
| Рентгенограмма грудной клетки | 0,02 | 2,5 дня |
| Маммография | 0,36 | 6 недель |
| Рентген поясничного отдела позвоночника 0,5 90–487 | ||
| Головной CT | 1-2 | 4-8 месяцев |
| Chest CT | 7 | 2 года |
| Abdominal CT | 5–10 | 1.6–3,2 года |
| КТ-колонография | 5–10 | 1,6–3,2 года |
| КТ-ангиография сердца | 5–15 | 1,6–5 лет |
| КТ эмболии грудной клетки | 155 лет |
| Процедура . | Эффективная доза (мЗв) . | Эквивалентное радиационное воздействие естественного фона . |
|---|---|---|
| Рентгенограмма грудной клетки | 0,02 | 2,5 дня |
| Маммография | 0,36 | 6 недель |
| Рентген поясничного отдела позвоночника 0,5 90–487 | ||
| Головной CT | 1-2 | 4-8 месяцев |
| Chest CT | 7 | 2 года |
| Abdominal CT | 5–10 | 1.6–3,2 года |
| КТ-колонография | 5–10 | 1,6–3,2 года |
| КТ-ангиография сердца | 5–15 | 1,6–5 лет |
| КТ эмболии грудной клетки | 155 лет |
Расчетные эффективные дозы при различных радиологических процедурах и расчетная эквивалентность продолжительности естественного фонового излучения
| Процедура . | Эффективная доза (мЗв) . | Эквивалентное радиационное воздействие естественного фона . |
|---|---|---|
| Рентгенограмма грудной клетки | 0,02 | 2,5 дня |
| Маммография | 0,36 | 6 недель |
| Рентген поясничного отдела позвоночника 0,5 90–487 | ||
| Головной CT | 1-2 | 4-8 месяцев |
| Chest CT | 7 | 2 года |
| Abdominal CT | 5–10 | 1.6–3,2 года |
| КТ-колонография | 5–10 | 1,6–3,2 года |
| КТ-ангиография сердца | 5–15 | 1,6–5 лет |
| КТ эмболии грудной клетки | 155 лет |
| Процедура . | Эффективная доза (мЗв) . | Эквивалентное радиационное воздействие естественного фона . |
|---|---|---|
| Рентгенограмма грудной клетки | 0,02 | 2,5 дня |
| Маммография | 0,36 | 6 недель |
| Рентген поясничного отдела позвоночника 0,5 90–487 | ||
| Головной CT | 1-2 | 4-8 месяцев |
| Chest CT | 7 | 2 года |
| Abdominal CT | 5–10 | 1.6–3,2 года |
| КТ-колонография | 5–10 | 1,6–3,2 года |
| КТ-ангиография сердца | 5–15 | 1,6–5 лет |
| КТ эмболии грудной клетки | 155 лет |
Учитывая, что средняя годовая эффективная доза (на все тело) от естественного фонового излучения составляет 3,1 мЗв, цифровой скрининговый маммографический осмотр женщины среднего роста имеет такой же риск развития рака, как и примерно 6 недель естественного радиационного фона (3.1 мЗв * 6/52 = 0,36 мЗв; см. Таблицу 4). Отчет 103 МКРЗ дает оценку риска причинения вреда (индукции рака) 0,041 на Зв (11), поэтому для цифровой скрининговой маммографии это будет означать риск индукции рака (0,36 мЗв) (1/1000 Зв / мЗв) ( 0,041 / Зв) = 1,5 на 1 000 000. Проблема с использованием оценок ICRP 103 заключается в том, что риск ущерба усреднен по возрасту (по взрослому населению) и по полу (по мужчинам и женщинам), и поэтому наиболее подходящий для оценки риска рака при процедурах визуализации груди.
Более приемлемым методом является использование оценок радиационного риска BEIR VII, которые зависят от возраста и пола и включают оценки как заболеваемости, так и смертности от рака, вызванного радиацией. Эти оценки не принимают во внимание последнее обновление LSS о рисках рака груди (43). В таблице 5 показаны оценки риска заболеваемости раком и смертности от рака, связанные с воздействием на женскую грудь, в рамках исследования BEIR VII. BEIR VII предполагает относительно высокое соотношение смертности от рака груди к заболеваемости, равное примерно 0.25. Более поздние модели сети моделирования вмешательства и надзора за раком оценивают общее отношение смертности от рака груди к заболеваемости в 0,19 для женщин, получающих современную терапию, но не проходящих скрининг (46). Эти более современные оценки показателей смертности от рака в отсутствие скрининга снизят оценки смертности по BEIR VII примерно на 25%. Оценки смертности были бы еще более занижены, если бы предполагалось проведение скрининга (47, 48).
Таблица 5.BEIR-VII Оценки заболеваемости и смертности от рака молочной железы по возрасту на момент воздействия
| Возраст на момент воздействия (лет) . | Риск заболеваемости раком . | Риск смерти от рака . | ||
|---|---|---|---|---|
| 0 | 1171 | 274 | ||
| 5 | 914 | 214 | ||
| 10 | 712 | 167 | 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 20429 | 101 |
| 30 | 253 | 61 | ||
| 40 | 141 | 35 | 50 | 70 | 9048 9048 9048 9048 9
| 70 | 12 | 5 | ||
| 80 | 4 | 2 |
| Возраст при воздействии (лет) . | Риск заболеваемости раком . | Риск смерти от рака . | ||
|---|---|---|---|---|
| 0 | 1171 | 274 | ||
| 5 | 914 | 214 | ||
| 10 | 712 | 167 | 9048 9048 9048 9048 9048 9048 9048 9048 9048 20429 | 101 |
| 30 | 253 | 61 | ||
| 40 | 141 | 35 | 50 | 70 | 9048 9048 9048 9048 9
| 70 | 12 | 5 | ||
| 80 | 4 | 2 |
BEIR-VII Оценки заболеваемости и смертности от рака груди по возрасту на момент воздействия
| Возраст на момент воздействия (лет) . | Риск заболеваемости раком . | Риск смерти от рака . | ||
|---|---|---|---|---|
| 0 | 1171 | 274 | ||
| 5 | 914 | 214 | ||
| 10 | 712 | 167 | 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 20429 | 101 |
| 30 | 253 | 61 | ||
| 40 | 141 | 35 | 50 | 70 | 9048 9048 9048 9048 9
| 70 | 12 | 5 | ||
| 80 | 4 | 2 |
| Возраст при воздействии (лет) . | Риск заболеваемости раком . | Риск смерти от рака . | ||
|---|---|---|---|---|
| 0 | 1171 | 274 | ||
| 5 | 914 | 214 | ||
| 10 | 712 | 167 | 9048 9048 9048 9048 9048 9048 9048 9048 9048 20429 | 101 |
| 30 | 253 | 61 | ||
| 40 | 141 | 35 | 50 | 70 | 9048 9048 9048 9048 9
| 70 | 12 | 5 | ||
| 80 | 4 | 2 |
BEIR VII может использоваться для оценки пожизненного риска заболеваемости и смертности от рака для одного скринингового обследования как функция возраста на момент воздействия (35).В таблице 6 представлены эти оценки для скрининга с DM, DBT, CEDM, КТ всей груди, BSGI / MBI и PEM в зависимости от возраста на момент воздействия для назначенных доз каждой процедуры. Первые четыре списка относятся к рискам рака груди или смерти, вызванной раком груди, поскольку эти процедуры подвергают только ткани груди воздействию значительного количества радиации. Последние списки (BSGI, MBI и PEM) включают риски рака или смерти от рака для всех органов тела (см. Таблицы 2 и 3).
Таблица 6.Расчетные случаи радиационной заболеваемости раком (верхняя таблица) и смертности (нижняя таблица) на 100000 женщин, подвергшихся воздействию указанных доз для различных существующих и предполагаемых методов скрининга, в зависимости от возраста на момент облучения
| . | . | Риск возникновения рака, вызванного радиацией . | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Метод проверки . | Расчетная MGD (мГр) . | Возраст 30 . | Возраст 40 . | Возраст 50 . | Возраст 60 . | Возраст 70 . | Возраст 80 . | |||||
| Цифровая маммография | 3,0 | 7,6 | 4,2 | 2,1 | 0,9 | 0,4 | 0,1 | |||||
| только DBT (2 просмотра) | 6–11,4 | 4,2–6,3 | 2,1–3,2 | 0,9–1,4 | 0,4–0,5 | 0,1–0,2 | ||||||
| DBT (1 вид) + DM (другой вид) | 3,0–3,75 | 7,6–9,5 | 4,2–5,3 | 2,1–2,6 | 0,9–1,2 | 0,4–0,5 | 0,1–0,2 | |||||
| DBT + DM (каждый в 2 просмотрах) | 6,0–7,5 | 15– 19 | 8,5–11 | 4,2–5,3 | 1,9–2,3 | 0.7–0,9 | 0,2–0,3 | |||||
| CT всей груди | 6,0–11,0 | 15–28 | 8,5–16 | 4,2–7,7 | 1,9–3,4 | 0,7–1,3 | 0,2 0,4 | |||||
| Управляемая доза | ||||||||||||
| BSGI (99mTc-sestamibi) | 9048 | 60 | 42 | 21 | ||||||||
| МБК (99mTc-sestamibi) | 300 МБк (8 мКи) a | 19 | 18 | 16 | 13 9 | 9048 9048 9048 PEM (F-18 FDG)370 МБк (10 мКи) | 81 | 75 | 68 | 57 | 40 | 20 |
| Риск рад. Смерть от рака, вызванного инфекцией | ||||||||||||
| Цифровая маммография | 3.0 | 1,8 | 1,1 | 0,6 | 0,3 | 0,2 | 0,1 | |||||
| Только DBT (2 просмотра) | 3,0–4,5 | 1,8–2,3 | 1,1–1,68 | 0,3–0,4 | 0,2 | 0,1 | ||||||
| DBT (1 вид) + DM (другой вид) | 3,0–3,75 | 1,8–2,3 | 1,1–1,3 | 0,6–0,7 | 0,3 | 0,20.1 | ||||||
| DBT + DM (каждый в 2 просмотрах) | 6,0–7,5 | 3,7–4,6 | 2,1–2,6 | 1,1–1,4 | 0,5–0,7 | 0,3–0,4 | 0,1–0,2 | |||||
| ЦТ всей груди | 6,0–11,0 | 3,7–6,7 | 2,1–3,9 | 1,1–2,1 | 0,5–1,0 | 0,3–0,6 | 0,1–0,2 | |||||
| Доза | ||||||||||||
| BSGI (99mTc-sestamibi) | 1110 МБк (30 мКи) | 40 | 40 | 40 | 40 | |||||||
| МБИ (99mTc-sestamibi) | 300 МБк (8 мКи) a | 9 | 9 | 8 | 7 | 5 | 3 | |||||
| FD 370 МБк (10 мКи) | 32 | 31 | 28 | 26 | 21 | 13 | ||||||
| . | . | Риск возникновения рака, вызванного радиацией . | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Метод проверки . | Расчетная MGD (мГр) . | Возраст 30 . | Возраст 40 . | Возраст 50 . | Возраст 60 . | Возраст 70 . | Возраст 80 . | ||||||||||
| Цифровая маммография | 3.0 | 7,6 | 4,2 | 2,1 | 0,9 | 0,4 | 0,1 | ||||||||||
| Только DBT (2 просмотра) | 3,0–4,5 | 7,6–11,4 | 4,2–6,3 | 0,9–1,4 | 0,4–0,5 | 0,1–0,2 | |||||||||||
| DBT (1 вид) + DM (другой вид) | 3,0–3,75 | 7,6–9,5 | 4,2–5,3 | 2,1–2,6 | 0,9–1,2 | 0,4–0.5 | 0,1–0,2 | ||||||||||
| DBT + DM (каждый в 2 ракурсах) | 6,0–7,5 | 15–19 | 8,5–11 | 4,2–5,3 | 1,9–2,3 | 0,70–0,9 | 0,2–0,3 | ||||||||||
| CT всей груди | 6,0–11,0 | 15–28 | 8,5–16 | 4,2–7,7 | 1,9–3,4 | 0,7–1,3 | 0,2–0,4 | Управляемая доза | |||||||||
| BSGI (99mTc-sestamibi) | 82487 8248 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 | 42 | 21 | ||||||||||||||
| MBI (99mTc-sestamibi) | 300 МБк (8 мКи) a | 19 | 18 | 16 | 13 | 9 | P | P | P | 18 ФДГ) 9 0488 | 370 МБк (10 мКи) | 81 | 75 | 68 | 57 | 40 | 20 |
| Риск радиационно-вызванного рака | Смерть | 9048 .01,8 | 1,1 | 0,6 | 0,3 | 0,2 | 0,1 | ||||||||||
| Только DBT (2 просмотра) | 3,0–4,5 | 1,8–2,3 | 1,1–1,68 | 0,3–0,4 | 0,2 | 0,1 | |||||||||||
| DBT (1 вид) + DM (другой вид) | 3,0–3,75 | 1,8–2,3 | 1,1–1,3 | 0,6–0,7 | 0,3 | 0,20.1 | |||||||||||
| DBT + DM (каждый в 2 просмотрах) | 6,0–7,5 | 3,7–4,6 | 2,1–2,6 | 1,1–1,4 | 0,5–0,7 | 0,3–0,4 | 0,1–0,2 | ||||||||||
| ЦТ всей груди | 6,0–11,0 | 3,7–6,7 | 2,1–3,9 | 1,1–2,1 | 0,5–1,0 | 0,3–0,6 | 0,1–0,2 | ||||||||||
| Доза | |||||||||||||||||
| BSGI (99mTc-sestamibi) | 1110 МБк (30 мКи) | 40 | 40 | 40 | 40 | ||||||||||||
| МБИ (99mTc-sestamibi) | 300 МБк (8 мКи) a | 9 | 9 | 8 | 7 | 5 | 3 | ||||||||||
| FD 370 МБк (10 мКи) | 32 | 31 | 28 | 26 | 21 | 13 | |||||||||||
Расчетные случаи радиационной заболеваемости раком (верхняя таблица) и смертности (нижняя таблица) на 100000 женщин, подвергшихся воздействию указанных доз для различных существующих и предполагаемых методов скрининга, в зависимости от возраста на момент облучения
| . | . | Риск возникновения рака, вызванного радиацией . | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Метод проверки . | Расчетная MGD (мГр) . | Возраст 30 . | Возраст 40 . | Возраст 50 . | Возраст 60 . | Возраст 70 . | Возраст 80 . | |||||
| Цифровая маммография | 3,0 | 7,6 | 4,2 | 2,1 | 0,9 | 0,4 | 0,1 | |||||
| только DBT (2 просмотра) | 6–11,4 | 4,2–6,3 | 2,1–3,2 | 0,9–1,4 | 0,4–0,5 | 0,1–0,2 | ||||||
| DBT (1 вид) + DM (другой вид) | 3,0–3,75 | 7,6–9,5 | 4,2–5,3 | 2,1–2,6 | 0,9–1,2 | 0,4–0,5 | 0,1–0,2 | |||||
| DBT + DM (каждый в 2 просмотрах) | 6,0–7,5 | 15– 19 | 8,5–11 | 4,2–5,3 | 1,9–2,3 | 0.7–0,9 | 0,2–0,3 | |||||
| CT всей груди | 6,0–11,0 | 15–28 | 8,5–16 | 4,2–7,7 | 1,9–3,4 | 0,7–1,3 | 0,2 0,4 | |||||
| Управляемая доза | ||||||||||||
| BSGI (99mTc-sestamibi) | 9048 | 60 | 42 | 21 | ||||||||
| МБК (99mTc-sestamibi) | 300 МБк (8 мКи) a | 19 | 18 | 16 | 13 9 | 9048 9048 9048 PEM (F-18 FDG)370 МБк (10 мКи) | 81 | 75 | 68 | 57 | 40 | 20 |
| Риск рад. Смерть от рака, вызванного инфекцией | ||||||||||||
| Цифровая маммография | 3.0 | 1,8 | 1,1 | 0,6 | 0,3 | 0,2 | 0,1 | |||||
| Только DBT (2 просмотра) | 3,0–4,5 | 1,8–2,3 | 1,1–1,68 | 0,3–0,4 | 0,2 | 0,1 | ||||||
| DBT (1 вид) + DM (другой вид) | 3,0–3,75 | 1,8–2,3 | 1,1–1,3 | 0,6–0,7 | 0,3 | 0,20.1 | ||||||
| DBT + DM (каждый в 2 просмотрах) | 6,0–7,5 | 3,7–4,6 | 2,1–2,6 | 1,1–1,4 | 0,5–0,7 | 0,3–0,4 | 0,1–0,2 | |||||
| ЦТ всей груди | 6,0–11,0 | 3,7–6,7 | 2,1–3,9 | 1,1–2,1 | 0,5–1,0 | 0,3–0,6 | 0,1–0,2 | |||||
| Доза | ||||||||||||
| BSGI (99mTc-sestamibi) | 1110 МБк (30 мКи) | 40 | 40 | 40 | 40 | |||||||
| МБИ (99mTc-sestamibi) | 300 МБк (8 мКи) a | 9 | 9 | 8 | 7 | 5 | 3 | |||||
| FD 370 МБк (10 мКи) | 32 | 31 | 28 | 26 | 21 | 13 | ||||||
| . | . | Риск возникновения рака, вызванного радиацией . | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Метод проверки . | Расчетная MGD (мГр) . | Возраст 30 . | Возраст 40 . | Возраст 50 . | Возраст 60 . | Возраст 70 . | Возраст 80 . | ||||||||||
| Цифровая маммография | 3.0 | 7,6 | 4,2 | 2,1 | 0,9 | 0,4 | 0,1 | ||||||||||
| Только DBT (2 просмотра) | 3,0–4,5 | 7,6–11,4 | 4,2–6,3 | 0,9–1,4 | 0,4–0,5 | 0,1–0,2 | |||||||||||
| DBT (1 вид) + DM (другой вид) | 3,0–3,75 | 7,6–9,5 | 4,2–5,3 | 2,1–2,6 | 0,9–1,2 | 0,4–0.5 | 0,1–0,2 | ||||||||||
| DBT + DM (каждый в 2 ракурсах) | 6,0–7,5 | 15–19 | 8,5–11 | 4,2–5,3 | 1,9–2,3 | 0,70–0,9 | 0,2–0,3 | ||||||||||
| CT всей груди | 6,0–11,0 | 15–28 | 8,5–16 | 4,2–7,7 | 1,9–3,4 | 0,7–1,3 | 0,2–0,4 | Управляемая доза | |||||||||
| BSGI (99mTc-sestamibi) | 82487 8248 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 9048 | 42 | 21 | ||||||||||||||
| MBI (99mTc-sestamibi) | 300 МБк (8 мКи) a | 19 | 18 | 16 | 13 | 9 | P | P | P | 18 ФДГ) 9 0488 | 370 МБк (10 мКи) | 81 | 75 | 68 | 57 | 40 | 20 |
| Риск радиационно-вызванного рака | Смерть | 9048 .01,8 | 1,1 | 0,6 | 0,3 | 0,2 | 0,1 | ||||||||||
| Только DBT (2 просмотра) | 3,0–4,5 | 1,8–2,3 | 1,1–1,68 | 0,3–0,4 | 0,2 | 0,1 | |||||||||||
| DBT (1 вид) + DM (другой вид) | 3,0–3,75 | 1,8–2,3 | 1,1–1,3 | 0,6–0,7 | 0,3 | 0,20.1 | |||||||||||
| DBT + DM (каждый в 2 просмотрах) | 6,0–7,5 | 3,7–4,6 | 2,1–2,6 | 1,1–1,4 | 0,5–0,7 | 0,3–0,4 | 0,1–0,2 | ||||||||||
| ЦТ всей груди | 6,0–11,0 | 3,7–6,7 | 2,1–3,9 | 1,1–2,1 | 0,5–1,0 | 0,3–0,6 | 0,1–0,2 | ||||||||||
| Доза | |||||||||||||||||
| BSGI (99mTc-sestamibi) | 1110 МБк (30 мКи) | 40 | 40 | 40 | 40 | ||||||||||||
| МБИ (99mTc-sestamibi) | 300 МБк (8 мКи) a | 9 | 9 | 8 | 7 | 5 | 3 | ||||||||||
| FD 370 МБк (10 мКи) | 32 | 31 | 28 | 26 | 21 | 13 | |||||||||||
Оценка степени риска
Оценка соотношения пользы и радиационного риска была сделана рядом авторов (47–53).Здесь приведены лишь некоторые оценки. Yaffe и Mainprize оценили соотношение пользы к радиационному риску при скрининговой маммографии, предполагая дозу 3,7 мГр на обе груди, схему скрининга, аналогичную рекомендованной Американским онкологическим обществом (ежегодный скрининг в возрасте 40–55 лет с последующим скринингом раз в два года). в возрасте от 55 до 74 лет), и предполагая снижение смертности на 24% в результате скрининга (47). Они оценили риски с точки зрения смертности от рака груди из-за радиации в результате скрининга (10,7 на 100000 женщин) и преимущества с точки зрения предотвращенных смертей от рака груди благодаря скринингу (497 на 100000 женщин), что дало соотношение пользы к радиационному риску. оценка 47: 1.С точки зрения количества лет жизни риск потери лет жизни из-за радиации в результате скрининга составлял 136,4 на 100 000, а количество лет жизни, полученных в результате скрининга, составляло 10 670 на 100 000, что дает соотношение пользы к радиационному риску 78. : 1. Более высокий риск соотношения пользы и радиации с точки зрения продолжительности жизни происходит потому, что большинство смертей от рака груди происходит в течение десяти лет после постановки диагноза, в то время как смерть от рака груди, вызванного радиацией, наиболее вероятна через два-три десятилетия после облучения. Недавнее модельное исследование Yaffe et al. Оценило снижение смертности на 42% при ежегодном скрининге в возрасте 40–49 лет и двухгодичном скрининге в возрасте 50–74 лет (48).Если использовать это значение снижения смертности, уже благоприятное соотношение пользы и радиационного риска увеличивается на 75%.
Преимущества в отношении смертности от методов скрининга, отличных от маммографии, неизвестны, но вполне вероятно, что методы с более высокими показателями выявления рака (CDR) в той же популяции приведут к большему снижению смертности. Исследования показали, что у DBT на 29–89% выше CDR, чем у DM в скрининговых популяциях (54–63). При оценке соотношения пользы к радиационным рискам для ДПТ или других методов следует принимать во внимание их увеличение дозы по сравнению с DM, в дополнение к их более высокому CDR (как суррогат для снижения смертности).
Соотношение пользы к радиационному риску — это один из способов сравнить новые или предлагаемые методы скрининга со скрининговой маммографией. Например, Хендрик и Треденник сравнили соотношение пользы и радиационного риска при уменьшенной дозе МБИ (полученная доза 300 МБк или 8 мКи, полученная доза 240 МБк или 6,4 мКи) с DM (64). Хотя было показано, что MBI с уменьшенной дозой имеет намного более высокий CDR, чем DM (для распространенных скринингов MBI), соотношение польза / радиационный риск было выше для DM (в 2,6 раза для скрининга в возрасте от 40 до 49 лет, вплоть до в 10 раз для возрастной группы 70–79 лет), чем для MBI с уменьшенной дозой.Недавняя работа предполагает, что MBI может быть способен к сопоставимому обнаружению рака груди примерно при половине этой уменьшенной дозы (150 МБк или 4 мКи) с новыми алгоритмами обработки изображений (65). Brown и Covington недавно обновили оценки соотношения пользы и риска для DM и DBT с различными стратегиями приобретения и MBI с уменьшенными дозами для сжатой груди различной толщины (66).
Заключение
Большинство современных методов скрининга, основанных на рентгеновских лучах, включая DM и DBT, имеют небольшой или незначительный риск заболеваемости или смерти от рака, вызванного радиацией.Перспективные методы скрининга, такие как CEM, имеют аналогичный небольшой риск рака. Перспективные методы скрининга, которые включают инъекции радионуклидов, такие как BSGI, MBI и PEM, имеют значительно более высокий риск рака, если не используются эффективные системы обнаружения и сниженные вводимые дозы. Оценка соотношения пользы к радиационному риску очень благоприятна для скрининговой маммографии, когда DM или другие методы имеют равные или более высокие уровни выявления рака и столь же низкие дозы облучения.
Финансирование
Не объявлено.
Заявление о конфликте интересов
Д-р Хендрик — консультант GE Healthcare по новым технологиям визуализации груди.
Список литературы
3.Хендрик
РЭ
.Дозы радиации и риск рака по результатам визуализационных исследований груди
.Радиология
2010
;257
(1
):246
—253
.6.М Али
RMK
,Англия
A
,McEntee
MF
,Mercer
CE
,Tootell
A
,Hogg
P
.Эффективный пожизненный радиационный риск для ряда национальных программ скрининга маммографии
.Радиография (Лондон)
2018
;24
(3
):240
—246
.7.Секопулос
Я
,Suryanarayanan
S
,Vedantham
S
,D’Orsi
CJ
,Karellas
A
.Доза облучения органов и тканей при маммографии: Монте-Карло и фантомное исследование
.Радиология
2008
;246
(2
):434
—443
.8.Секопулос
Я
,Хендрик
RE
.Маммография и риск рака щитовидной железы
.AJR Am J Roentgenol
2012
;198
(3
):705
—707
. 9.Хаммерштайн
ГР
,Miller
DW
,Белый
DR
,Masterson
ME
,Woodard
HQ
,Laughlin
JS
.Поглощенная доза облучения при маммографии
.Радиология
1979
;130
(2
):485
—491
. 11.Международная комиссия по радиологической защите
.Рекомендации Международной комиссии по радиологической защите 2007 г. Публикация МКРЗ 103
.Ann ICRP
2007
;37
(2–4
):1
—332
.13.Пизано
ЭД
,Gatsonis
C
,Hendrick
E
и др.;Исследовательская группа по исследованию цифровых маммографических изображений (DMIST)
.Диагностические характеристики цифровой маммографии по сравнению с пленочной маммографией для скрининга рака груди
.N Engl J Med
2005
;353
(17
):1773
—1783
. 14.Хендрик
РЭ
,Пизано
ЭД
,Авербух
А
и др.Сравнение параметров получения и дозы на грудь в цифровой маммографии и экранно-пленочной маммографии в Испытании цифрового маммографического скрининга Американского колледжа радиологии сети визуализации
.AJR Am J Roentgenol
2010
;194
(2
):62
—369
.15.Молодой
KC
,Одуко
JM
.Дозы радиации, полученные в рамках программы скрининга груди Соединенного Королевства в 2010–2012 годах
.Br J Радиол
2016
;89
(1058
):20150831
. 16.Дженнаро
G
,Bernardi
D
,Houssami
N
.Доза облучения при цифровом томосинтезе груди по сравнению с цифровой маммографией: анализ по просмотрам
.евро Радиол
2018
;28
(2
):573
—581
. 17.Skaane
-П
,Bandos
AI
,Gullien
R
и др.Сравнение только цифровой маммографии и цифровой маммографии плюс томосинтез в программе популяционного скрининга
.Радиология
2013
;267
(1
):47
—56
.18.Сван
TM
,Houssami
N
,Sechopoulos
I
,Mattsson
S
.Обзор оценок дозы облучения при цифровом томосинтезе молочных желез по сравнению с таковыми при цифровой маммографии с полным полем с двумя проекциями
.Грудь
2015
;24
(2
):93
—99
.19.Маршалл
NW
,Bosmans
H
;Медицинская физика UZ Leuven
.Применение проекта протокола EUREF для контроля качества систем цифрового томосинтеза молочных желез
.Левен, Бельгия: Бельгийская ассоциация больничных физиков
,2014
.20.Кокмартин
л
,Marshall
NW
,Van Ongeval
C
и др.Сравнение цифрового томосинтеза груди и цифровой двумерной маммографии с использованием гибридного теста производительности
.Phys Med Biol
2015
;60
(10
):3939
—3958
. 21.Dromain
С
,Thibault
F
,Diekmann
F
и др.Цифровая маммография с двойным энергетическим контрастированием и контрастным усилением: первые клинические результаты многопозиционного исследования
.Рак молочной железы Res
2012
;14
(3
):R94
.22.Джеймс
JR
,Pavlicek
W
,Hanson
JA
,Boltz
TF
,Patel
BK
.Доза облучения груди с CESM по сравнению с 2D FFDM и 3D томосинтезирующей маммографией
.AJR Am J Roentgenol
2017
;208
(2
):362
—372
. 23.Линдфорс
к.к. ,Boone
JM
,Nelson
TR
,Yang
K
,Kwan
AL
,Miller
DF
.Специализированная компьютерная томография молочных желез: первоначальный клинический опыт
.Радиология
2008
;246
(3
):725
—733
. 24.О’Коннелл
А
,Conover
D
,Zhang
Y
и др.КТ с коническим лучом для визуализации груди: доза облучения, охват груди и качество изображения
.AJR Am J Roentgenology
2010
;195
(2
):496
—509
.25.Ведантам
S
,Shi
L
,Karellas
A
,O’Connell
AM
,Conover
DL
.Персонализированные оценки дозы облучения от специальной компьютерной томографии груди в диагностической популяции и сравнение с диагностической маммографией
.Phys Med Biol
2013
;58
(22
):7921
—7936
.27.Родос
DJ
,Hruska
CB
,Phillips
SW
,Whaley
DH
,O’Connor
MK
.Специальная двухканальная гамма-визуализация для скрининга рака груди у женщин с маммографически плотной грудью
.Радиология
2011
;258
(1
):106
—118
.28.Родос
DJ
,Hruska
CB
,Conners
AL
и др.Журнальный клуб: молекулярная визуализация груди при сниженной дозе облучения для дополнительного скрининга груди с плотной маммографией
.AJR Am J Roentgenol
2015
;204
(2
):241
—251
.29.Swanson
TN
,Troung
DT
,Paulsen
A
,Hruska
CB
,O’Connor
MK
.Адсорбция 99mTc-сестамиби на пластмассовых шприцах: оценка факторов, влияющих на степень адсорбции, и их влияние на клинические исследования
.J Nucl Med Technol
2013
;41
(4
):247
—252
.30.Розен
EL
,Turkington
TG
,Soo
MS
,Baker
JA
,Coleman
RE
.Выявление первичной карциномы молочной железы с помощью специального маммографического устройства FDG PET с большим полем обзора: первоначальный опыт
.Радиология
2005
;234
(2
):527
—534
.32.Престон
DL
,Ron
E
,Tokuoka
S
и др.Заболеваемость твердым раком у выживших после атомной бомбардировки: 1958–1998
.Radiat Res
2007
;168
(1
):1
—64
. 33.Престон
DL
,Симидзу
Y
,Pierce
DA
,Suyama
A
,Mabuchi
K
.Исследования смертности выживших после атомной бомбардировки: отчет 13 — смертность от солидного рака и нераковых заболеваний: 1950–1997
.Radiat Res
2003
;160
(4
):381
—407
. 34.Престон
DL
,Pierce
DA
,Shimizu
Y
и др.Влияние недавних изменений в дозиметрии выживших после атомной бомбы на оценки риска смертности от рака
.Radiat Res
2004
;162
(4
):377
—389
0,35.Национальный исследовательский совет национальных академий
.Риски для здоровья от воздействия низких уровней ионизирующего излучения: BEIR VII, фаза 2 — Комитет по оценке рисков для здоровья от воздействия низких уровней ионизирующего излучения
.Вашингтон, округ Колумбия
:National Academies Press
,2006
. 36.Двойная
EB
,Mabuchi
K
,Cullings
HM
и др.Долгосрочные радиационные последствия для здоровья уникальной человеческой популяции: уроки, извлеченные у выживших после атомной бомбардировки Хиросимы и Нагасаки
.Disaster Med Public Health Prep
2011
;5 (Дополнение 1)
:S122
—S133
. 37.Миллер
AB
,Howe
GR
,Sherman
GJ
и др.Смертность от рака груди после облучения при рентгеноскопических исследованиях у больных туберкулезом
.N Engl J Med
1989
;321
(19
):1285
—1289
0,38.Дуди
ММ
,Lonstein
JE
,Stovall
M
,Hacker
DG
,Luckyanov
N
,Land
CE
.Смертность от рака груди после диагностической рентгенографии: результаты Когортного исследования сколиоза в США
.Spine (Phila Pa 1976)
2000
;25
(16
):2052
—2063
. 39.Трэвис
фунтов
,Hill
DA
,Dores
GM
и др.Рак груди после лучевой и химиотерапии у молодых женщин с болезнью Ходжкина
.JAMA
2003
;290
(4
):465
—475
.40.ван Леувен
FE
,Klokman
WJ
,Stovall
M
и др.Роль дозы облучения, химиотерапии и гормональных факторов при раке груди после болезни Ходжкина
.J Natl Cancer Inst
2003
;95
(13
):971
—980
.41.Хенди
WR
,O’Connor
MK
.Радиационные риски медицинской визуализации: отделяя факт от фантазии
.Радиология
2012
;264
(2
):312
—321
.42.Кардарелли
JJ
2-й ,Улш
БА
.пора выйти за рамки линейной беспороговой теории для защиты от малых доз радиации
.Доза реакция
2018
;16
(3
):15518779651
. 43.Бреннер
AV
,Preston
DL
,Sakata
R
и др.Заболеваемость раком груди в исследовании продолжительности жизни выживших после атомной бомбардировки: 1958-2009 гг.
.Radiat Res
2018
;190
(4
):433
—444
. 44.Земля
CE
,Tokunaga
M
,Koyama
K
и др.Заболеваемость раком женской груди среди выживших после атомной бомбардировки, Хиросима и Нагасаки, 1950–1990 годы
.Radiat Res
2003
;160
(6
):707
—717
.45.Меттлер
FA
Младший ,Huda
W
,Yoshizumi
TT
,Mahesh
M
.Эффективные дозы в радиологии и диагностической ядерной медицине: каталог
.Радиология
2008
;248
(1
):254
—263
. 46.Мандельблатт
JS
,Stout
NK
,Schechter
CB
и др.Совместное моделирование преимуществ и вреда, связанных с различными стратегиями скрининга рака груди в США
.Ann Intern Med
2016
;164
(4
):215
—225
. 47.Яффе
МДж
,Mainprize
JG
.Риск радиационно-индуцированного рака груди в результате маммографического обследования
.Радиология
2011
;258
(1
):98
—105
. 48.Яффе
МДж
,Mittmann
N
,Lee
P
и др.Клинические результаты моделирования стратегий маммографического скрининга
.Представитель здравоохранения
2015
;26
(12
):9
—15
.49.Фейг
SA
,Хендрик
RE
.Радиационный риск при скрининговой маммографии женщин в возрасте 40–49 лет
.J Natl Cancer Inst Monogr
1997
;22
:119
—124
.50.Ротенберг
LN
,Feig
SA
,Hendrick
RE
и др.Отчет NCRP № 149. Руководство по маммографии и другим процедурам визуализации молочных желез
.Bethesda, MD
:Национальный совет по радиационной защите и измерениям
,2004
, см. Главу 7.51.Беррингтон де Гонсалес
А
,Ривз
G
.Маммографический скрининг в возрасте до 50 лет в Великобритании: сравнение радиационных рисков с преимуществами смертности
.Br J Cancer
2005
;93
(5
):590
—596
,52.Мильоретти
DL
,Lange
J
,van den Broek
JJ
и др.Заболеваемость и смертность от рака груди, вызванного радиацией, по результатам цифрового маммографического скрининга: модельное исследование
.Ann Intern Med
2016
;164
(4
):205
—214
.53.Уоррен
LM
,Dance
DR
,Young
KC
.Радиационный риск обследования груди в Англии с помощью цифровой маммографии
.Br J Радиол
2016
;89
(1067
):20150897
. 54.Friedewald
SM
,Rafferty
EA
,Rose
SL
и др.Скрининг рака груди с использованием томосинтеза в сочетании с цифровой маммографией
.JAMA
2014
;311
(24
):2499
—2507
.55.Conant
EF
,Beaber
EF
,Sprague
BL
и др.Скрининг рака груди с использованием томосинтеза в сочетании с цифровой маммографией по сравнению с одной только цифровой маммографией: когортное исследование в рамках консорциума PROSPR
.Лечение рака молочной железы
2016
;156
(1
):109
—116
. 56.Маккарти
AM
,Kontos
D
,Synnestvedt
M
и др.Результаты скрининга после внедрения цифрового томосинтеза груди в программу скрининга населения
.J Natl Cancer Inst
2014
;106
(11
):dju316
. 57.Роза
SL
,Tidwell
AL
,Bujnoch
LJ
,Kushwaha
AC
,Nordmann
AS
,Sexton
R
Jr. обсервационное исследование.AJR Am J Roentgenol
2013
;200
(6
):1401
—1408
. 58.Макдональдс
ES
,McCarthy
AM
,Akhtar
AL
,Synnestvedt
MB
,Schnall
M
,Conant
EF
.Исходная скрининговая маммография: сравнение полноформатной цифровой маммографии с цифровым томосинтезом груди
.AJR Am J Roentgenol
2015
;205
(5
):1143
—1148
. 59.Макдональдс
ES
,Oustimov
A
,Weinstein
SP
,Synnestvedt
MB
,Schnall
M
,Conant
EF
.Эффективность цифрового томосинтеза груди по сравнению с цифровой маммографией: анализ результатов 3-летнего скрининга рака груди
.JAMA Oncol
2016
;2
(6
):737
—743
.60.Шарп
РЭ
Младший ,Venkataraman
S
,Phillips
J
и др.Повышенная частота выявления рака и вариации в частоте отзыва в результате внедрения трехмерного цифрового томосинтеза груди в программу популяционного скрининга
.Радиология
2016
;278
(3
):698
—706
.61.Гринберг
JS
,Javitt
MC
,Katzen
J
,Michael
S
,Holland
AE
.Метрики клинической эффективности трехмерного цифрового томосинтеза груди по сравнению с двумерной цифровой маммографией для скрининга рака груди в общественной практике
.AJR Am J Roentgenol
2014
;203
(3
):687
—693
0,62.Хули
RJ
,Durand
MA
,Philpotts
LE
.Достижения в области цифрового томосинтеза груди
.AJR Am J Roentgenol
2017
;208
(2
):256
—266
.63.Паттачини
-П
,Nitrosi
A
,Giorgi Rossi
P
и др. ;Рабочая группа RETomo
.Цифровая маммография в сравнении с цифровой маммографией плюс томосинтез для скрининга рака груди: рандомизированное исследование томосинтеза Реджио Эмилии
.Радиология
2018
;288
(2
):375
—385
.64.Хендрик
РЭ
,Tredennick
T
.Повышение радиационного риска специфической гамма-визуализации груди по сравнению с маммографией при скрининге бессимптомных женщин с плотной грудью
.Радиология
2016
;281
(2
):583
—588
0,65.Тао
AT
,Hruska
CB
,Conners
AL
и др.Снижение дозы при молекулярной визуализации груди с новым алгоритмом обработки изображений
.AJR Am J Roentgenol
2020
;214
(1
):185
—193
0,66.Коричневый
м
,Ковингтон
М
.Сравнительное соотношение пользы и радиационного риска молекулярной визуализации молочной железы, двумерной полноформатной цифровой маммографии с томосинтезом и без него и синтетической маммографии с томосинтезом
.Радиология.
Опубликовано онлайн: 27 сентября 2019 г. doi: 10.1148 / rycan.20191.© Society of Breast Imaging 2020. Все права защищены. Для получения разрешений обращайтесь по электронной почте: [email protected]
Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера на прием файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Величины и единицы ионизирующего излучения: Ответы по охране труда
В подземных урановых рудниках, а также в некоторых других рудниках радиационное облучение происходит в основном из-за переносимого по воздуху газообразного радона и его твердых короткоживущих продуктов распада, называемых дочерними или дочерними продуктами радона. Дочки радона попадают в организм с вдыхаемым воздухом. Доза альфа-частиц в легких зависит от концентрации газа радона и дочерних радонов в воздухе.
Концентрация радона измеряется в пикокюри на литр (пКи / л) или беккерелях на кубический метр (Бк / м 3 ) окружающего воздуха.Концентрация дочерних радоновых частиц измеряется в единицах рабочего уровня (WL), это мера концентрации потенциальных альфа-частиц на литр воздуха.
Облучение работников дочерним радоном выражается в месяцах рабочего уровня (WLM). Один WLM эквивалентен 1 WL экспозиции в течение 170 часов.
1 WL = 130000 МэВ энергия альфа на литр воздуха
= 20,8 мкДж (микроджоулей) энергия альфа на кубический метр (м 3 ) воздуха
WLM = Месяц рабочего уровня
= 1 воздействие WL в течение 170 часов
1 WLM = 3.5 мДж-ч / м 3
Часто люди используют концентрацию газообразного радона (пКи / л) в воздухе для оценки уровня WL дочерних радонов. Такие оценки подвержены ошибкам, поскольку отношение радона к продуктам его распада (дочерним радону) не является постоянным.
Коэффициент равновесия — это отношение активности всех короткоживущих дочерних радонов к активности родительского газа радона. Фактор равновесия равен 1, когда оба равны. Дочерняя активность радона обычно меньше активности радона, и, следовательно, коэффициент равновесия обычно меньше 1.
мДж-ч / м 3 = миллиджоуль-часы / на кубический метр
МБк-ч / м 3 = мегабеккерель-часы на кубический метр
Джоуль — единица энергии
1 Дж = 1 Вт-секунда = Энергия, передаваемая за одну секунду источником питания мощностью 1 Вт
1 калория = 4,2 Дж
МБк / м 3 = мегабеккерель на кубический метр
WLM = рабочий уровень в месяцах
Источники излучения, дозы и рак
Теперь мы объединим информацию из различных других диаграмм в этом разделе.Однако сначала помните, что без радиационного облучения вероятность заболеть раком составляет 1 к 2,4 (или 42 процента). Это означает, что из 100 средних людей, которых я знаю, включая меня, 42 из нас могут когда-нибудь заболеть раком. Кроме того, если я пойду к врачу и сделаю КТ органов малого таза (доза <= 10 мЗв), мои шансы на рак останется 1 из 2,4 (или 42 процента). Если я сделаю 10 снимков компьютерной томографии, то мои шансы на рак теперь составляют 1 из 2,3 (или 43,7 процента). Если я живу рядом с забором по периметру вокруг атомной электростанции в течение 40 лет, мои шансы на рак - 1 к 2.4, то же, что и в исходном состоянии, без дополнительного облучения.
С этой информацией мы теперь лучше понимаем приблизительный риск доз облучения. Мы видим, что дозы облучения менее 100 мЗв вряд ли вызовут вредные эффекты и лишь немного увеличат наши шансы заболеть раком. Обеспокоенность или нет — все еще личное решение. Важно принять меры, чтобы снизить воздействие потенциально вредных агентов на нас. Это личная ответственность за себя и свою семью.
Однако мы должны стараться принимать обоснованные решения, основываясь на реальных, а не предполагаемых рисках в нашей повседневной жизни. Когда мы делаем это, мы можем снизить или устранить более высокие риски, которые мы контролируем, и не мучиться из-за снижения рисков, которые и так низки. Часто мы считаем, что присутствие радиации сопряжено с высоким риском. Как видно из диаграмм и информации в этом разделе, мы знаем, что это неправда. Чтобы сравнить шансы заболеть раком в результате радиационного облучения с другими, более распространенными шансами заболеваний или несчастных случаев, см. Наш Таблица вероятностей.
Рентгеновские лучи и рак
Давайте посмотрим на риск рака с помощью рентгеновских снимков. Вот источники радиации, приблизительная доза радиации, которую вы получаете от них, и насколько ваши шансы заболеть раком увеличиваются в вашей жизни в результате этой дозы радиации. Помните, что без дополнительной дозы облучения ваши шансы заболеть раком в течение жизни составляют примерно 10 из 24 (или 1 из 2,4) или 42 процента.
| Источник излучения | Эффективная доза | Дополнительные шансы заболеть раком ‡ * |
|---|---|---|
прикусная стоматологическая пленка годовая доза, живущая на периметре АЭС рентгеновский снимок черепа рентген грудной клетки | Меньше (<) или равно (=) 0.1 мЗв | <= 1 из 60 000 |
рентген позвоночника рентген брюшной полости рентген таза рентген бедра маммограмма | <= 1 мЗв | <= 1 из 6000 |
почечная серия рентгеновских лучей рентгеновских лучей, связанных с барием головка CT + рентген любого позвоночника серия годового естественного радиационного фона большинство ядерных исследований печени, почек, костей, мозга или легких | <= 5 мЗв | <= 1 из 1,200 |
бариевая клизма КТ грудной клетки, брюшной полости или таза + | <= 10 мЗв | <= 1 из 600 |
Катетеризация сердца коронарография другие рентгенологические исследования сердца большинство сканирований сердца в ядерной медицине | <= 50 мЗв | <= 1 из 120 |
‡ Числа «шансов» в этом столбце представляют собой приблизительное количество случаев рака; действительное число в каждом случае может быть равно нулю до указанного числа.Например, шансы 1 из 120 действительно равны «от нуля до 1» из 120. * Номера Национального совета по радиационной защите (ныне Управление здравоохранения Соединенного Королевства) + CT = компьютерная томография; специализированное рентгеновское обследование. | ||
Итак, вы можете видеть, что даже при многих видах радиационного облучения и медицинских обследованиях обычные ежедневные шансы заболеть раком (1 к 2.4) намного выше, чем добавленные шансы заболеть раком от радиационного облучения.
Ограничение радиационного облучения | Michigan Medicine
Департамент радиологии Мичиганского университета стремится снизить уровень радиационного облучения наших пациентов. Ваша безопасность является нашим приоритетом — от использования новейшего оборудования для более быстрых исследований до проведения обследований пациентов при минимально необходимом облучении.
Что следует знать об излучении
- Хотя никаких крупномасштабных исследований риска рака от диагностического излучения не существует, данные японских выживших после атомной бомбардировки, подвергшихся воздействию низких уровней радиации, предполагают, что частое воздействие низких уровней радиации может увеличить риск в конечном итоге развития рака, особенно если человек молодой.
- Уровень радиации часто измеряется в единицах, известных как зиверты. Обычно используется порог в 100 тысячных зиверта или 100 миллизивертов (мЗв). Ниже 100 мЗв, не волнуйтесь; выше этого числа, мы думаем, что вы подвергаетесь повышенному риску. Наша средняя доза облучения в Университете Мичигана сейчас составляет 9 мЗв.
- Пациентам следует искать аккредитованный центр визуализации и сертифицированных врачей, что увеличит шансы на лучшее исследование при самой низкой дозе.
- Вам не нужно проходить обследование.Однако это компромисс: если вы сдадите экзамен, вы получите необходимую диагностическую информацию. Если вы не пройдете обследование, вы сохраните излучение, но не получите диагностической информации.
- Самое важное сообщение, касающееся радиации, — это относительный риск. Пациентам практически всегда лучше пройти необходимое визуализационное исследование, чем избегать связанного с ним умеренного облучения.
Большие шаги по снижению уровня радиации для наших пациентов
Мы приняли ряд важных мер по минимизации радиационного облучения без ущерба для качества изображения, в том числе:
- Наша группа контроля качества физики работает вместе с радиологами и технологами для определения и приобретения систем визуализации с функциями, минимизирующими дозу облучения.
- Цифровые детекторы рентгеновского излучения, специальные фильтры рентгеновского пучка и другие новые технологии снижают дозы облучения в радиографии, маммографии и рентгеноскопии.
- Использование более чувствительного оборудования для визуализации в ядерной медицине (например, однофотонной эмиссионной компьютерной томографии и позитронно-эмиссионных томографов) позволяет нам использовать меньшие дозы радиоактивных индикаторов (радиоактивная молекула, используемая в определенных тестах визуализации, чтобы помочь найти проблемы в организме).
- Мы ограничиваем сканируемую / рентгеновскую область тела до минимально возможного размера.
- Проверьте все системы, чтобы убедиться, что они работают правильно.
- Сосредоточьтесь на способах дальнейшего снижения радиационного облучения за счет постоянных исследований с нашим инженерным отделом.
Снижение радиации от компьютерной томографии
КТ (компьютерная томография) исследования, известные как компьютерная томография или компьютерная томография, приобрели огромную популярность, потому что они являются чрезвычайно эффективным инструментом в диагностике и лечении заболеваний, используемым для всего, от выявления областей мозга, пораженных инсультом, и головы. травм, обнаружению патологий легких, диагностике заболеваний брюшной полости, таких как аппендицит, оценке ишемической болезни сердца.В отделениях неотложной помощи КТ являются предпочтительным инструментом из-за их скорости и точности диагностики.
Меры, которые мы принимаем для уменьшения радиации при компьютерной томографии, включают:
- Настройка сканирования в зависимости от размера и веса пациента или сканируемой части тела.
- Устранение ненужных экзаменов.
- Инвестиции в компьютерные томографы с новейшими аппаратными и программными средствами, минимизирующими радиационное воздействие. Мы используем General Electric Discovery CT750 HD, который обеспечивает снижение дозы облучения наших пациентов до 50%, а также качество изображения высокой четкости для любой части тела.
- Наш реестр радиационного облучения, который в настоящее время находится в разработке, предоставит эталоны для определения оптимального уровня радиации для каждого КТ-исследования.
- В исследовании повышения качества Blue Cross Blue Shield в 40 больницах и центрах визуализации, которое называется Консорциумом Advanced Cardiovascular Imaging Consortium, наша команда кардиологической компьютерной томографии снизила среднее воздействие КТ-излучения на 43 процента.
- Использование МРТ или ультразвука, если любой из них считается эффективной альтернативой.
Для радиологических центров важна аккредитация
Всегда спрашивайте, аккредитован ли центр визуализации. Центры услуг Medicare и Medicaid утвердили три органа для аккредитации программ диагностической визуализации: Американский колледж радиологии, Межобщественную комиссию по аккредитации и Совместную комиссию. (Для аккредитации объекта требуется только один из трех органов по аккредитации.) Для аккредитации существует пять требований:
- Квалификация персонала для немедицинского медицинского персонала, медицинских руководителей и наблюдающих врачей
- Качество изображения
- Характеристики оборудования
- Нормы безопасности для персонала и пациентов
- Обеспечение качества и контроль качества
Пока что этот процесс аккредитации является обязательным только для амбулаторных учреждений, но, скорее всего, он станет обязательным и для больниц.

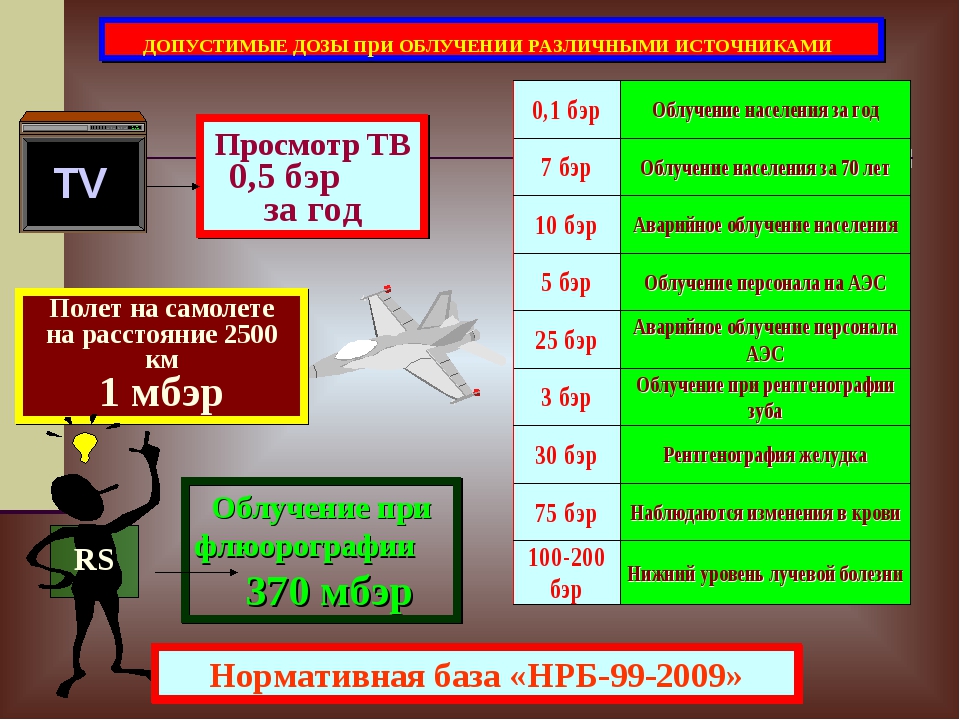 – Мы также занимаемся настройкой и калибровкой различных дозиметров, а для этого нужны соответствующие источники ионизирующего излучения. Однако эти источники можно использовать и для других целей, например, для работы с биологическими объектами. Облучение проростков лука – это не первый наш подобный опыт, ранее мы проводили серию аналогичных экспериментов с ветвистоусыми рачками, также совместно с научной группой из ИБФ СО РАН. Биологи привозят нам готовые образцы, а мы обеспечиваем необходимые условия и следим за ходом эксперимента».
– Мы также занимаемся настройкой и калибровкой различных дозиметров, а для этого нужны соответствующие источники ионизирующего излучения. Однако эти источники можно использовать и для других целей, например, для работы с биологическими объектами. Облучение проростков лука – это не первый наш подобный опыт, ранее мы проводили серию аналогичных экспериментов с ветвистоусыми рачками, также совместно с научной группой из ИБФ СО РАН. Биологи привозят нам готовые образцы, а мы обеспечиваем необходимые условия и следим за ходом эксперимента». Более ‘/з (33%) этих узлов оказались злокачественными. Анализ потенциальных факторов риска показал высокую степень корреляции (р<0,001) между радиационным воздействием и узловыми образованиями. К сожалению, в приведенном исследовании авторы не имели контрольной группы, однако, согласно предыдущим работам этой же группы ученых, частота пальпируемых узлов среди необлученных пациентов составила не более 0,8—2,7 %.
Более ‘/з (33%) этих узлов оказались злокачественными. Анализ потенциальных факторов риска показал высокую степень корреляции (р<0,001) между радиационным воздействием и узловыми образованиями. К сожалению, в приведенном исследовании авторы не имели контрольной группы, однако, согласно предыдущим работам этой же группы ученых, частота пальпируемых узлов среди необлученных пациентов составила не более 0,8—2,7 %.