Механизм действия гемостатических лекарственных препаратов
Авторы: А.А. Мельник
Продолжение. Начало в № 20.
Коагулянты
А. Коагулянты прямого действия
Фибриноген
Его применяют при гипо- и афибриногенемии, кровотечениях, возникших во время оперативных вмешательств, массивных кровотечениях в акушерстве и гинекологии. При воздействии тромбина на фибриноген происходит образование фибрина (конечного продукта процесса свертывания крови).
Механизм действия. Фибриноген (фактор I) состоит из трех пар неидентичных полипептидных цепей: Аα, Вβ и γ. Они соединены дисульфидными связями и образуют 3 домена, переплетенные между собой (рис. 3).
Тромбин (сериновая протеаза) отщепляет от фибриногена А- и В-пептиды, в результате чего образуется фибрин-мономер.
Тромбин
Раствор тромбина применяется только местно для остановки кровотечений из мелких капилляров и паренхиматозных органов, из костной полости, десен, особенно при болезни Верльгофа, апластической и гипопластической анемии. При кровотечениях из крупных сосудов тромбин не применяется.
Механизм действия. Тромбин (фактор IIа) образуется в организме из протромбина (фактор II) при ферментативной активации тромбопластином (фактор III, протромбиназа). Лекарственный препарат тромбин, связываясь с фибриногеном, переводит его в нерастворимый фибрин.
Тромбин – гетеродимер, состоящий из А-цепи (36 аминокислот) и В-цепи (259 аминокислот), соединенных дисульфидной связью. Этот белок имеет важные структурные особенности: активная область расщепления (60- и γ-петли), центр, связывающий натрий, экзосайт I и экзосайт II. Экзосайт I расположен на В-цепи и участвует в связывании фибриногена [15].
Этот белок имеет важные структурные особенности: активная область расщепления (60- и γ-петли), центр, связывающий натрий, экзосайт I и экзосайт II. Экзосайт I расположен на В-цепи и участвует в связывании фибриногена [15].
Концентрат протромбинового комплекса
Концентрат протромбинового комплекса (КПК) используется для быстрой инактивации антагонистов витамина К. В практике используются 3 различных типа КПК: 4-факторный (4F), 3-факторный (3F) и активированный КПК. Функциональными прокоагулянтными компонентами в 4F-КПК являются витамин К-зависимые коагуляционные факторы II, VII, IX и X.
3F-КПК, в отличие от 4F-КПК, не содержит фактор VII.
Активированный КПК содержит протромбин (фактор II), факторы IX и Х (как 3F-КПК, 4F-КПК), но дополнительно в его состав входит фактор VII в активированной форме (VIIa).
Витамин К-зависимые факторы прокоагуляции (VII, IX, X, протромбин) и витамин К-зависимые антикоагулянтные белки (C и S) изображены как полосы, которые иллюстрируют их различные домены и глобулярные структуры, основанные на современных знаниях их трехмерной конфигурации [16,17] (рис. 4).
4).
4F-КПК применяется при острых кровотечениях и в терапии у пациентов с врожденным или приобретенным дефицитом факторов свертывания [18]. 3F-КПК одобрен для применения во многих странах для лечения гемофилии В. Клинические исследования показывают, что 3F-КПК может также применяться у пациентов с приобретенной недостаточностью факторов протромбинового комплекса, вызванного приемом антагонистов витамина К, хотя и с менее благоприятным результатом, чем 4F-КПК [19-22]. Эффективность активированного КПК была продемонстрирована в нескольких клинических исследованиях [23].
В данном контексте следует отметить концентрат рекомбинантного активированного фактора VII (VIIa). Первоначально он был разработан для лечения кровотечения у пациентов с гемофилией, у которых продуцировались антитела к фактору VIII. В дальнейшем препарат использовали для предотвращения кровотечений, связанных с кардиоваскулярными хирургическими вмешательствами, травмами и внутричерепными кровоизлияниями [24]. В некоторых исследованиях подтвержден положительный эффект концентрата фактора VIIа при лечении витамин К-зависимых кровотечений [25-28]. В одной из недавних публикаций представлены данные об успешном использовании рекомбинантного фактора VIIa и 3F-КПК в лечении внутричерепного кровоизлияния [29]. Оно заключается в доставке необходимого количества уже активированного фактора VIIa к месту повреждения сосуда.
В некоторых исследованиях подтвержден положительный эффект концентрата фактора VIIа при лечении витамин К-зависимых кровотечений [25-28]. В одной из недавних публикаций представлены данные об успешном использовании рекомбинантного фактора VIIa и 3F-КПК в лечении внутричерепного кровоизлияния [29]. Оно заключается в доставке необходимого количества уже активированного фактора VIIa к месту повреждения сосуда.
КПК представляют собой смесь частично очищенных витамин К-зависимых коагуляционных факторов. Их получают из плазмы крови человека и затем лиофилизируют. Содержание КПК, указанное на упаковке лекарственных препаратов 3F-КПК и 4F-КПК, определяется содержанием фактора IX в международных единицах активности (IU) на 1 мг белка согласно рекомендациям Европейской фармакопеи.
Активность активированного КПК выражается в произвольных единицах. Прием некоторых КПК, доступных до середины 90-х годов прошлого века, был ассоциирован с повышенным риском тромбоза [30]. Данные, опубликованные C. Grundman и соавт. [31], подтверждают, что перегрузка протромбином вызывает дисбаланс факторов свертывания и является основным тромбогенным триггером при терапии КПК. В соотвествии с этим баланс уровней коагуляционных факторов может оказывать существенное влияние на безопасность терапии КПК [32]. Относительное количество всех прокоагулянтных витамин К-зависимых факторов свертывания в КПК и плазме практически идентично. Это относится и к протеину С. Однако для белка S их уровни значительно ниже, чем в плазме. Протромбин является наиболее распространенным К-зависимым коагуляционным фактором, в то время как фактор VII присутствует только в следовых количествах как в плазме, так и в 4F-КПК.
Grundman и соавт. [31], подтверждают, что перегрузка протромбином вызывает дисбаланс факторов свертывания и является основным тромбогенным триггером при терапии КПК. В соотвествии с этим баланс уровней коагуляционных факторов может оказывать существенное влияние на безопасность терапии КПК [32]. Относительное количество всех прокоагулянтных витамин К-зависимых факторов свертывания в КПК и плазме практически идентично. Это относится и к протеину С. Однако для белка S их уровни значительно ниже, чем в плазме. Протромбин является наиболее распространенным К-зависимым коагуляционным фактором, в то время как фактор VII присутствует только в следовых количествах как в плазме, так и в 4F-КПК.
Согласно рекомендациям Европейского общества анестезиологов (ESA, 2013) для быстрого ингибирования эффекта пероральных антикоагулянтов перед операцией предлагается использовать КПК (уровень доказательства А) (табл.).
Было показано, что 3F- и 4F-КПК более эффективно, чем рекомбинантный фактор VIIa и свежезамороженная плазма, воздействуют на образование тромбина и уменьшение кровопотери при хирургических вмешательствах и травме независимо от того, применялся ли перед этим варфарин [33, 34].
Б. Коагулянты непрямого действия
Викасол. Фитоменадион
Их применяют при геморрагическом синдроме, связанном с гипопротромбинемией, кровотечениях после ранений, травм и хирургических вмешательств, в составе комплексной терапии дисфункциональных маточных кровотечений, меноррагий.
Механизм действия. Эти лекарственные препараты представляют собой синтетические аналоги витамина К, а их фармакологическое действие обусловлено характерными для него свойствами.
Витамин К присутствует в организме в виде гидрохинона, эпоксида и хинона, постоянно преобразующихся друг в друга. Метаболическая роль витамина К заключается в том, что он является кофактором γ-глутамилкарбоксилазы. Этот фермент осуществляет посттрансляционную модификацию белка, катализируя карбоксилирование глутаминовых остатков (Glu) в белках в γ-карбоксиглутаминовые (Gla) в присутствии О 2 и НСО3/СО2. Активным кофактором для γ-глутамилкарбоксилазы является восстановленная форма витамина К – гидрохинон. В процессе карбоксилирования витамин К-зависимых белков гидрохинон преобразуется в эпоксид [35,36] (рис. 5).
В процессе карбоксилирования витамин К-зависимых белков гидрохинон преобразуется в эпоксид [35,36] (рис. 5).
При карбоксилировании остатка глутаминовой кислоты в различных белках последние приобретают способность связывать ионы кальция. Так происходит активирование протромбина, факторов свертывания VII, IX и X.
Протамина сульфат
Протамина сульфат применяют для нейтрализации действия избыточного экзогенного гепарина, кровотечениях вследствие передозировки гепарина, перед операцией у больных, принимающих гепарин с лечебной целью, после операций на сердце и кровеносных сосудах с экстракорпоральным кровообращением.
Механизм действия. Протамина сульфат – специфический антагонист гепарина (1 мг протамина сульфата нейтрализует 80-120 ЕД гепарина в крови). Протамина сульфат (основание), связываясь с гепарином (кислотой), образует стабильное соединение и вызывает разрушение комплекса гепарина с антитромбином III, что приводит к снижению антикоагулянтной активности гепарина. Эффект протамина сульфата наблюдается уже через несколько минут после введения. Комплексообразование обусловлено обилием катионных групп (за счет аргинина), которые связываются с анионными центрами гепарина.
Эффект протамина сульфата наблюдается уже через несколько минут после введения. Комплексообразование обусловлено обилием катионных групп (за счет аргинина), которые связываются с анионными центрами гепарина.
Гемостатические средства на основе желатина, коллагена, целлюлозы
Желатиновая губка
Первый желатиновый гемостатик был использован в 1945 г. С 1999 г. используются гемостатики в виде пасты из матричных желатиновых компонентов, полученных из говяжьего или свиного сырья с добавлением CaCl 2 и человеческого или животного тромбина. Локальный гемостатический эффект основан на активации тромбоцитов, попадающих в поры губки, формировании на ее поверхности тромбоцитарного агрегата и образовании фибринового сгустка. Данные средства применяют при капиллярных, паренхиматозных и венозных кровотечениях в стоматологии, малой проктологии, абдоминальной хирургии, отоларингологии и гинекологии. Желатиновые гемостатики подтвердили свою эффективность при сложных кровотечениях, возникающих при резекциях почек, селезенки, печени [38]. Они обеспечивают немедленный и продолжительный гемостаз без необходимости лигирования [39], существенно усиливают гемостаз в паренхиме и уменьшают вероятность возникновения послеоперационных геморрагических осложнений.
Они обеспечивают немедленный и продолжительный гемостаз без необходимости лигирования [39], существенно усиливают гемостаз в паренхиме и уменьшают вероятность возникновения послеоперационных геморрагических осложнений.
Коллагеновая губка
В 1970 г. М. Hait [40] впервые применила коллаген в качестве гемостатического агента. Коллаген является структурным белком. При кровотечении он быстро вступает во взаимодействие с тромбоцитами в субэндотелии, что приводит к активации их адгезивно-агрегационных свойств [41]. Данный механизм используется при применении коллагена в качестве местного гемостатика. Кроме того, при использовании коллагеновой губки гемостаз происходит еще и за счет гигроскопического эффекта. Коллагеновые губки применяют с целью достижения гемостаза при кровотечении из паренхиматозных органов (печени, селезенки, поджелудочной и щитовидной желез, почек, легких). Могут рекомендаваться как профилактическая мера в случае образования лимфатических, желчных и жидкостных фистул.
Окисленная целлюлоза
Впервые окисленная целлюлоза в качестве гемостатического агента была использована в 1942 г. V. Frantz [42]. Ее активное применение в клинической практике началось с 60-х гг. прошлого столетия [43]. Материал из окисленной регенерированной целлюлозы при контакте с кровью создает кислую среду (рН=2,5-3,0), усиливающую гемостаз благодаря впитывающей способности оксицеллюлозы. В кислой среде собственные тромбоциты и разрушившиеся эритроциты, выделившие кислый гематин, служат каркасом для образования тромбоцитарного сгустка.
Ингибиторы фибринолиза
Ингибиторы протеиназ плазмы
Апротинин
Апротинин – природный ингибитор протеолитических ферментов, получаемый из легких крупного рогатого скота, тучные клетки которых содержат повышенное его количество. Активность белка измеряется в антитрипсиновых (АтЕ) или калликреиновых ингибирующих единицах (КИЕ, 1 АтЕ соответствует 1,33 КИЕ). Апротинин обратимо взаимодействует с разнообразными протеазами плазмы крови и тканей, формируя стехиометрические комплексы.
Апротинин обратимо взаимодействует с разнообразными протеазами плазмы крови и тканей, формируя стехиометрические комплексы.
Апротинин был открыт в 1930 г. исследовательской группой Мюнхенского университета, выделившей ингибитор калликреина из бычьей ткани и поджелудочной железы коровы. В 1936 г. Куниц и Нортрап выделили ингибитор трипсина из бычьей поджелудочной железы. В 1959 г. ингибитор бычьего трипсина начал применяться в Германии в терапии больных панкреатитом. В конце 1960-х гг. было установлено, что ингибитор калликреина и ингибитор трипсина (апротинин) – идентичны. Учитывая тот факт, что калликреин является воспалительным медиатором, были разработаны протоколы для оценки способности апротинина уменьшать воспаление легких, спровоцированного сердечно-легочным шунтированием.
Результаты исследования, опубликованного в 1987 г., продемонстрировали очевидное снижение риска геморрагий у пациентов, перенесших повторную операцию на открытом сердце, которым был назначен апротинин в высокой дозировке [44].
Дальнейшее изучение показало, что апротинин ингибирует плазмин и поддерживает гомеостаз гликопротеинов тромбоцитов. Апротинин назначался прежде всего пациентам с наиболее высоким риском периоперационного кровотечения вследствие повторного шунта коронарной артерии, больным, по разным причинам не прошедшим процедуру переливания крови, и адептам религиозной организации «Свидетели Иеговы».
Механизм действия. Апротинин – полипептид, состоящий из 58 аминокислот и имеющий молекулярную массу 6512 дальтон.
Апротинин ингибирует сериновые протеиназы человека в широком диапазоне концентраций (рис. 6).
Апротинин связывается с трипсином, плазмином и калликреином легче и в гораздо более низких концентрациях, чем с урокиназой или тромбином. Константа ингибирования (Ki) приблизительно в 500 млн раз выше для тромбина [45]. При этом апротинин снижает фибринолитическую активность крови, тормозит фибринолиз и оказывает гемостатическое действие при коагулопатиях.
Ингибиторы плазмина
ε-Аминокапроновая кислота
Аминокапроновую кислоту применяют для остановки и профилактики кровотечений, обусловленных повышенной фибринолитической активностью крови, гипо- и афибриногенемиями. Ее назначают при оперативных вмешательствах на органах, богатых активаторами фибринолиза (легкие, мозг, матка, предстательная, щитовидная и поджелудочная железы, надпочечники), после операций на сердце и сосудах, при экстракорпоральном кровообращении, ожоговой болезни, преждевременной отслойке плаценты, осложненном аборте, маточных кровотечениях, операциях в области уха, горла, носа, носовых кровотечениях, заболеваниях внутренних органов с геморрагическим синдромом (желудочно-кишечные кровотечения, кровотечения из мочевого пузыря и др.). Аминокапроновую кислоту применяют также для предупреждения вторичной гипофибриногенемии при массивных переливаниях консервированной крови.
Механизм действия. ε-Аминокапроновая кислота – синтетическое производное лизина. С 60-х гг. XX века исследователи сфокусировали свое внимание на ее терапевтических свойствах как кровоостанавливающего средства [46, 47]. ε-Аминокапроновая кислота – один из антифибринолитических агентов, она ингибирует протеолитическую активность плазмина и превращение плазминогена в плазмин [48] (рис. 7).
С 60-х гг. XX века исследователи сфокусировали свое внимание на ее терапевтических свойствах как кровоостанавливающего средства [46, 47]. ε-Аминокапроновая кислота – один из антифибринолитических агентов, она ингибирует протеолитическую активность плазмина и превращение плазминогена в плазмин [48] (рис. 7).
Кроме того, ε-аминокапроновая кислота:
- тормозит активирующее действие стрептокиназы, урокиназы и тканевых киназ на фибринолиз;
- нейтрализует эффекты калликреина, трипсина и гиалуронидазы;
- уменьшает проницаемость капилляров;
- стимулирует образование тромбоцитов;
- сенсибилизирует тромбоцитарные рецепторы к тромбину, тромбоксану А2 и другим эндогенным агрегантам.
Транексамовая кислота
Транексамовая кислота – гемостатический препарат, ингибитор фибринолиза. Специфически подавляет активацию плазминогена и его превращение в плазмин. Обладает местным и системным гемостатическим эффектом при кровотечениях, вызванных повышенной активностью фибринолиза.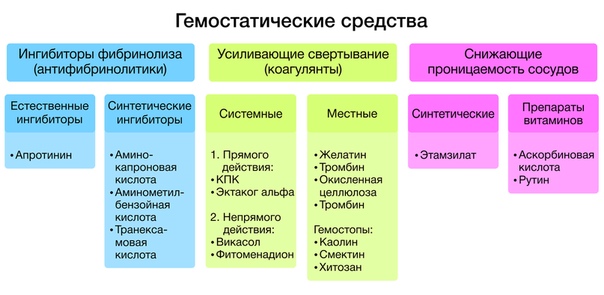
Показания к применению транексамовой кислоты – профилактика и лечение кровотечений вследствие повышения общего (злокачественные новообразования поджелудочной или предстательной железы, операции на органах грудной клетки, послеродовые кровотечения, ручное отделение плаценты, лейкоз, заболевания печени) и местного (маточные, носовые, желудочно-кишечные кровотечения, гематурия, кровотечения после простатэктомии) фибринолиза.
Механизм действия. Транексамовая кислота – синтетическое производное лизина. Ее антифибринолитическое действие заключается в обратимом блокировании участков связывания лизина на молекуле плазминогена, что приводит к предотвращению деградации фибрина. Транексамовая кислота блокирует тканевой активатор плазминогена (t-PA) и его превращение в фибринолизин (плазмин), а также препятствует соединению плазмина и t-PA с фибрином. Вследствие этого происходит подавление деградации фибрина плазмином (рис. 8).
Помимо антифибринолитического действия транексамовая кислота нормализует функцию тромбоцитов и проницаемость капилляров.
В результате кровотечения нарушаются метаболические процессы, работа сердца и функционирование жизненно важных органов (мозг, печень, почки), а состояние пострадавшего стремительно ухудшается. В этой связи использование доступных средств для остановки кровотечения и информация о появлении новых перспективных гемостатиков позволят врачам различных специальностей эффективно бороться с таким жизнеугрожающим состоянием, как кровопотеря.
Список литературы находится в редакции.
Медична газета «Здоров’я України 21 сторіччя» № 21 (418), листопад 2017 р.
СТАТТІ ЗА ТЕМОЮ Ендокринологія
05.02.2021 Ендокринологія Огрядний пацієнт на прийомі сімейного лікаря: що насправді ховається за «косметичною проблемою»Згідно з даними ВООЗ, на ожиріння страждає понад 650 млн мешканців нашої планети, що дозволяє говорити про новітню неінфекційну пандемію. Надмірна кількість жирової тканини асоціюється з багатьма патологічними станами та їхніми ускладненнями, включно з артеріальною гіпертензією, ішемічною хворобою серця, цукровим діабетом тощо. Нормалізація ваги здатна суттєво покращити стан здоров’я пацієнтів і привести до норми основні фізіологічні константи. Так, за даними J. E. Neter і співавт., зниження маси тіла на 1 кг супроводжується зменшенням рівня систолічного й діастолічного артеріального тиску приблизно на 1 мм рт. ст. У дослідженні ADDITION-Cambridge (n=725; на момент включення учасники мали середні масу тіла та індекс маси тіла (ІМТ) 94,6 кг та 33,4 кг/м2 відповідно) було показано, що зниження маси тіла на ≥5% протягом 1 року забезпечувало зниження 10-літнього ризику інфаркту міокарда та інсульту на 48%. Таким чином, ожиріння є надто серйозною проблемою, щоб її ігнорувати….
Надмірна кількість жирової тканини асоціюється з багатьма патологічними станами та їхніми ускладненнями, включно з артеріальною гіпертензією, ішемічною хворобою серця, цукровим діабетом тощо. Нормалізація ваги здатна суттєво покращити стан здоров’я пацієнтів і привести до норми основні фізіологічні константи. Так, за даними J. E. Neter і співавт., зниження маси тіла на 1 кг супроводжується зменшенням рівня систолічного й діастолічного артеріального тиску приблизно на 1 мм рт. ст. У дослідженні ADDITION-Cambridge (n=725; на момент включення учасники мали середні масу тіла та індекс маси тіла (ІМТ) 94,6 кг та 33,4 кг/м2 відповідно) було показано, що зниження маси тіла на ≥5% протягом 1 року забезпечувало зниження 10-літнього ризику інфаркту міокарда та інсульту на 48%. Таким чином, ожиріння є надто серйозною проблемою, щоб її ігнорувати….
 02.2021
Ендокринологія Проблеми та можливості покращення контролю кардіометаболічних ризиків під час пандемії COVID‑19
02.2021
Ендокринологія Проблеми та можливості покращення контролю кардіометаболічних ризиків під час пандемії COVID‑19Пандемія коронавірусної хвороби COVID‑19 кидає виклик системам охорони здоров’я у всьому світі, потребує безпрецедентних зусиль медичної спільноти та мобілізації усіх ресурсів для щоденного порятунку життів. Тим часом тягар хронічних неінфекційних захворювань, зокрема серцево-судинних (ССЗ), стає ще важчим для суспільства через двосторонні зв’язки з коронавірусною інфекцією [1]. Кардіометаболічна хвороба та її клінічні форми, зокрема ішемічна хвороба серця та цукровий діабет (ЦД) 2 типу, і до пандемії були провідними причинами втрати працездатності та передчасної смерті, а під час пандемії вони також сприяють більш тяжкому перебігу захворювання та смерті від COVID‑19. …
…
15 січня в онлайн-режимі відбулася експертна нарада, присвячена питанням оптимізації та безпеки лікування пацієнтів із цукровим діабетом (ЦД) 2 типу. Провідні вітчизняні ендокринологи обговорили стан контролю ЦД 2 типу в Україні та світі, основні причини недосягнення цільових глікемічних показників і можливі варіанти покращення ситуації….
24. 01.2021
Ендокринологія Цукровий діабет і хронічний коронарний синдром
01.2021
Ендокринологія Цукровий діабет і хронічний коронарний синдромДо атеросклеротичних серцево-судинних захворювань (АССЗ) належать ішемічна хвороба серця (ІХС), цереброваскулярні захворювання та патологія периферичних артерій. Висока частота серцево-судинних ускладнень у хворих на цукровий діабет (ЦД) є однією з основних проблем системи охорони здоров’я. Зокрема, ІХС в Україні посідає провідне місце в структурі причин смертності. Результати нещодавніх досліджень свідчать, що частота госпіталізації хворих із хронічною серцевою недостатністю (ХСН) у 2 рази вища в пацієнтів із ЦД порівняно з особами, котрі не мають цього захворювання в анамнезі (American Diabetes Association – ADA, 2019)….
Гемостатический рассасывающийся материал HEMA LIMIT® компании Amed Therapeutics (Ирландия)
HEMA LIMIT® – это стерильный гемостатический материал, состоящий из 100% натуральной окисленной целлюлозы.
Предназначен для остановки капиллярного и незначительного венозного кровотечения, а также кровотечения из паренхиматозных органов при хирургических вмешательствах.
Может быть использован для остановки кровотечения даже в тех случаях, когда другие техники гемостаза неприменимы.
Высоко гигроскопичен, обладает высокими адгезивными свойствами по отношению к форменным элементам крови и белкам-коагулянтам, что ускоряет процесс гемостаза.
Обладает высокой биологической совместимостью, хорошо переносится организмом.
Гипоаллергенный, не вызывает сенсибилизации и негативной иммунной реакции организма. В отличие от гемостатиков коллагенового типа не вызывает раздражения раны и не образует гранулем, рубцов, плотных образований, что делает его практически идеальным в нейрохирургии при работе на головном мозге и эпидуральных структурах. Не увеличивается в объеме и не требует удаления после достижения гемостаза.
Не требует специальных условий хранения. Полностью готов к употреблению, что позволяет использовать его в практике военно-полевой хирургии и бригадами скорой медицинской помощи.
В отличие от гемостатиков на основе регенерированной целлюлозы, получаемой из древесных опилок, имеет значительно более высокую абсорбционную способность.
Выпускается в двух формах: в виде порошка с добавлением гидрофосфата кальция и в виде тканевых пластинок.
Характеристики
HEMA LIMIT®, благодаря содержанию карбоксильных групп в своей молекулярной структуре (16-24%).
- Обладает гемостатическим и адсорбирующим действием
- Обеспечивает гемостатический эффект немедленно, полный гемостаз достигается в течение 2-3х минут
- Полностью абсорбируется из места апликации через 12 — 72 часов в зависимости от используемой формы материала и состояния раны
- Полностью выводится из организма в течение 7 — 21 дней, не накапливается в тканях и клетках
- Оказывает доказанный бактерицидный и бактериостатический эффект
- Предупреждает возможное развитие гнойно-септических осложнений, связанных с интра-операционной контаминацией
- Ускоряет процесс эпителизации, стимулирует регенерацию тканей.

Особенности порошковой формы
Ионы кальция, используемые в порошковой форме HEMA LIMIT®, благодаря создаваемой ионной блокаде автономных нервных окончаний, оказывают умеренный обезболивающий эффект. Не вызывает закисления среды и не оказывает отрицательного влияния на естественный гемостаз.
Большим преимуществом порошковой формы HEMA LIMIT® является возможность применения материала для обработки очага кровотечения в труднодоступных для хирурга местах, а также ранах неправильной формы и различной глубины. Это свойство особенно важно при применении малоинвазивных методик хирургии позвоночника, а также в техниках микрохирургии, в том числе головного мозга.
Особенности формы в виде тканевых пластинок
Благодаря активации фибробластов действующим веществом, тканевые пластинки HEMA LIMIT® могут быть использованы в лечении трудно заживляемых скальпированных ран. Неоспоримым преимуществом является возможность фиксации тканевой формы материала хирургическим швом в местах целевого применения.
Неоспоримым преимуществом является возможность фиксации тканевой формы материала хирургическим швом в местах целевого применения.
Области применения
HEMA LIMIT® в форме тканевых пластинок подходит для использования в нейрохирургии головного и спинного мозга, в общей, абдоминальной, пластической, ортопедической хирургии, гинекологии, урологии, и других направлениях хирургии и травматологии, в том числе в педиатрической практике. Может быть использован для остановки кровотечения с поверхности ожоговых ран после фасциальной некрэктомии, проведенной в ранние сроки с момента травмы. Может быть также применен для заполнения полостей после удаления опухолей, а также при эндоскопических вмешательствах.
Форма выпуска, типоразмеры
Порошковая форма:
- Пластиковая емкость (флакон) с 3 или 5 граммами активного вещества. Для удобства распыления прилагается навинчиваемая на емкость канюля
Тканевые пластинки:
- Пластинки шириной 50 мм: 50 x 50 мм, 50 x 70 мм, 50 x 100 мм, 50 x 350 мм
- Пластинки шириной 100 мм: 100 x 100 мм, 100 x 200 мм
Гемостатик | гемостатики | местный гемостатик | гемостатический порошок | BioCer
ОПИСАНИЕ. HaemoCer™ PLUS является медицинским продуктом растительного происхождения, полученным из очищенного растительного крахмала. Предназначен для использования в качестве абсорбирующего гемостатического агента в целях контроля кровотечений при хирургическом вмешательстве. HaemoCer™ PLUS не содержит компонентов животного или человеческого происхождения. Это биологически совместимая стерильная белая пудра, не обладающая пирогенным эффектом. Как правило, HaemoCer™ PLUS полностью абсорбируется в течение нескольких дней.
HaemoCer™ PLUS является медицинским продуктом растительного происхождения, полученным из очищенного растительного крахмала. Предназначен для использования в качестве абсорбирующего гемостатического агента в целях контроля кровотечений при хирургическом вмешательстве. HaemoCer™ PLUS не содержит компонентов животного или человеческого происхождения. Это биологически совместимая стерильная белая пудра, не обладающая пирогенным эффектом. Как правило, HaemoCer™ PLUS полностью абсорбируется в течение нескольких дней.
ДЕЙСТВИЕ. В результате контакта HaemoCer™ PLUS с кровью запускается механизм двойного действия. Во-первых, происходит ускорение естественного процесса свертывания крови посредством быстрой дегидратации крови и ускорения концентрации тромбоцитов, эритроцитов и белков крови в месте кровотечения. Во-вторых, образуется прочная гелеобразная матрица, которая выступает в качестве механического барьера и предупреждает повторное кровотечение. HeamoCerTM PLUS выводится из организма амилазой в течение 48 часов.
HeamoCerTM PLUS выводится из организма амилазой в течение 48 часов.
ПОКАЗАНИЯ. HaemoCer™ PLUS является вспомогательным гемостатическим агентом, предназначенным для использования при хирургическом вмешательстве с целью контроля кровотечений из капиллярных, венозных и артериальных сосудов в случаях неэффективности или неосуществимости применения зажимов, лигирования сосудов или иных общепринятых методов.
ПРОТИВОПОКАЗАНИЯ.
- Не допускается применение HaemoCer™ PLUS для инъекций в кровеносные сосуды. Это может вызвать рассеянную внутрисосудистую коагуляцию.
- Не допускается применение HaemoCer™ PLUS в целях контроля послеродовых кровотечений или меноррагии.
- Не допускается применение HaemoCer™ PLUS для инъекций в мочевой пузырь или мочеиспускательный канал.
- Не допускается применение HaemoCer™ PLUS для инъекций в глаза.

- HaemoCer™ PLUS противопоказан пациентам с непереносимостью крахмала или крахмалосодержащих веществ.
ПРЕДОСТЕРЕЖЕНИЯ. HaemoCer™ PLUS не является альтернативой тщательному проведению хирургического вмешательства и, в частности, надлежащему применению общепринятых методов гемостаза (например, наложению лигатуры). HaemoCer™ PLUS поставляется как стерильный продукт. Его нельзя рестерилизовать. Неиспользованные открытые системы необходимо выбрасывать. Повторное применение предназначенных для разового использования приборов может повлечь за собой серьезные проблемы со здоровьем пациента и нарушение функций продукта. При подозрении на инфекцию применение HaemoCer™ PLUS не рекомендуется; при использовании продукта в инфицированных областях следует действовать с особой осторожностью. Совместное применение HaemoCer™ PLUS с другими гемостатическими агентами локального применения не было исследовано в рамках клинических испытаний и, следовательно, не рекомендуется. При достижении гемостаза следует удалить излишние частицы HaemoCer™ PLUS с обработанного участка посредством промывания и отсасывания. Это особенно важно в случае применения в области спинного мозга, костных отверстий и/или зрительного нерва и хиазмы. При контакте с кровью или жидкостью HaemoCer™ PLUS незамедлительно набухает до своего максимального объема. Удаление излишнего гемостатического вещества позволяет избежать некроза окружающих тканей, возможного вследствие вызванного набуханием сдавливания.
При достижении гемостаза следует удалить излишние частицы HaemoCer™ PLUS с обработанного участка посредством промывания и отсасывания. Это особенно важно в случае применения в области спинного мозга, костных отверстий и/или зрительного нерва и хиазмы. При контакте с кровью или жидкостью HaemoCer™ PLUS незамедлительно набухает до своего максимального объема. Удаление излишнего гемостатического вещества позволяет избежать некроза окружающих тканей, возможного вследствие вызванного набуханием сдавливания.
ОБЛАСТИ ПРИМЕНЕНИЯ.
- Кардиохирургия, сосудистая и торакальная хирургия
- Общая хирургия
- Трансплантация
- Травматология
- Удаление опухоли
- ЧЛХ
- ЛОР-хирургия
- Урология/гинекология
- Ортопедия
- Пластическая хирургия
- Ожоговая хирургия
- Нейрохирургия
- Педиатрия

Запросить цену
НОВОСЕВЕН® компании «Ново Нордиск» — универсальное гемостатическое средство
|
ПРОКОНВЕРТИН В ЛОКАЛЬНОМ ЭПИЦЕНТРЕ ГЕМОСТАЗА
Процесс тромбообразования представляет собой ряд сложных взаимодействий различных факторов свертывания крови (ФСК) и подразделяется на несколько этапов. На первом этапе при участии ряда плазменных и тромбоцитарных ФСК образуется тромбопластин. На втором — тромбопластин в комплексе с VII (проконвертином) и X ФСК (фактор VII и фактор Х) и в присутствии ионов кальция превращает неактивный белок протромбин в активный фермент тромбин. На третьем этапе растворимый белок фибриноген под действием тромбина превращается в нерастворимый фибрин, составляющий «строму» тромба.
В процессе гемостаза основную роль играет комплекс, который образуется при избирательном взаимодействии тканевого фактора (ТФ; фиксирован на мембранах субэндотелиальных клеток и не контактирует непосредственно с кровью) и активированного фактора VII (фактор VIIа). В норме уровень фактора VIIа составляет приблизительно 1% (около 4 нг/мл) от общего уровня протеина фактора VII. Сам по себе фактор VIIа не проявляет ферментативной активности, но образующийся в месте повреждения сосуда комплекс фактора VIIа–ТФ активирует фактор IХ и фактор Х и запускает многоступенчатый коагуляционный каскад с участием как плазменных, так и клеточных (тромбоцитарных) ФСК, в результате чего значительно повышается локальный синтез тромбина, активирующего превращение фибриногена в фибрин и формирование стабильного и надежного гемостатического сгустка.
В норме уровень фактора VIIа составляет приблизительно 1% (около 4 нг/мл) от общего уровня протеина фактора VII. Сам по себе фактор VIIа не проявляет ферментативной активности, но образующийся в месте повреждения сосуда комплекс фактора VIIа–ТФ активирует фактор IХ и фактор Х и запускает многоступенчатый коагуляционный каскад с участием как плазменных, так и клеточных (тромбоцитарных) ФСК, в результате чего значительно повышается локальный синтез тромбина, активирующего превращение фибриногена в фибрин и формирование стабильного и надежного гемостатического сгустка.
НОВОСЕВЕН В ГЕМАТОЛОГИИ
Рекомбинантный активированный человеческий ФСК VIIа — препарат НовоСевен (эптаког альфа (активированный)), разработанный и выпускаемый компанией «Ново Нордиск», в течение более чем 15 лет клинического применения зарекомендовал себя как эффективное средство для заместительной патогенетической гемостатической терапии при различных типах кровотечений. Болюсное введение НовоСевена в дозе 90–120 мкг/кг обеспечивает эффективный гемостаз у пациентов с ингибиторной гемофилией, компенсируя недостаток ФСК VIII или IХ, максимально активируя тромбоциты в месте повреждения и способствуя полноценному синтезу тромбина. Приведенные данные применимы и по отношению к пациентам с приобретенной гемофилией (Hedner U. Recombinant activated factor VII as universal hemostatic agent. Blood Coagulation and Fibrinolisis, 1998,9; suppl.).
Болюсное введение НовоСевена в дозе 90–120 мкг/кг обеспечивает эффективный гемостаз у пациентов с ингибиторной гемофилией, компенсируя недостаток ФСК VIII или IХ, максимально активируя тромбоциты в месте повреждения и способствуя полноценному синтезу тромбина. Приведенные данные применимы и по отношению к пациентам с приобретенной гемофилией (Hedner U. Recombinant activated factor VII as universal hemostatic agent. Blood Coagulation and Fibrinolisis, 1998,9; suppl.).
От прочих препаратов ФСК НовоСевен отличается локальным механизмом гемостатического действия: проявляет ферментативную активность только в комплексном соединении с ТФ, что обусловливает минимальную вероятность системной активации коагуляционного процесса. Кроме того, благодаря рекомбинантной (генно-инженерной) технологии производства препарат не оказывает иммуногенного действия — не провоцирует антителообразование, приводящее к ингибированию гемостатического эффекта.
НОВОСЕВЕН: НОВЫЕ КЛИНИЧЕСКИЕ ГОРИЗОНТЫ
В середине 80-х годов прошлого столетия, когда по окончании клинических испытаний НовоСевен был зарегистрирован сначала в Дании, а затем в других странах Европы и в США (Roberts H. R. Brief history of Novo-Seven. Blood Coagulation and Fibrinolisis, 1998, 9; suppl. 1), в качестве показаний к его применению были установлены ингибиторные формы гемофилии, приобретенная форма гемофилии (аутоиммунное разрушение ФСК при системных коллагенозах, злокачественных опухолях, токсических поражениях печени, после антикоагулянтной терапии антагонистами витамина К, в результате массивных кровотечений в ранний послеродовой период и др.), гипопроконвертинемия (наследственная форма геморрагического диатеза, обусловленная врожденным дефицитом фактора VII) и др.
R. Brief history of Novo-Seven. Blood Coagulation and Fibrinolisis, 1998, 9; suppl. 1), в качестве показаний к его применению были установлены ингибиторные формы гемофилии, приобретенная форма гемофилии (аутоиммунное разрушение ФСК при системных коллагенозах, злокачественных опухолях, токсических поражениях печени, после антикоагулянтной терапии антагонистами витамина К, в результате массивных кровотечений в ранний послеродовой период и др.), гипопроконвертинемия (наследственная форма геморрагического диатеза, обусловленная врожденным дефицитом фактора VII) и др.
К концу 90-х годов, когда НовоСевен получил широкое признание у гематологов Европы и Северной Америки, были получены данные, свидетельствующие об эффективности препарата при купировании профузных посттравматических кровотечений. Так, в 1998 г. в одну из клиник Израиля в крайне тяжелом состоянии был доставлен 19-летний военнослужащий с пулевым ранением в живот, вызвавшим разрыв нижней полой вены, массивное внутреннее кровотечение, гиповолемический шок III–IV степени, кетоацидоз, гипотермию с признаками ДВС-синдрома. Перевязка v. cava inferior и трансфузия 5 л эритроцитарной массы, 3 л свежезамороженной плазмы, 20 доз тромбоцитарной массы и 10 доз криопреципитата не привели к остановке кровотечения, которое продолжалось со скоростью 300 мл/мин. В качестве терапии спасения больному болюсно ввели НовоСевен в дозе 60 мкг/кг. Через 10 мин после инъекции скорость кровотечения уменьшилась до 10–15 мл/мин, хотя сохранялось медленное просачивание по всей раневой поверхности. Через 1 ч после повторного введения препарата в той же дозе основные показатели свертывания крови приблизились к норме, просачивание прекратилось, что позволило хирургам найти и перевязать несколько мелких поврежденных сосудов. Пострадавший выжил, состояние в послеоперационный период было стабильным, геморрагических рецидивов не наблюдалось (Kenet G. et al. The treatment of traumatic bleeding by means of recombinant factor VII. Lancet Research Letters, 1999, vol. 354: 9193).
Перевязка v. cava inferior и трансфузия 5 л эритроцитарной массы, 3 л свежезамороженной плазмы, 20 доз тромбоцитарной массы и 10 доз криопреципитата не привели к остановке кровотечения, которое продолжалось со скоростью 300 мл/мин. В качестве терапии спасения больному болюсно ввели НовоСевен в дозе 60 мкг/кг. Через 10 мин после инъекции скорость кровотечения уменьшилась до 10–15 мл/мин, хотя сохранялось медленное просачивание по всей раневой поверхности. Через 1 ч после повторного введения препарата в той же дозе основные показатели свертывания крови приблизились к норме, просачивание прекратилось, что позволило хирургам найти и перевязать несколько мелких поврежденных сосудов. Пострадавший выжил, состояние в послеоперационный период было стабильным, геморрагических рецидивов не наблюдалось (Kenet G. et al. The treatment of traumatic bleeding by means of recombinant factor VII. Lancet Research Letters, 1999, vol. 354: 9193).
После опубликования в приложении к журналу «Lancet» описанного случая рекомбинантный фактор VIIа (препарат НовоСевен) стали применять для купирования кровотечений различного генеза, в частности, в хирургической и акушерской практике. В научной литературе последних лет появляется все больше сообщений об успешном использовании препарата как эффективного и безопасного универсального гемостатического средства в клинических ситуациях, когда применение традиционных гемостатиков не дает желаемого результата. Так, описаны случаи успешного использования НовоСевена для остановки профузных внутренних кровотечений после хирургических вмешательств — резекции кишечника при болезни Крона и лимфоме кишечника — у пациентов, у которых ранее не отмечалось нарушений системы свертывания крови (White B. et al. British Journal of Haematology 1999; 107: 677–678).
В научной литературе последних лет появляется все больше сообщений об успешном использовании препарата как эффективного и безопасного универсального гемостатического средства в клинических ситуациях, когда применение традиционных гемостатиков не дает желаемого результата. Так, описаны случаи успешного использования НовоСевена для остановки профузных внутренних кровотечений после хирургических вмешательств — резекции кишечника при болезни Крона и лимфоме кишечника — у пациентов, у которых ранее не отмечалось нарушений системы свертывания крови (White B. et al. British Journal of Haematology 1999; 107: 677–678).
Василий Леонидович Новак, доктор медицинских наук, профессор, директор Института патологии крови и трансфузионной медицины АМН Украины (г. Львов), главный специалист Министерства здравоохранения Украины по гематологии:
— К сожалению, на сегодняшний день в нашей стране обеспечение высокоочищенными вирусинактивированными и человеческими рекомбинантными ФСК составляет менее 1% от необходимого объема закупок. Что касается криопреципитата (гемостатического средства эпохи 50-х годов прошлого века, которое сегодня и в развивающихся-то странах редко используется!), то им мы обеспечены на 4,1%. Каким бы ограниченным не был бюджет здравоохранения и какими бы дорогостоящими не были эти препараты, такое положение недопустимо.
Что касается криопреципитата (гемостатического средства эпохи 50-х годов прошлого века, которое сегодня и в развивающихся-то странах редко используется!), то им мы обеспечены на 4,1%. Каким бы ограниченным не был бюджет здравоохранения и какими бы дорогостоящими не были эти препараты, такое положение недопустимо.
В последнее время на государственном уровне, в частности Министерством здравоохранения, принимаются меры, направленные на преодоление кризиса в этой области. Недавно состоялось первое аппаратное совещание МЗ, посвященное проблеме гемофилии и вопросам обеспечения пациентов гемостатиками, на котором подробно рассматривалась ситуация с обеспечением населения кровеостанавливающими средствами. Нам наконец удалось создать единый Всеукраинский реестр больных гемофилией (впервые не только в нашей стране, но и в пределах ближнего зарубежья). Согласно этому реестру в нашей стране зарегистрирован 2601 больной гемофилией. Теперь мы знаем, сколько среди них больных гемофилией A, гемофилией B, пациентов с болезнью Виллебранда. Препараты ФСК являются для них жизнеспасающими, улучшить обеспечение ими крайне необходимо. В этом направлении сегодня сделан еще один важный шаг: разработана (и одобрена МЗ) Монопрограмма по гемофилии, которая предусматривает оказание неотложной помощи при тех или иных кровотечениях с использованием «препарата спасения» НовоСевена — оригинального препарата компании «Ново Нордиск», созданного на основе моноклональных антител. Во-первых, он является рекомбинантным, во-вторых — активированным ФСК. В этом заключается одно из основных клинических преимуществ: гемостатическое действие препарата проявляется не при введении в сосудистое русло, а непосредственно в месте кровотечения, вызванного повреждением сосуда, то есть там, где необходимо. Вторая особенность препарата: его используют в тех случаях, когда «традиционные» гемостатики требуют введения в значительно более высоких дозах (я имею в виду ингибиторную форму гемофилии). Кроме того, как свидетельствует опыт зарубежных ученых, НовоСевен можно использовать не только при гемофилии, но и при других видах кровотечений независимо от их этиологии и локализации.
Препараты ФСК являются для них жизнеспасающими, улучшить обеспечение ими крайне необходимо. В этом направлении сегодня сделан еще один важный шаг: разработана (и одобрена МЗ) Монопрограмма по гемофилии, которая предусматривает оказание неотложной помощи при тех или иных кровотечениях с использованием «препарата спасения» НовоСевена — оригинального препарата компании «Ново Нордиск», созданного на основе моноклональных антител. Во-первых, он является рекомбинантным, во-вторых — активированным ФСК. В этом заключается одно из основных клинических преимуществ: гемостатическое действие препарата проявляется не при введении в сосудистое русло, а непосредственно в месте кровотечения, вызванного повреждением сосуда, то есть там, где необходимо. Вторая особенность препарата: его используют в тех случаях, когда «традиционные» гемостатики требуют введения в значительно более высоких дозах (я имею в виду ингибиторную форму гемофилии). Кроме того, как свидетельствует опыт зарубежных ученых, НовоСевен можно использовать не только при гемофилии, но и при других видах кровотечений независимо от их этиологии и локализации. Как я уже отмечал, препарат сам «находит» нужное место действия.
Как я уже отмечал, препарат сам «находит» нужное место действия.
Вера Дмитриевна Дроздова, кандидат медицинских наук, руководитель отдела проблем гематологии детского возраста Института гематологии и трансфузиологии АМН Украины, главный специалист Министерства здравоохранения Украины по детской гематологии:
— Для того чтобы по жизненным показаниям остановить массивное кровотечение у ребенка, больного гемофилией, в крови которого уже циркулируют антитела, ингибирующие вводимый фактор VIII или IХ, использование обычной «рабочей» дозы ФСК (как правило, 20–60 Ед/кг) однократно является малоэффективным. Для достижения гемостаза необходимо повысить ее в 10 раз! Но и это не предел, поскольку титр антител каскадно повышается с каждым последующим введением. Значит, эффективность вновь снижается, значит, вновь нужно повышать дозу, что приводит к увеличению лекарственной нагрузки на организм, возрастанию стоимости лечения, — это замкнутый круг.
Уникальность свойств НовоСевена обусловлена универсальностью его гемостатического действия. Это «готовый» активированный фактор VII, для «включения» которого в гемостатический каскад не требуется промежуточных стадий, он позволяет, минуя целый ряд физиологических этапов, практически сразу получить главный субстрат первичного тромба (тромбина) «по месту требования» — в зоне кровотечения. С этим связана способность НовоСевена останавливать кровотечения не только при гемофилии, но и при многих других видах нарушения свертывания — при дефиците протромбина (особенно в акушерской практике), при афибриногенемии, болезни Виллебранда, дефиците факторов VII, V, X (как врожденных, так и приобретенных формах), при различных видах тромбоцитопений и тромбоцитопатий, когда остановить почечное или желудочно-кишечное кровотечение представляется крайне сложной задачей.
Лечение детей с нарушенной системой свертывания крови — это особая проблема, ведь они так же подвижны, как их здоровые сверстники, соответственно высок риск травматизма, но они не отдают себе отчета в его последствиях, не умеют беречься… К сожалению, в нашей клинике НовоСевен не применялся, но, если станет возможной его государственная закупка, этот препарат обязательно должен быть в арсенале детской гематологической клиники. Пусть немного, пусть один флакон в качестве «неприкосновенного запаса» — для спасения жизни ребенка в случае тяжелого кровотечения, не поддающегося остановке с помощью рутинных гемостатических средств.
Пусть немного, пусть один флакон в качестве «неприкосновенного запаса» — для спасения жизни ребенка в случае тяжелого кровотечения, не поддающегося остановке с помощью рутинных гемостатических средств.
Виктор Журавель
Гемоблок, [email protected] 8(925)7712709
Регистрационный номер:ФСР 2012/13587 по ТУ 9391-002-68087337-2012
Описание:
Хирургическое инвазивное медицинское изделие кратковременного применения. Гемоблок® — жидкое гемостатическое средство в виде полимерного раствора по вязкости близкое к воде. Цвет раствора от бесцветного до желто-коричневого, возможно наличие взвеси, pH нейтральный. Стерильно.
Состав:
Гемоблок® — 1% водный раствор неполной серебряной соли полиакриловой кислоты, с интегрированными наночастицами серебра.
Назначение.
Гемостатическое средство с антисептическими свойствами для местного применения.
Применяется для остановки всех типов капиллярных и паренхиматозных кровотечений, возникающих при хирургических операциях и травмах (в том числе полостных операциях на паренхиматозных органах, кровотечениях из губчатого вещества кости), для обработки ран, ожогов, трофических язв, а так же для гемостаза и визуализации при эндоскопических манипуляциях, челюстно-лицевой и офтальмохирургии.
Используется в различных отраслях хирургии: ангиологии и кардиохирургии, абдоминальной хирургии, проктологии, гнойной хирургии, ортопедии и травматологии, урологии, гинекологии, пластической, эндокринной хирургии, онкологии, офтальмохирургии, нейрохирургии, челюстно-лицевой хирургии и стоматологии, детской хирургии и т.д.:
1. Кровотечения из мышечной, жировой, губчатой костной, соединительной ткани, возникающие в ходе выполнения хирургических операций.
2. Кровотечения из паренхиматозных органов при хирургических операциях (капиллярные кровотечения из паренхимы печени, селезенки, почек, надпочечников, головного мозга, лёгких, щитовидной железы и др.).
3. Кровотечения из эрозивных и язвенных дефектов и злокачественных неоплазий полых органов желудочно-кишечного тракта.
4. Кровотечения из эрозивных и язвенных дефектов и злокачественных неоплазий трахеи и бронхов.
5. Кровотечения после эндоскопических операций (полипэктомии, подслизистой диссекции, мукозэктомии, радиочастотной абляции, папиллосфинктеротомии и литоэкстракции, миотомии и др. )
)
6. Капиллярные кровотечения из распадающихся опухолей любой локализации.
7. Капиллярные кровотечения любой локализации и этиологии при врожденном или приобретенном дефиците факторов свертывания, в том числе при синдроме диссеминированного внутрисосудистого свертывания.
8. Остановка носовых кровотечений, а также интраоперационных кровотечений в оториноларингологии (после аденотомии, тонзиллотомии и тонзилэктомии).
9. В комбустиологии- обработка ран при термических, химических и лучевых ожогах кожных покровов и слизистых оболочек.
10. В офтальмологии: при операциях на веках, конъюктивальных сводах, склере, роговице.
11. В нейрохирургии для остановки паренхиматозных кровотечений любой этиологии, при гемостазе ложа, удаляемых новообразований головного и спинного мозга, операциях на позвоночнике.
12. Акушерство и гинекология как полостные, так и лапароскопические операции, Кесарево сечение, эпизиотомия, разрывы маточные, влагалища и промежности; внутриматочные кровотечения, послеродовые кровотечения.
В гинекологии: кровотечения из шейки матки, эндометриозе и прочие кровотечения паренхимы малого женского таза.
13. Оказание первой помощи при кровотечениях обусловленных травмами, сопровождающимися нарушением целостности кожных покровов и слизистых оболочек, и ожогами.
14. Для профилактики постоперационных осложнений (для снижения риска развития раневой инфекции и спаечного процесса), для ускорения (до полутора раз) заживления ран и ожогов кожных покровов и слизистых, послеоперационных швов, трофических язв.
Действие.
Действует местно, не проникает в системный кровоток. При взаимодействии с белками плазмы крови (главным образом с альбумином) Гемоблок® формирует полимерный комплекс (полиакриловая матричная структура, связанная с молекулами альбумина). Такая структура упаковывается в несколько микрослоев, создавая прочную полиметакрилатную пленку на поверхности раны. В дальнейшем поверхностная структура Гемоблок®- белок замещается фибрином. При образовании полимерного комплекса наступает гемостаз. Полиметакрилатная пленка не видима невооруженным глазом, биодеградирует естественным путем в течение суток.
Полиметакрилатная пленка не видима невооруженным глазом, биодеградирует естественным путем в течение суток.
Гемоблок® за счет наличия в составе наночастиц серебра, обладает бактерицидным, противовирусным и противогрибковым действием. Бактерицидный эффект проявляется в отношении большинства известных грамположительных и грамотрицательных бактерий, таких как Streptococcus spp., Staphylococcus spp., Moraxella spp., и других, а также грибковой флоры (Candida spp., и др.) и к устойчивым внутрибольничным штаммам бактерий. Препятствует развитию раневой инфекции. Раны заживают первичным натяжением шва без нагноений.
Гемоблок не содержит компонентов животного происхождения, не проявляет раздражающего, прижигающего, вяжущего, токсического, резорбтивного или аллергенного действия, не оказывает побочного действия на ткани. Средство не требует дополнительного оборудования при использовании. Не ухудшает визуализацию в области нанесения. Не всасывается. Не проникает в системный кровоток. Не влияет на функцию гемостаза в общем кровотоке, не приводит к тромбообразованию, повышению СОЭ.
Применение.
Гемоблок® применяют наружно, внутрисосудистое введение средства Гемоблок® запрещено. Препарат стерилен и его используют с соблюдением правил антисептики.
Средство готово к применению. Для однократного применения в зависимости от интенсивности кровотечения и площади кровоточащей поверхности может быть использовано от 5 до 100 и более миллилитров гемоблока. Гемостатический эффект является дозозависимым. Доза гемостатического средства не ограничена и определяется индивидуально в зависимости от площади кровоточащей поверхности и интенсивности кровотечения. Гемостатический эффект достигается в течение 1-2 минут. Визуально оценивать действие Гемоблока следует по уменьшению интенсивности кровотечения вплоть до его остановки.
С увеличением количества препарата эффект нарастает.
При обработке раны происходит остановка кровотечения с формированием гладкой эластичной поверхности – удобного поля для проведения дальнейших манипуляций.
При наружных кровотечениях, ранениях, ожогах, а также в качестве средства для оказания первой медицинской помощи: возможно прямое нанесение на пораженный участок кожи или слизистой, либо смачивание тампонов (марлевых носителей) с последующим наложением на кровоточащую поверхность. Поверхность рекомендуется предварительно осушить. При необходимости дополнительно орошают наложенные на кровоточащую поверхность марлевые салфетки раствором Гемоблока непосредственно из флакона, либо из одноразового медицинского шприца. После экспозиции (через 1-2 минуты) салфетки и тампоны осторожно удаляют с раневой поверхности. Оптимальное количество 1% раствора средства Гемоблок® — 30-50 мл для достижения надежного гемостаза, бактерицидного и бактериостатического эффекта. При обширных кровоточащих раневых поверхностях рекомендуется использовать 1% раствора средства Гемоблок® — 100 мл.
Поверхность рекомендуется предварительно осушить. При необходимости дополнительно орошают наложенные на кровоточащую поверхность марлевые салфетки раствором Гемоблока непосредственно из флакона, либо из одноразового медицинского шприца. После экспозиции (через 1-2 минуты) салфетки и тампоны осторожно удаляют с раневой поверхности. Оптимальное количество 1% раствора средства Гемоблок® — 30-50 мл для достижения надежного гемостаза, бактерицидного и бактериостатического эффекта. При обширных кровоточащих раневых поверхностях рекомендуется использовать 1% раствора средства Гемоблок® — 100 мл.
В полостной хирургии: после выполнения основного этапа оперативного вмешательства проводится осушение зоны оперативного вмешательства тампонами, перед ушиванием лапаро-, торакотомных ран тампоны удаляют, обильно орошают раневую поверхность раствором Гемоблок®. Обильно смоченные стерильные марлевые салфетки для получения гемостатического эффекта салфетку не отжимают и прикладывают к кровоточащей предварительно осушенной поверхности. Оптимальное количество 1% раствора средства Гемоблок® — 50 мл для достижения надежного гемостаза, бактерицидного и бактериостатического эффекта. С увеличением количества препарата эффект нарастает.
Оптимальное количество 1% раствора средства Гемоблок® — 50 мл для достижения надежного гемостаза, бактерицидного и бактериостатического эффекта. С увеличением количества препарата эффект нарастает.
В травматологии и нейрохирургии:
-после выполнения основного этапа оперативного вмешательства проводится осушение зоны оперативного вмешательства тампонами, перед ушиванием ран тампоны удаляют, обильно орошают раневую поверхность раствором Гемоблок® и затем проводят послойное ушивание операционных ран без удаления избытков препарата Гемоблок®. Также возможно введение препарата Гемоблок® непосредственно в установленные дренажи после ушивания операционных ран.
— обильно смоченные стерильные марлевые салфетки для получения гемостатического эффекта салфетку не отжимают и прикладывают к кровоточащей предварительно осушенной поверхности. Оптимальное количество 1% раствора средства Гемоблок® — 50-100 мл для достижения надежного гемостаза, бактерицидного и бактериостатического эффекта. С увеличением количества препарата эффект нарастает. Гемоблок не является нейротоксичным, не требует смывания.
Гемоблок не является нейротоксичным, не требует смывания.
При лапаро- и торакоскопических операциях, а также для остановки кровотечений из верхних и нижних отделов желудочно-кишечного тракта и бронхиального дерева проводят орошение средством Гемоблок® кровоточащей поверхности через ирригационный канал эндоскопа, до достижения необходимого эффекта. При необходимости возможно заведение обильно смоченной салфетки через порт. Для этого стерильную марлевую салфетку или тампон, обильно смоченные Гемоблоком, вводят через порт с помощью эндоскопических щипцов, накладывают на кровоточащую поверхность. После экспозиции через 1-2 минуты салфетки и тампоны осторожно удаляют. Так же при лапароскопических операциях препарат можно вводить путём прицельной ирригации через катетер.
При эндоскопических манипуляциях возможно использование Гемоблока при кровотечениях из верхнего отдела пищеварительного тракта, язвы двенадцатиперстной кишки, диффузных кровотечений, а также кровотечениях толстой и тонкой кишки. В этом случае возможно орошение препаратом Гемоблок раневой кровоточащей поверхности (в случае желудочных кровотечений до 200 мл) через катетер или спрей-катетер, введенный в инструментальный канал эндоскопа. При необходимости можно наносить препарат непосредственно через инструментальный канал эндоскопа. Для инфильтрационного гемостаза (полипоэктомия, язвы ДПК и пр.) применяется подслизистое введение эндоскопической инъекционной иглой в подслизистый слой вокруг кровоточащего дефекта 1-5 мл Гемоблока.
В этом случае возможно орошение препаратом Гемоблок раневой кровоточащей поверхности (в случае желудочных кровотечений до 200 мл) через катетер или спрей-катетер, введенный в инструментальный канал эндоскопа. При необходимости можно наносить препарат непосредственно через инструментальный канал эндоскопа. Для инфильтрационного гемостаза (полипоэктомия, язвы ДПК и пр.) применяется подслизистое введение эндоскопической инъекционной иглой в подслизистый слой вокруг кровоточащего дефекта 1-5 мл Гемоблока.
В акушерской практике и гинекологии возможна обработка раневых поверхностей, как на поверхности матки, так и внутриматочно. Используется как орошение, так и тампонирование источника кровотечения.
В оториноларингологии:
При носовых кровотечениях — передняя тампонада полости носа марлевыми тампонами пропитанными 1% раствором средства Гемоблок®.
При интраоперацинных кровотечениях — прижатие марлевыми тампонами, пропитанными 1% раствором средства Гемоблок®, раневых поверхностей, при необходимости дополнительно однократное закапывание 1% раствора средства Гемоблок® в носовые ходы по 5 капель.
Гемоблок® обеспечивает устойчивый местный гемостаз за 1-2 минуты, повторные кровотечения отсутствуют. Эффективен при нарушении свёртывающей системы крови (гемофилия, коагулопатия).
Гемоблок® может применяться без ограничений у пациентов с нарушениями функции почек и/или печени.
Гемоблок не инфицируется, не является нейротоксичным, не требует смывания.
Ограничения к применению:
Артериальные кровотечения, кровотечения из магистральных венозных сосудов.
Индивидуальная непереносимость.
Внутрисосудистое введение Гемоблок® запрещено.
Применение при беременности и в период грудного вскармливания
Клинические данные о применении средства Гемоблок® во время беременности и в период грудного вскармливания ограничены. Учитывая, что средство Гемоблок® не проникает в системный кровоток, не оказывает негативного влияния плод, его можно применять в период беременности и период грудного вскармливания.
Применение в педиатрии
Гемоблок® не имеет возрастных ограничений при применении у детей.
Передозировка
Случаев передозировки при применении средства Гемоблок® не установлено.
Форма выпуска
Средство гемостатическое «Гемоблок» в отдельных упаковках:
— раствор во флаконе 100 мл 1% раствора. Стерильно.
Средство гемостатическое «Гемоблок» в отдельных упаковках:
— раствор во флаконе 50 мл 1% раствора. Стерильно.
Средство гемостатическое «Гемоблок» в отдельных упаковках:
— раствор во флаконе 30 мл 1% раствора. Стерильно.
Средство гемостатическое «Гемоблок» в отдельных упаковках:
— раствор во флаконе 20 мл 1% раствора. Стерильно.
Средство гемостатическое «Гемоблок» в отдельных упаковках:
— раствор во флаконе 15 мл 1% раствора. Стерильно.
Срок годности
3 года от даты выпуска.
Не использовать по истечении срока годности, указанного на упаковке.
Условия хранения
Хранить в сухом прохладном месте при температуре от +5°С до +25°С, беречь от света.
Не подвергать заморозке.
Хранить в недоступном для детей месте.
Вскрытый флакон использовать сразу, не хранить.
Профи — Как сохранить зуб в Пскове
КАЛЬЦИЙ ПРИ ДЛИТЕЛЬНОМ ЛЕЧЕНИИ ТВОРИТ ЧУДЕСА!
Наряду с остальными науками стоматология не стоит на месте. За последние 20 лет методика по лечению зубов координально изменилась, начиная от стоматологических установок, которые обеспечивают комфортабельность нахождения пациента на приеме у врача, и высокотехнологичных аппаратов, позволяющих безболезненно проводить лечение, заканчивая современными инструментами и эффективными препаратами.
Если раньше такая форма заболевания как «периодонтит», либо «киста» означала, что зуб подлежит удалению, как говорится в советском мультфильме : «Казнить, нельзя помиловать», то на сегодняшний момент «помиловать» МОЖНО, и лечение значительно успешное!
Конечно, эти манипуляции не разовые, потребуется несколько посещений, т.к. процесс остеогенеза (образование кости) длительный. Но результаты положительные и наблюдаются уже через полгода, окончательное выздоровление через год-полтора. Лечение каналов зуба проводится при помощи препарата «Каласепт», в составе которого находится гидроокись кальция.
Но результаты положительные и наблюдаются уже через полгода, окончательное выздоровление через год-полтора. Лечение каналов зуба проводится при помощи препарата «Каласепт», в составе которого находится гидроокись кальция.
Чем же помогает кальций?
Он:
- участвует в формировании костной ткани;
- повышает защитные свойства тканей зуба к микробным воздействиям. микробы погибают за 6 минут, корневые каналы становятся стерильными;
- снижает проницаемость тканей и оказывает противоотечное, противовоспалительное, противоаллергическое, гемостатическое действие;
На рентгенограммах красным цветом показаны границы воспалительных очагов, которые за время лечения препаратом «Каласепт» ( в течение 10 месяцев) уменьшились (на 1 рисунке — воспалительный очаг полностью исчез; на 2 рисунке — значительно сократился в размерах).
На фото результаты работы врачей клиники «Дантист-Профи»
Записывайтесь на лечение к нашим специалистам.
 Мы сделаем всё возможное, чтобы сохранить ваши зубы:
Мы сделаем всё возможное, чтобы сохранить ваши зубы:Октябрьский пр. 41/48: 66-85-32
ул. Балтийская 4: 44-05-32
Гемостатическая губка (50х50х7мм) — кроостанавливающее и антисептическое действие БЕЛКОЗИН
Губка биодеградируемая коллагеновая гемостатическая — ООО «ЛУЖСКОГО ЗАВОДА «БЕЛКОЗИН», произведена по современной технологии. Губка гемостатическая оказывает кровоостанавливающее и антисептическое действие, стимулирует регенерацию тканей. Толщина пластины, позволяет легко моделировать укрываемые контуры при наложении на поврежденные участки ткани. Хорошо адгезирует (прилипает) к раневой поверхности. Оставленная в ране или полости, она полностью рассасывается.Губка гемостатическая представляет собой сухую пористую пластину желтого цвета со специфическим запахом уксусной кислоты, с рельефной поверхностью, с пористой структурой.
Губку гемостатическую готовят из раствора коллагена. В состав губки гемотатической входят: борная кислота и фурацилин. Клинические испытания проводились на базе СПбГМУ им. И.П. Павлова, ВМА им. С.М. Кирова, кафедре неотложной хирургии СПб МАПО.
Клинические испытания проводились на базе СПбГМУ им. И.П. Павлова, ВМА им. С.М. Кирова, кафедре неотложной хирургии СПб МАПО.
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ:
При хирургических вмешательствах в стационарных условиях в ходе проведении таких операций, как традиционная и лапароскопическая холецистэктомия, грыжесечении, остром аппендиците, после обработки рвано-ушибленных ран, обработке ран заживающих вторичным натяжением при панкреатитах, заполнение дефектов паренхиматозных органов и остановки паренхиматозных кровотечений, укрытия анастомозов, при операциях в гинекологии, оториноларингологии, и многих других случаях. Стадии воспаления протекают в более короткие сроки. Лечебный эффект губки сохраняется в течении 2-3 суток без ее замены. Применение губки не вызывает у пациентов нареканий.
СПОСОБ ПРИМЕНЕНИЯ:
Губку гемостатическую соблюдая правила асептики извлекают из упаковки, накладывают на кровоточащее место и прижимают к нему в течение 1-2 минуты , или плотно тампонируют кровоточащую поверхность с последующим бинтованием. После остановки кровотечения пластину не удаляют, так как она в последствии полностью рассасывается. После пропитывания кровью пластина плотно прилегает к кровоточащей поверхности, при необходимости, фиксируется липким бинтом. Если кровотечение не останавливается, накладывается второй слой губки. Кровоостанавливающее действие губки усиливается, если ее дополнительно смочить раствором тромбина. После остановки кровотечения губку не удаляют, так как впоследствии она полностью рассасывается.
После остановки кровотечения пластину не удаляют, так как она в последствии полностью рассасывается. После пропитывания кровью пластина плотно прилегает к кровоточащей поверхности, при необходимости, фиксируется липким бинтом. Если кровотечение не останавливается, накладывается второй слой губки. Кровоостанавливающее действие губки усиливается, если ее дополнительно смочить раствором тромбина. После остановки кровотечения губку не удаляют, так как впоследствии она полностью рассасывается.
ПРОТИВОПОКАЗАНИЯ:
Применение губки гемостатической противопоказано при артериальном кровотечении, индивидуальной непереносимости нитрофуранового ряда (фурацилин, фурагин). Гнойные раны, пиодермия.
ФОРМА ВЫПУСКА:
Губку гемостатическую выпускают толщиной 7±2 мм размером (50±5) × (50±5) мм и (90±10) × (90±10) мм, в индивидуальной упаковке. Стерильно.
СРОК ГОДНОСТИ: 3 года.
↓ Показать описание ↓
различных местных гемостатических средств с разными режимами действия; Сравнительное рандомизированное экспериментальное исследование сосудистой хирургии in vivo
Открытый архив в партнерстве с Европейским обществом сосудистой хирургии
открытый архив
Цели
Оценить эффекты различных местных гемостатических средств в новой экспериментальной модели сосудистого кровотечения с высоким потоком.
Дизайн
Бычий тромбин в сочетании с коллагеновой матрицей (bTcM), микропористые полисахаридные атмосферы (MPH), лиофилизированный rFVIIa с комбинацией MPH и без нее сравнивали с контрольной группой (только компрессия) рандомизированным образом ( 20 животных / группа).Первичной конечной точкой был гемостаз, а вторичными конечными точками — время до гемостаза, кровопотеря и артериальное давление при гемостазе.
Методы
общую сонную артерию гепаринизированных крыс лигировали проксимально и пересекали. Сжатие применялось в течение одной минуты с последующим нанесением местного гемостатического средства. Компрессия поддерживалась еще две минуты с последующей повторной оценкой гемостаза: если кровотечение продолжалось, применялась дополнительная компрессия, и после этого кровотечение проверяли каждую минуту до гемостаза.
Результаты
Все животные в группе bTcM достигли гемостаза по сравнению с 20% в контрольной группе ( p <0,0001). Комбинация MPH и rFVIIa (гемостаз 70%) также показала значительную гемостатическую способность по сравнению с контрольной группой ( p <0,001). Ни одна из других групп активного лечения не отличалась от контрольной группы. Животные, получавшие bTcM, имели значительно более короткое время до гемостаза по сравнению с животными в других группах активного лечения.Существенной разницы в кровопотере и артериальном давлении при гемостазе не обнаружено.
Комбинация MPH и rFVIIa (гемостаз 70%) также показала значительную гемостатическую способность по сравнению с контрольной группой ( p <0,001). Ни одна из других групп активного лечения не отличалась от контрольной группы. Животные, получавшие bTcM, имели значительно более короткое время до гемостаза по сравнению с животными в других группах активного лечения.Существенной разницы в кровопотере и артериальном давлении при гемостазе не обнаружено.
Выводы
Наиболее эффективным гемостатическим агентом был bTcM, за которым следовала комбинация rFVIIa и MPH, в то время как ни MPH, ни rFVIIa сами по себе не проявляли гемостатической способности по сравнению только с компрессией.
Ключевые слова
Местный гемостаз
Тромбин крупного рогатого скота
Микропористые полисахаридные полусферы
Рекомбинантный FVIIa
Рекомендуемые статьи Цитирующие статьи (0)
Просмотреть аннотацию Copyright © 2006 Elsevier Ltd.Все права защищены.
Рекомендуемые статьи
Ссылки на статьи
Местные кровоостанавливающие средства при акушерской и гинекологической хирургии
Номер 812
Комитет ACOG по гинекологической практике
Это заключение комитета было разработано Комитетом гинекологической практики Американского колледжа акушеров и гинекологов в сотрудничестве с членом комитета Кэтрин П. Пеннингтон, доктором медицины, и координатором Дженой Дуниван, доктором медицины.
РЕЗЮМЕ: Существует три широких категории кровоостанавливающих средств: 1) едкие, 2) физические и 3) биологические. Из-за недостатка данных об использовании местных кровоостанавливающих средств в гинекологической и акушерской хирургии показания к применению экстраполируются из данных об использовании этих средств в других типах операций и основываются на мнении экспертов. Местные гемостатические агенты могут быть полезным дополнением к лечению интраоперационного кровотечения в определенных обстоятельствах. Местные гемостатические агенты чаще всего используются в ситуациях, когда использование электрокоагуляции или швов для гемостатического контроля хирургического кровотечения не является идеальным или безопасным, включая кровотечение в областях с близлежащими уязвимыми структурами или при наличии диффузного кровотечения с поверхностей брюшины или поверхностей разрезов твердые органы. При лечении интраоперационного кровотечения нет замены тщательной хирургической технике. По возможности хирург должен попытаться остановить интраоперационное кровотечение с помощью швов, зажимов или электрохирургии перед использованием гемостатических средств.Для хирургов важно понимать правильное использование, противопоказания и стоимость этих средств, чтобы принять наиболее обоснованное решение о лечении пациентов.
Местные гемостатические агенты чаще всего используются в ситуациях, когда использование электрокоагуляции или швов для гемостатического контроля хирургического кровотечения не является идеальным или безопасным, включая кровотечение в областях с близлежащими уязвимыми структурами или при наличии диффузного кровотечения с поверхностей брюшины или поверхностей разрезов твердые органы. При лечении интраоперационного кровотечения нет замены тщательной хирургической технике. По возможности хирург должен попытаться остановить интраоперационное кровотечение с помощью швов, зажимов или электрохирургии перед использованием гемостатических средств.Для хирургов важно понимать правильное использование, противопоказания и стоимость этих средств, чтобы принять наиболее обоснованное решение о лечении пациентов.
Рекомендации и выводы
Американский колледж акушеров и гинекологов делает следующие рекомендации и выводы относительно использования местных кровоостанавливающих средств:
Данные об использовании местных кровоостанавливающих средств в гинекологической и акушерской хирургии ограничены и, следовательно, , рекомендации в значительной степени основаны на выводах, экстраполированных из исследований использования этих агентов в негинекологических и неакушерских операциях.

При лечении интраоперационного кровотечения нет замены тщательной хирургической технике. По возможности хирург должен попытаться остановить интраоперационное кровотечение с помощью швов, зажимов или электрохирургии перед использованием гемостатических средств.
Местные гемостатические агенты чаще всего используются в ситуациях, когда использование электрокоагуляции или швов для гемостатического контроля хирургического кровотечения не является идеальным или безопасным, включая кровотечение в областях с близлежащими уязвимыми структурами (например, мочеточниками или нервами) или в наличие диффузного кровотечения с поверхностей брюшины или срезанных поверхностей твердых органов.
Местные гемостатические агенты не следует использовать для рутинной профилактики послеоперационного кровотечения, поскольку эти агенты могут увеличить риск инфекции, образования спаек и других осложнений.
Местные гемостатические агенты имеют различные механизмы действия, различные профили потенциальных побочных эффектов и разную стоимость.
 Понимание этих различий важно для принятия наиболее подходящих и экономически эффективных решений относительно их использования.
Понимание этих различий важно для принятия наиболее подходящих и экономически эффективных решений относительно их использования.Физические агенты с большей вероятностью будут эффективны у пациентов без нарушений свертывания крови и при менее тяжелых кровотечениях. Когда кровотечение более активно или при наличии коагулопатии, можно рассмотреть возможность применения биологически активных агентов, таких как тромбин и фибриновые герметики для местного применения.
Введение
При лечении интраоперационного кровотечения нет замены тщательной хирургической технике. По возможности хирург должен попытаться остановить интраоперационное кровотечение с помощью швов, зажимов или электрохирургии перед использованием гемостатических средств.Тем не менее, местные гемостатические агенты могут быть полезным дополнением для помощи в лечении интраоперационного кровотечения в определенных обстоятельствах. Местные гемостатические агенты чаще всего используются в ситуациях, когда использование электрокоагуляции или швов для гемостатического контроля хирургического кровотечения не является идеальным или безопасным, включая кровотечение в областях с близлежащими уязвимыми структурами (например, мочеточники или нервы) или при наличии диффузного кровотечения. с перитонеальных поверхностей или срезанных поверхностей твердых органов. Их нельзя использовать в профилактических целях.Данные об использовании местных кровоостанавливающих средств в гинекологической и акушерской хирургии ограничены, поэтому рекомендации в значительной степени основаны на выводах, экстраполированных из исследований по использованию этих средств в негинекологических и неакушерских операциях.
с перитонеальных поверхностей или срезанных поверхностей твердых органов. Их нельзя использовать в профилактических целях.Данные об использовании местных кровоостанавливающих средств в гинекологической и акушерской хирургии ограничены, поэтому рекомендации в значительной степени основаны на выводах, экстраполированных из исследований по использованию этих средств в негинекологических и неакушерских операциях.
Использование транексамовой кислоты для внутривенного введения выходит за рамки данной статьи; руководство по применению транексамовой кислоты для внутривенного введения для профилактики и лечения акушерских кровотечений, связанных с вагинальными родами и кесаревым сечением, см. в Практическом бюллетене No.183, Послеродовое кровотечение 1. Это заключение Комитета не распространяется на лиц с известными нарушениями свертываемости крови. Рекомендации для этих групп населения см. В Заключении Комитета № 785, «Скрининг и лечение нарушений свертываемости крови у подростков с тяжелым менструальным кровотечением», и Заключении Комитета № 580, Болезнь фон Виллебранда у женщин 2 3.
Общий обзор каскада свертывания
Понимание каскада свертывания необходимо для понимания роли местных гемостатических агентов.Вкратце, внутренний путь и внешний путь включают множество факторов, которые в конечном итоге объединяются, чтобы активировать фактор X в общем пути. Активированный фактор X (фактор Ха) необходим для превращения протромбина в тромбин. Затем тромбин может превращать фибриноген в фибрин. Фибрин становится поперечно-сшитым и служит каркасом для тромбоцитов, что в конечном итоге приводит к образованию стабильного фибринового сгустка. и 3) биологический.См. Таблицу 1 для получения подробной информации о физических и биологических местных гемостатических средствах. Названия торговых марок, упомянутые в документе, используются исключительно в целях идентификации продукта и не подразумевают одобрения.
Каустические агенты
Местные едкие агенты включают хлорид алюминия, 20% субсульфат железа (раствор Монселя), нитрат серебра и пасту хлорида цинка. Они коагулируют белки, что приводит к некрозу тканей и образованию струпов, усиливая образование тромбов и гемостаз 4. Хотя они используются в шейке матки и влагалище, они не предназначены для внутрибрюшного применения 5.
Физические агенты
Физические агенты используют субстрат, такой как целлюлоза, желатин, крахмал или коллаген, для формирования матрицы в месте кровотечения, которая активирует каскад внешней коагуляции и служит каркасом для образования сгустка. Таким образом, физические агенты не подходят пациентам с тяжелой коагулопатией, потому что агентам для функционирования 6 требуется неповрежденный каскад коагуляции. Физические агенты доступны в различных формах, включая порошок, губки, тканую сетку или пену.
Желатиновая матрица (например, Gelfilm, GelFoam, Surgifoam) доступна в форме порошка или губки, получена из свиного происхождения и абсорбируется в течение 4–6 недель. Он впитывает окружающую кровь и жидкость, существенно увеличивая свой размер и вес; это может быть полезно для механического гемостаза в дополнение к концентрации тромбоцитов и белков крови в месте кровотечения. Стерильная прессованная желатиновая губка (GelFoam), в частности, может увеличиваться в размерах до двух раз; следует соблюдать осторожность из-за сопутствующих осложнений, таких как компрессионный некроз, при использовании в ограниченном пространстве вблизи хрупких структур (например, нервов) или внутри костных полостей 7 8 9.Продукты с желатиновой матрицей имеют нейтральный pH и поэтому могут использоваться с местным тромбином или другими местными гемостатическими агентами с нейтральным pH 7.
Окисленная регенерированная целлюлоза (например, Surgicel) происходит из растений и доступна в виде порошка или рыхлой сетки, которая может быть обрезан по мере необходимости, а также введен через лапароскопические порты 10. Обычно он абсорбируется в течение 1-2 недель, хотя в опубликованном отчете документально подтверждено наличие стойкого материала в течение 15 месяцев после операции 11. Окисленная регенерированная целлюлоза имеет низкий pH, который помогает формировать искусственный сгусток и усиливает поверхностное взаимодействие между тромбоцитами, коллагеном, факторами коагуляции и сужением сосудов мелких сосудов 10 12 13.Кроме того, его кислая природа обеспечивает теоретические антибактериальные свойства 7 10 14. Примечательно, что низкий pH может инактивировать местный тромбин; таким образом, окисленную регенерированную целлюлозу и тромбин местного применения нельзя использовать вместе.
Микропористые полисахаридные гемосферы (например, Arista) представляют собой кровоостанавливающее средство из полисахаридного порошка растительного происхождения. Порошок абсорбирует воду и, следовательно, концентрирует тромбоциты и другие белки для ускорения образования сгустка 15. Поскольку порошок всасывается примерно за 48 часов, теоретически он может с меньшей вероятностью вызвать реакцию на инородное тело или служить очагом инфекции по сравнению с другими физические агенты 15.
Микрофибриллярный коллаген (например, Avitene) производится из очищенного бычьего коллагена и поставляется в виде порошка или пены. Он обеспечивает большую площадь поверхности, что способствует агрегации тромбоцитов и образованию тромбов 15. Он всасывается за 8–12 недель.
Биологические агенты
Биологические агенты, такие как местный тромбин и фибриновый герметик, обходят начальные этапы каскада коагуляции (внешний путь), способствуя гемостазу через общий путь. Тромбин в месте кровотечения расщепляет фибриноген с образованием фибринового сгустка 7.В отличие от физических агентов, местный тромбин можно использовать у пациентов с нарушенным каскадом коагуляции, но адекватным уровнем фибриногена; Таким образом, он полезен для пациентов с легкой коагулопатией 16. Вероятность того, что он будет эффективен у пациентов с тяжелой коагулопатией, будет меньше, особенно при наличии гипофибриногенемии. Тромбины для местного применения (например, Thrombin-JMI, Recothrom, Evithrom) могут быть получены либо из коровьих, человеческих, либо из рекомбинантных источников, и каждый тип имеет свой профиль безопасности. Эти агенты обычно наносятся шприцем или распылителем.Тромбин можно использовать отдельно, но часто его комбинируют с желатиновой матрицей, такой как гранулы желатина, для создания «текучего» гемостатического агента (например, Floseal). Его также можно сочетать с желатиновой губкой или с фибриногеном человека (дополнительную информацию см. Ниже в разделе «Фибриновый герметик»). Многие хирурги могут не знать, что местный тромбин не следует сочетать с окисленной регенерированной целлюлозой, потому что кислотность окисленной регенерированной целлюлозы может нейтрализовать эффективность местного тромбина 12.
Фибриновые герметики (например, Tisseel, Evicel) представляют собой двухкомпонентную систему, которая сочетает раствор тромбина с концентрированным раствором фибриногена человека, который наносится непосредственно на место кровотечения, что позволяет сформировать сгусток фибрина.Некоторые продукты также содержат апротинин, антифибринолитический агент, который помогает поддерживать стабильные сгустки фибрина 16. Фибриновые герметики можно использовать у пациентов с коагулопатией, даже у пациентов с дефицитом фибриногена. Одним из потенциальных недостатков фибриновых герметиков является то, что их приготовление занимает больше времени по сравнению с другими местными кровоостанавливающими средствами. Это включает по крайней мере 10–20 минут для размораживания, в зависимости от конкретного продукта 17. Они также являются одними из самых дорогих из всех местных гемостатических средств.
Транексамовая кислота оказывает антифибринолитическое действие, вытесняя плазминоген с поверхности фибрина и подавляя протеолитическую активность плазмина.Внутривенное введение транексамовой кислоты уменьшает кровотечение во время хирургического вмешательства, но из-за опасений по поводу возможных тромбоэмболических осложнений также изучается местное применение транексамовой кислоты. Транексамовую кислоту можно смешивать со стерильной водой и наносить непосредственно на кровоточащие поверхности. Концентрации в плазме после местного применения транексамовой кислоты составляют менее одной десятой от уровня после внутривенного введения. Было показано, что местная транексамовая кислота снижает кровопотерю при различных хирургических вмешательствах, включая кардиологическую, спинальную, отоларингологическую и артропластику коленного сустава.Его влияние на тромбоэмболические события не определено 18.
Показания к применению
Из-за недостатка данных об использовании местных гемостатических средств в гинекологической и акушерской хирургии показания к применению экстраполируются на основании данных об использовании этих средств в другие виды операций и основываются на мнении специалистов. По возможности хирург должен попытаться остановить интраоперационное кровотечение с помощью швов, зажимов или электрохирургии перед использованием гемостатических средств.Местные кровоостанавливающие средства не следует использовать для рутинной профилактики послеоперационного кровотечения, поскольку эти средства могут увеличить риск инфекции, образования спаек и других осложнений.
Как правило, любое местное кровоостанавливающее средство более эффективно при низком давлении и низкой скорости венозного кровотечения. Микропористые полисахаридные гемосферы (Arista) — единственное местное кровоостанавливающее средство, одобренное для лечения артериальных кровотечений. Физические агенты часто используются в качестве средства первой линии для контроля минимального кровотечения из-за их быстрой доступности.Кроме того, они обычно дешевле биологических агентов. Физические агенты с большей вероятностью будут эффективны у пациентов без нарушений свертывания крови и при менее тяжелых кровотечениях. Когда кровотечение более активно или при наличии коагулопатии, можно рассмотреть возможность применения биологически активных агентов, таких как тромбин и фибриновые герметики для местного применения.
Эффективность
В целом качественные данные, сравнивающие эффективность различных местных гемостатических агентов, отсутствуют. Однако было проведено небольшое количество рандомизированных контролируемых клинических испытаний, в которых сравнивали препараты для местного применения.Рандомизированные контролируемые испытания, сравнивающие фибриновый герметик с окисленной регенерированной целлюлозой 19 20 или с другим местным гемостатическим агентом по отдельности или в комбинации, включая окисленную регенерированную целлюлозу, желатиновую матрицу, желатиновую матрицу с тромбином и микрофибриллярный коллаген 21 22, продемонстрировали, что фибриновый герметик имел наибольший успех. скорость достижения гемостаза, выполнялась быстрее, чем другие агенты, и могла быть эффективной, когда другие гемостатические агенты не помогли. Однако они более дорогие и требуют больше времени для приготовления.
Желатиновая матрица часто сочетается с местным тромбином. Мало что известно об относительной эффективности комбинации желатин-тромбин по сравнению с одним желатином, хотя в исследованиях на животных было показано, что она более эффективна, чем один желатин 23. Несколько рандомизированных испытаний, сравнивающих текучую комбинацию жидкого тромбина и гранул желатина (Floseal) к желатиновой губке (Gelfoam), пропитанной тромбином, продемонстрировали, что комбинация текучего жидкого тромбина и желатиновых гранул (Floseal) превосходит 24 25.Прямые сравнения бычьего тромбина и объединенного тромбина 26 плазмы человека и бычьего тромбина с рекомбинантным тромбином 27 предполагают, что все три формы местного тромбина имеют одинаковую эффективность.
Возможные осложнения
Инфекция — это наиболее частое осложнение, связанное с местными гемостатическими средствами. Однако важно отметить, что неконтролируемое кровотечение во время операции связано с другими факторами риска инфицирования, включая длительное время операции, переливание крови и другие характеристики, которые могут затруднить связь между инфекцией и использованием гемостатических средств.Тем не менее, любой продукт с замедленным всасыванием может стать потенциальным очагом заражения. Как правило, необходимо использовать минимально необходимое количество необходимого местного гемостатического средства и удалить излишки местного средства после достижения адекватного гемостаза, чтобы максимально снизить риск инфекции. Окисленная регенерированная целлюлоза может иметь более низкий риск инфицирования по сравнению с другими физическими гемостатическими средствами 28 29 и обладает некоторой бактерицидной активностью из-за ее кислого pH 30; однако чрезмерное употребление все же может вызвать инфекцию 28.Имеются некоторые свидетельства того, что физические гемостатические агенты могут имитировать абсцесс при визуализации, даже при отсутствии инфекции 31.
Сообщалось о реакциях на инородные тела, таких как образование гранулемы и фиброз, с физическими агентами, включая микрофибриллярный коллаген 32, окисленную регенерированную целлюлозу 33 и агенты на основе желатина 34, 35, 36, 37. Спайки и непроходимость тонкой кишки в месте предыдущего нанесения также были зарегистрированы с продуктами текучей тромбин-желатиновой матрицы, используемыми отдельно 38 39 или в комбинации с окисленной регенерированной целлюлозой 40.В соответствии с инструкциями производителя для тромбин-желатинового продукта, избыток вещества, не включенного в кровоостанавливающий сгусток, следует удалить осторожным орошением 41.
Объединенные герметики из человеческого тромбина и фибрина, которые содержат человеческий фибриноген в дополнение к тромбину, теоретический риск передачи вируса. Из-за строгих методов скрининга общий риск довольно низок: риск вируса иммунодефицита человека (ВИЧ) и гепатита оценивается ниже 1 из 10 15 как для тромбина, так и для фибриногена, а риск парвовируса немного выше, но все еще низкий, менее 1 из 10 7 на флакон тромбина и менее 1 из 500 000 для фибриногена 42.Описан случай парвовирусной инфекции после использования фибринового герметика во время гистерэктомии 43.
Могут возникать аллергические реакции и иммунологические реакции. Большинство реакций возникает при использовании биологических агентов. Тромбин крупного рогатого скота может вызвать тяжелые реакции, опосредованные антителами, которые могут привести к выработке антител против тромбина и фактора V, и привести к иммуноопосредованной коагулопатии с тяжелым послеоперационным кровотечением при повторном воздействии 44 45. Пищевые продукты и лекарства США Предупреждение администрации в виде черного ящика предостерегает от повторного воздействия тромбина крупного рогатого скота на пациентов с антителами к препаратам тромбина крупного рогатого скота 46.Для хирургов может быть благоразумным избегать использования тромбина бычьего происхождения у пациентов, которые ранее подвергались воздействию этого агента, поскольку рутинные клинические испытания на антитела к тромбину бычьего происхождения обычно не проводятся. Продукция антител также может происходить у пациентов, подвергшихся воздействию объединенного человеческого тромбина и рекомбинантного тромбина, но это происходит с гораздо меньшей частотой по сравнению с тромбином крупного рогатого скота 47. В послеоперационном периоде пациенты, которые лечились тромбином крупного рогатого скота, должны быть предупреждены о потенциальных рисках, связанных с повторным -воздействие во время будущих хирургических вмешательств.
Существует также теоретический риск аллергических реакций на рекомбинантный тромбин у пациентов, страдающих аллергией на линии клеток хомяка или протеазы змей, используемые для производства продукта. Фибриновые герметики могут вызывать аллергические реакции в зависимости от типа используемого тромбина. Некоторые фибриновые герметики также содержат антифибринолитический агент апротинин; сообщалось об анафилактических реакциях при повторном воздействии апротинина 48. Фибриновые герметики, приготовленные из плазмы или криопреципитата, не следует использовать у людей, у которых в прошлом была анафилаксия с использованием продуктов плазмы или у которых есть дефицит иммуноглобулина А.Продукты животного происхождения, в том числе желатиновый матрикс (свиной) и микрофибриллярный коллаген (бычий), также теоретически могут вызывать аллергические реакции; однако желатиновая матрица не считается антигенной. Сообщалось об одном случае тяжелой системной аллергической реакции после использования микрофибриллярного коллагена при лапароскопической холецистэктомии 49.
Сообщалось о газовой эмболии, включая смерть, при применении фибриновых герметиков в виде спрея 50 51. Риск может возрасти, если герметик распыляется также близко к ткани или при превышении максимально рекомендованного давления распыления.В одном из клинических случаев описана внутрисосудистая тромбоэмболия смеси тромбин-желатин, случайно попавшей во внутрисосудистое пространство при нанесении на быстро кровоточащую венозную ножку 52. Внутрисосудистое использование гемостатических средств противопоказано из-за риска эмболизации. Кроме того, использование местных гемостатических агентов в сочетании с системами спасения клеток остается спорным из-за опасений по поводу свертывания крови в интраоперационных резервуарах для спасения. Сообщалось о случаях тромбоэмболии легочной артерии после реинфузии восстановленной крови 53.Американская ассоциация банков крови рекомендует при использовании системы восстановления крови избегать аспирации в области, где используются местные гемостатические средства 54.
Другие соображения
Использование гемостатических средств часто невозможно предсказать, поскольку они используются в ситуации непредвиденного кровотечения; Таким образом, необязательно давать пациентам до операции согласие на возможное использование различных продуктов. Однако акушеры-гинекологи и другие клиницисты должны чутко относиться к религиозным возражениям или светским проблемам, связанным с кровоостанавливающими средствами, и участвовать в беседе с информированным согласием о возможном использовании, когда это возможно.Этот разговор может происходить, когда пациент сообщает врачу, что отказывается от продуктов крови или возражает против продуктов, полученных из крупного рогатого скота или свиньи. Для пациентов, которые отказываются от продуктов крови, акушер-гинеколог должен обсудить информированное согласие о местных гемостатических средствах плазмы крови перед операцией 55. Вместо тромбина, полученного из плазмы, эффективной альтернативой является рекомбинантный тромбин. Если пациент поднимает вопрос о продуктах животного происхождения, акушер-гинеколог должен сообщить пациенту об альтернативных кровоостанавливающих средствах.Важно отметить, что религиозные лидеры со всего мира поддерживают использование продуктов животного происхождения, если нет других альтернатив или в случае чрезвычайной ситуации 56. Кроме того, стоимость конкретных гемостатических средств варьируется, и акушеры-гинекологи рекомендуется понимать затраты в соответствующих учреждениях.
Заключение
Поскольку использование местных гемостатических средств может увеличить риск осложнений, их не следует использовать для плановой профилактики послеоперационного кровотечения.Местные гемостатические агенты имеют разные механизмы действия, разные профили потенциальных побочных эффектов и разную стоимость. Понимание этих различий важно для принятия наиболее подходящих и экономически эффективных решений относительно их использования. Физические агенты можно рассматривать у пациентов без нарушений свертывания крови и при менее тяжелых кровотечениях. Физические агенты обычно дешевле, чем биологические агенты, но могут возникать инфекции и реакции с инородным телом. Напротив, когда происходит более активное кровотечение, присутствует коагулопатия, или, если физические агенты не эффективны, можно рассмотреть возможность применения биологических агентов.Биологические агенты или комбинированные агенты имеют тенденцию быть более дорогими и могут быть связаны с риском патогенов, передающихся через кровь, иммунологических событий или аллергических реакций, в зависимости от агента. Хотя фибриновые герметики являются наиболее дорогостоящим типом биологического агента, они связаны с более высокими показателями контроля и могут быть уместны, когда кровотечение не реагирует на другие агенты или при наличии тяжелой коагулопатии. Для хирургов важно понимать правильное использование, противопоказания и стоимость этих средств, чтобы принять наиболее обоснованное решение о лечении пациентов.
Опубликовано онлайн 24 сентября 2020 г.
Авторские права 2020 Американского колледжа акушеров и гинекологов. Все права защищены. Никакая часть этой публикации не может быть воспроизведена, сохранена в поисковой системе, размещена в Интернете или передана в любой форме и любыми средствами, электронными, механическими, путем фотокопирования, записи или иными способами, без предварительного письменного разрешения издателя.
Американский колледж акушеров и гинекологов 409 12th Street SW, Вашингтон, округ Колумбия 20024-2188
Местные кровоостанавливающие средства во время акушерских и гинекологических операций.Заключение комитета ACOG № 812. Американский колледж акушеров и гинекологов. Obstet Gynecol 2020; 136: e81–89.
Эта информация разработана как образовательный ресурс, чтобы помочь клиницистам в оказании акушерской и гинекологической помощи, и использование этой информации является добровольным. Эта информация не должна рассматриваться как исчерпывающая информация обо всех надлежащих процедурах или методах ухода или как изложение стандарта ухода. Он не предназначен для замены независимого профессионального суждения лечащего врача.Вариации на практике могут быть оправданы, когда, по разумному мнению лечащего врача, такой курс действий определяется состоянием пациента, ограниченностью доступных ресурсов или прогрессом в знаниях или технологиях. Американский колледж акушеров и гинекологов регулярно проверяет свои публикации; однако его публикации могут не отражать самые последние данные. Любые обновления этого документа можно найти на сайте acog.org или позвонив в Центр ресурсов ACOG.
Хотя ACOG прилагает все усилия для предоставления точной и надежной информации, эта публикация предоставляется «как есть», без каких-либо явных или подразумеваемых гарантий точности, надежности или иным образом.ACOG не гарантирует, не гарантирует и не поддерживает продукты или услуги какой-либо фирмы, организации или лица. Ни ACOG, ни его должностные лица, директора, члены, сотрудники или агенты не несут ответственности за любые убытки, ущерб или претензии в отношении любых обязательств, включая прямые, особые, косвенные или косвенные убытки, понесенные в связи с этой публикацией или доверием. по представленной информации.
Все члены и авторы комитета ACOG подали заявление о раскрытии конфликта интересов в отношении этого опубликованного продукта.Любые потенциальные конфликты были рассмотрены и разрешены в соответствии с Политикой раскрытия информации о конфликте интересов ACOG. Политики ACOG можно найти на acog.org. Для продуктов, разработанных совместно с другими организациями, раскрытие информации о конфликте интересов представителями других организаций осуществляется этими организациями. Американский колледж акушеров и гинекологов не запрашивал и не принимал никакого коммерческого участия в разработке содержания этого опубликованного продукта.
Гемостатическое действие древесного угля из листьев лотоса, вероятно, связано с преобразованием флавонол-агликонов из флавонол-гликозидов в традиционной китайской медицине
Abstract
Этнофармакологическая значимость
Nelumbo nuciferamostatic Gaertn (листья лотоса) были усилены эмпирической карбонизацией листьев лотоса эффект в традиционной китайской медицине. Механизм этого приложения остается неясным.
Цель исследования
Настоящее исследование направлено на изучение превращения фитохимических соединений в листьях лотоса после нагревания и выяснение фитохимического механизма применения угольных кровоостанавливающих средств.
Методы и результаты
Сырые листья лотоса нагревали до 150 ° C и 220 ° C, соответственно, и изучили трансформацию фитохимических веществ. Было обнаружено, что гликозиды флавонолов в сырых листьях лотоса разлагаются до соответствующих агликонов в древесном угле из листьев лотоса при 150 ° C (LLC) и последующих продуктов разложения агликонов в LLC при 220 ° C. LLC при 150 ° C продемонстрировал наиболее желательный гемостатический эффект у мышей по сокращению как времени кровотечения (BT), так и времени свертывания (CT) более чем на 30% по сравнению с группой, не получавшей лечения (P <0.05). Экстракты LLC при 150 ° C были дополнительно разделены с использованием различных растворителей. Фракция этилацетата, содержащая много флавонол-агликонов, показала наиболее желаемый гемостатический эффект. Напротив, фракция петролейного эфира содержит плохое количество флавоноидов и много алкалоидов, таким образом продлевая BT и CT. Экстракты N-бутанола, содержащие только флавонолгликозид, не смогли сократить CT. У крыс стандарт кверцетина (агликона) способствовал свертыванию крови за счет сокращения ЧАТВ (активированного частичного тромбопластинового времени) и увеличения фибриногена (P <0.05). Гиперозид (гликозид) увеличивает количество фибриногена и тромбоцитов (P <0,05). Было показано, что нуциферин удлиняет АЧТВ и ТТ (тромбиновое время) и снижает фибриноген (P> 0,05).
Заключение
Было высказано предположение, что разложение флавоноидов и алкалоидов в листьях лотоса усиливает гемостатический эффект LLC. Было обнаружено, что агликоны флавонола более эффективны в отношении свертывания крови по сравнению с их соответствующими гликозидами. Нуциферин, типичный алкалоид в листьях лотоса, который разлагался в LLC, показал антикоагулянтный эффект у крыс.Содержание флавоноидного агликона можно рассматривать как критерий для квалификации LLC.
Ключевые слова
Nelumbo nucifera Листовой уголь Gaertn
Гемостатический эффект
Флавонол агликон
Флавонол гликозид
Алкалоид
Сокращения
EA2000 PetroleumЭкстракция
Традиционные китайские лекарственные препараты
этилацетатные экстракты
CMC-Naкарбоксиметилцеллюлоза натрия
APTTактивированное частичное тромбопластиновое время
Рекомендуемые статьиЦитирующие статьи (0)
Полный текст© 2019 Elsevier B.V. Все права защищены.
Рекомендуемые статьи
Цитирующие статьи
Достижения в области терапии местными гемостатическими средствами: всестороннее обновление
Лоу Дж., Любер Дж., Левицкий С., Хантак Э., Монтгомери Дж., Шистл Н. и др. Оценка местной гемостатической эффективности и безопасности фибринового герметика TISSEEL VH S / D по сравнению с лицензированным в настоящее время TISSEEL VH у пациентов, перенесших кардиохирургию: рандомизированное двойное слепое клиническое исследование фазы 3. J Cardiovasc Surg (Турин).2007. 48 (3): 323–31.
CAS Google ученый
Оклу Р., Альбадави Х., Джонс Дж. Э., Ю Х. Дж., Уоткинс М. Т. Снижение ишемического реперфузионного повреждения задних конечностей у мышей с мутантным toll-подобным рецептором-4 связано с уменьшением внеклеточных ловушек нейтрофилов. J Vasc Surg. 2013. 58 (6): 1627–36. https://doi.org/10.1016/j.jvs.2013.02.241.
Артикул PubMed Google ученый
Chiara O, Cimbanassi S, Bellanova G, Chiarugi M, Mingoli A, Olivero G и др. Систематический обзор использования местных гемостатов при травмах и неотложной хирургии. BMC Surg. 2018; 18 (1): 68. https://doi.org/10.1186/s12893-018-0398-z.
CAS Статья PubMed PubMed Central Google ученый
Echave M, Oyagüez I, Casado MA. Использование Floseal ® , герметика матрикса из желатина и тромбина человека, в хирургии: систематический обзор.BMC Surg. 2014; 14: 111. https://doi.org/10.1186/1471-2482-14-111.
CAS Статья PubMed PubMed Central Google ученый
Rojas S, Arias B, Miquel I, Sánchez P, Ureta C, Rincón E, López R, Murat J. Экспериментальная оценка нового местного гемостата на основе тканевого фактора (TT-173) для лечения заболеваний печени. кровотечение. J Invest Surg. 2018; 31: 1–11. https://doi.org/10.1080/08941939.2018.1517840.
Артикул Google ученый
Cheng Y, Ye M, Xiong X, Peng S, Wu HM, Cheng N и др. Фибриновые герметики для профилактики послеоперационной панкреатической фистулы после операции на поджелудочной железе. Кокрановская база данных Syst Rev.2016; 2: CD009621. https://doi.org/10.1002/14651858.CD009621.pub2 (Обзор. Обновление в: Cochrane Database Syst Rev. 2018 6: CD009621) .
Брукнер Б.А., Блау Л.Н., Родригес Л., Суарес Е.Е., Нго Ю.К., Рирдон М.Дж. и др. Гемостат, рассасывающийся из микропористого полисахарида, используется в кардиоторакальных хирургических вмешательствах.J Cardiothorac Surg. 2014; 9: 134. https://doi.org/10.1186/s13019-014-0134-4.
Артикул PubMed PubMed Central Google ученый
Райт Н.М., Пак Дж., Тью Дж. М., Ким К. Д., Шаффри М. Е., Ченг Дж. И др. Система герметика для позвоночника обеспечивает лучшее водонепроницаемое закрытие во время операции, чем стандартная помощь во время операции на позвоночнике: проспективное многоцентровое рандомизированное контролируемое исследование. Позвоночник (Phila Pa 1976). 2015; 40 (8): 505–13. https: // doi.org / 10.1097 / BRS.0000000000000810.
Артикул Google ученый
Miscusi M, Polli FM, Forcato S, Coman MA, Ricciardi L, Ramieri A и др. Использование хирургических герметиков при заживлении разрывов твердой мозговой оболочки при неинструментальных операциях на позвоночнике. Eur Spine J. 2014; 23 (8): 1761–6. https://doi.org/10.1007/s00586-013-3138-1.
Артикул PubMed Google ученый
Фишер С.П., Вуд К.Г., Шен Дж., Батиллер Дж., Харт Дж. К., Пател Б. и др. Рандомизированное испытание фибринового герметика без апротинина в сравнении с рассасывающимся кровоостанавливающим средством. Clin Appl Thromb Hemost. 2011. 17 (6): 572–7. https://doi.org/10.1177/1076029611404212.
CAS Статья PubMed Google ученый
Чалмерс Р.Т., Дарлинг III Р.С., Вингард Дж. Т., Четтер И., Катлер Б., Керн Дж. А. и др. Рандомизированное клиническое испытание фибринового герметика, не содержащего транексамовую кислоту, во время хирургических вмешательств на сосудах.Br J Surg. 2010. 97 (12): 1784–9. https://doi.org/10.1002/bjs.7235.
CAS Статья PubMed Google ученый
Ван Г.Дж., Голдтуэйт Калифорния младший, Беркс С.Г., Спотниц В.Д., Группа ортопедических исследований. Опыт улучшает успешное использование фибринового герметика при тотальной артропластике коленного сустава: значение для хирургического образования. J Long Term Eff Med Implants. 2003. 13 (5): 389–97. https://doi.org/10.1615/jlongtermeffmedimplants.v13.i5.40.
Артикул PubMed Google ученый
Пракаш С., Тхакур А. Концентраты тромбоцитов: прошлое, настоящее и будущее. J Maxillofac Oral Surg. 2011; 10 (1): 45–9. https://doi.org/10.1007/s12663-011-0182-4.
Артикул PubMed PubMed Central Google ученый
Эспозито Ф., Ангилери Ф. Ф., Круз П., Кавалло Л. М., Солари Д., Эспозито В., Томаселло Ф., Каппабьянка П.Фибриновые герметики для герметизации твердой мозговой оболочки: систематический обзор литературы. PLoS ONE. 2016; 11 (4): e0151533. https://doi.org/10.1371/journal.pone.0151533.
CAS Статья PubMed PubMed Central Google ученый
Montana M, Tabélé C, Curti C, Terme T, Rathelot P, Gensollen S, Vanelle P. Органические клеи или фибриновые клеи из объединенной плазмы: эффективность, безопасность и потенциал в качестве систем доставки каркаса. J Pharm Pharm Sci. 2012; 15 (1): 124–40.https://doi.org/10.18433/j39k5h.
Артикул PubMed Google ученый
Тейлор Л. М. мл., Мюллер-Фельтен Г., Кослоу А., Хантер Г., Наслунд Т., Клайн Р. и др. Проспективное рандомизированное многоцентровое испытание фибринового герметика по сравнению с пропитанной тромбином желатиновой губкой при кровотечении через шовное или игольное отверстие из трансплантатов бедренной артерии из политетрафторэтилена. J Vasc Surg. 2003. 38 (4): 766–71. https://doi.org/10.1016/s0741-5214(03)00474-9.
Артикул PubMed Google ученый
Zhang WH, Bai YY, Guo W., Li M, Chang GX, Liu W., Mao Y. Применение внутрилегочной проволоки в сочетании с внутриплевральным фибриновым клеем при предоперационной локализации небольших легочных узелков. Медицина (Балтимор). 2019; 98 (4): e14029. https://doi.org/10.1097/MD.0000000000014029.
CAS Статья Google ученый
Вакалопулос К.А., Даамс Ф., Ву З., Тиммерманс Л., Джикель Дж. Дж., Кляйнренсинк Дж. Дж. И др. Тканевые адгезивы в желудочно-кишечном анастомозе: систематический обзор.J Surg Res. 2013. 180 (2): 290–300. https://doi.org/10.1016/j.jss.2012.12.043.
CAS Статья PubMed Google ученый
Гринберг Дж. А., Робинсон Дж. Н., Карабуэна Дж. М., Фарбер М. К., Карузи Д. А.. Использование пластыря из фибринового герметика при кесаревом сечении для консервативного лечения патологически прикрепленной плаценты. Отчет AJP 2018; 8 (4): e325 – e327327. https://doi.org/10.1055/s-0038-1675848.
Артикул PubMed PubMed Central Google ученый
Fischer CP, Bochicchio G, Shen J, Patel B, Batiller J, Hart JC. Проспективное рандомизированное контролируемое исследование эффективности и безопасности фибриновой прокладки в качестве дополнительного средства для контроля кровотечения из мягких тканей во время абдоминальной, забрюшинной, тазовой и торакальной хирургии. J Am Coll Surg. 2013. 217 (3): 385–93. https://doi.org/10.1016/j.jamcollsurg.2013.02.036.
Артикул PubMed Google ученый
Simo KA, Hanna EM, Imagawa DK, Iannitti DA.Гемостатические агенты в хирургии гепатобилиарной и поджелудочной железы: обзор литературы и критическая оценка нового фибринового герметика, связанного с носителем (TachoSil). ISRN Surg. 2012; 2012: 729086. https://doi.org/10.5402/2012/729086.
CAS Статья PubMed PubMed Central Google ученый
Spotnitz WD. Кровоостанавливающие, герметики и адгезивы: практическое руководство для хирурга. Am Surg. 2012. 78 (12): 1305–21.
Артикул Google ученый
Fu X, Tian P, Xu GJ, Sun XL, Ma XL. Кровоостанавливающее средство на основе тромбина при первичном тотальном артропластике коленного сустава. J Knee Surg. 2017; 30 (2): 121–7. https://doi.org/10.1055/s-0036-1582137.
Артикул PubMed Google ученый
Comadoll JL, Comadoll S, Hutchcraft A, Krishnan S, Farrell K, Kreuwel HT, Bechter M. Сравнение гемостатического матрикса и стандартного гемостаза у пациентов, перенесших первичную ТКА. Ортопедия. 2012; 35 (6): e785 – e793793.https://doi.org/10.3928/01477447-20120525-14.
Артикул PubMed Google ученый
Дэвид Г., Лим С., Гуннарссон С., Кочарян Р., Рой С. Схожие исходы для пациентов, но разные затраты на лечение текучих гемостатических средств. J Med Econ. 2015; 18 (9): 735–45. https://doi.org/10.3111/13696998.2015.1044994.
Артикул PubMed Google ученый
Nasso G, Piancone F, Bonifazi R, Romano V, Visicchio G, De Filippo CM и др. Проспективное рандомизированное клиническое испытание матричного герметика FloSeal в кардиохирургии. Ann Thorac Surg. 2009. 88 (5): 1520–6. https://doi.org/10.1016/j.athoracsur.2009.07.014.
Артикул PubMed Google ученый
Wagenhäuser MU, Mulorz J, Ibing W, Simon F, Spin JM, Schelzig H, et al. Окисленная (не) регенерированная целлюлоза влияет на фундаментальные клеточные процессы заживления ран.Научный доклад 2016; 2016 (6): 32238. https://doi.org/10.1038/srep32238.
CAS Статья Google ученый
Brodbelt AR, Miles JB, Foy PM, Broome JC. Интраспинальная окисленная целлюлоза (Surgicel), вызывающая отсроченную параплегию после торакотомии — сообщение о трех случаях. Ann R Coll Surg Engl. 2002. 84 (2): 97–9.
CAS PubMed PubMed Central Google ученый
Cheng F, Wu Y, Li H, Yan T, Wei X, Wu G и др. Биоразлагаемая сетка из композита N , O -карбоксиметилхитозан / окисленная регенерированная целлюлоза в качестве барьера для предотвращения послеоперационной адгезии. Carbohydr Polym. 2019; 207: 180–90. https://doi.org/10.1016/j.carbpol.2018.10.077.
CAS Статья PubMed Google ученый
Menovsky T, Plazier M, Rasschaert R, Maas AI, Parizel PM, Verbeke S.Массивный отек гемостатического средства Surgicel ® Fibrillar ™ после операции на позвоночнике. Отчет о болезни и обзор литературы. Минимально инвазивный нейрохирург. 2011. 54 (5–6): 257–9. https://doi.org/10.1055/s-0031-1284394.
Lv F, Cong X, Tang W, Han Y, Tang Y, Liu Y и др. Новые кровоостанавливающие средства на основе смеси желатин-микробной трансглутаминазы. Sci China Life Sci. 2017; 60 (4): 397–403. https://doi.org/10.1007/s11427-015-9019-x.
CAS Статья PubMed Google ученый
Abbott WM, Austen WG. Эффективность и механизм местного гемостаза, вызванного коллагеном. J Cardiovasc Surg (Турин). 1976. 17 (1): 95–6.
CAS Google ученый
Ямагами Т., Канда К., Като Т., Хирота Т., Нисида К., Йошимацу Р. и др. Эмболизация проксимальной анастомотической псевдоаневризмы, развивающейся после хирургического лечения аневризмы брюшной аорты бифуркационным трансплантатом с н-бутилцианоакрилатом. Br J Radiol.2006; 79 (948): e193 – e195195. https://doi.org/10.1259/bjr/97367208.
CAS Статья PubMed Google ученый
Coulthard P, Worthington H, Esposito M, Elst M, Waes OJ. Тканевые клеи для закрытия хирургических разрезов. Кокрановская база данных Syst Rev.2004; (2): CD004287. https://doi.org/10.1002/14651858.CD004287.pub3.
Jeanmonod D, Rammohan G, Jeanmonod R. Тромбостатические средства и тканевые адгезивы в отделении неотложной помощи: остановка кровотечения, закрытие раны и новые применения.В: Фирстенберг М.С.С., Ставицки С.П., ред. Биохирургические препараты — новый рубеж в оперативных подходах. 2020. https://doi.org/10.5772/intechopen.91470. https://www.intechopen.com/online-first/thrombostatic-agents-and-tissue-adhesives-in-the-emergency-department-stopping-the-bleeding-closing-.
Pace Napoleone C, Oppido G, Angeli E, Gargiulo G. Рестернотомия в детской кардиохирургии: первоначальный опыт CoSeal. Взаимодействовать Cardiovasc Thorac Surg. 2007. 6 (1): 21–3. https: // doi.org / 10.1510 / icvts.2006.141531.
Артикул PubMed Google ученый
Bhamidipati CM, Coselli JS, LeMaire SA. BioGlue в 2011 году: какова его роль в кардиохирургии? J Extra Corpor Technol. 2012; 44 (1): P6–12.
PubMed PubMed Central Google ученый
Гурусами К.С., Ли Дж., Воган Дж., Шарма Д., Дэвидсон Б.Р. Сердечно-легочные вмешательства для уменьшения кровопотери и потребности в переливании крови для резекции печени.Кокрановская база данных Syst Rev.2012; (5): CD007338. https://doi.org/10.1002/14651858.CD007338.pub3.
Luo Z, Wang S, Zhang S. Изготовление самособирающегося каркаса из нановолокон D-формы пептида d-EAK16 для быстрого гемостаза. Биоматериалы. 2011; 32 (8): 2013–20. https://doi.org/10.1016/j.biomaterials.2010.11.049.
CAS Статья PubMed Google ученый
Sun H, Lv L, Bai Y, et al. Материалы с применением нанотехнологий для гемостатического и противоинфекционного лечения в ортопедической хирургии.Int J Nanomed. 2018; 13: 8325–38. https://doi.org/10.2147/IJN.S173063.
CAS Статья Google ученый
Te Grotenhuis R, van Grunsven PM, Heutz WM, Tan EC. Использование гемостатических повязок на догоспитальном этапе в службах неотложной медицинской помощи в Нидерландах: проспективное исследование 66 случаев. Травма, повреждение. 2016; 47 (5): 1007–111. https://doi.org/10.1016/j.injury.2016.01.005.
Артикул Google ученый
Шина А., Липски А.М., Надлер Р., Леви М., Бенов А., Ран И. и др. Использование гемостатических повязок на догоспитальном этапе Медицинским корпусом Сил обороны Израиля: серия случаев с участием 122 пациентов. J Trauma Acute Care Surg. 2015; 79 (4 Приложение 2): S204 – S209209. https://doi.org/10.1097/TA.0000000000000720.
CAS Статья PubMed Google ученый
Гриссом Т.Э., Фанг Р. Местные кровоостанавливающие средства и повязки на догоспитальном этапе.Curr Opin Anaesthesiol. 2015. 28 (2): 210–6. https://doi.org/10.1097/ACO.0000000000000166.
CAS Статья PubMed Google ученый
Мортазави С.М., Атефи А., Рошан-Шомал П., Раадпей Н., Мортазави Г. Разработка нового гемостатического агента на минеральной основе, состоящего из комбинации минералов бентонита и цеолита. Дж. Аюб Мед Колл Абботтабад. 2009. 21 (1): 3–7.
CAS PubMed Google ученый
Shanmugam V, Робинсон MH. Отчет о случае неконтролируемого тазового кровотечения, купленного ранее незарегистрированным методом (QuikClot). Colorectal Dis. 2009. 11 (2): 221–2. https://doi.org/10.1111/j.1463-1318.2008.01550.x.
CAS Статья PubMed Google ученый
Арно Ф, Томори Т., Карр В., МакКиг А., Тераниши К., Прусачик К. и др. Экзотермическая реакция в цеолитных гемостатических повязках: QuikClot ACS и ACS + ® .Ann Biomed Eng. 2008; 36: 1708. https://doi.org/10.1007/s10439-008-9543-7.
Артикул PubMed Google ученый
Williams LB, Haydel SE. Оценка лекарственного использования глинистых минералов в качестве антибактериальных средств. Int Geol Rev.2010; 52 (7/8): 745–70. https://doi.org/10.1080/00206811003679737.
Артикул PubMed PubMed Central Google ученый
Боултон AJ, Льюис CT, Науманн DN, Midwinter MJ. Гемостатические повязки на догоспитальном этапе при травмах: систематический обзор. Emerg Med J. 2018; 35 (7): 449–57. https://doi.org/10.1136/emermed-2018-207523.
Артикул PubMed Google ученый
Хейрабади Б.С., Мейс Дж.Э., Терразас И.Б., Федык К.Г., Эстеп Дж.С., Дубик М.А. и др. Оценка безопасности новых гемостатических агентов, гранул смектита и марли, покрытой каолином, на модели сосудистой раны у свиньи.J Trauma. 2010. 68 (2): 269–78. https://doi.org/10.1097/TA.0b013e3181c97ef1.
CAS Статья PubMed Google ученый
Хан М.А., Муджахид М. Обзор последних достижений в области композитов на основе хитозана для гемостатических повязок. Int J Biol Macromol. 2019; 124: 138–47. https://doi.org/10.1016/j.ijbiomac.2018.11.045.
CAS Статья PubMed Google ученый
Хошмохабат Х., Пайдар С., Каземи Х.М., Далфарди Б. Обзор агентов, используемых для экстренного гемостаза. Травма Пн. 2016; 21 (1): e26023. https://doi.org/10.5812/traumamon.26023.
Артикул PubMed PubMed Central Google ученый
Чен Х, Ян Й, Ли Х, Ван Х, Тан С., Ли Кью и др. Оценка абсорбируемых кровоостанавливающих средств полиэлектролитных комплексов с использованием карбоксиметилкрахмала и хитозанолигосахарида как in vitro, так и in vivo.Biomater Sci. 2018; 6 (12): 3332–44. https://doi.org/10.1039/c8bm00628h.
CAS Статья PubMed Google ученый
Brown MA, Daya MR, Worley JA. Опыт применения хитозановых повязок в гражданской системе скорой медицинской помощи. J Emerg Med. 2009; 37 (1): 1–7. https://doi.org/10.1016/j.jemermed.2007.05.043.
Артикул PubMed Google ученый
Антифибринолитические средства, аналоги вазопрессина, факторы свертывания крови, гемостатические средства, местные
Автор
Вивиан И Чанг, доктор медицины, магистр медицины Доцент, кафедра педиатрии, отделение детской гематологии-онкологии, Калифорнийский университет, Лос-Анджелес, медицинская школа Дэвида Геффена
Вивиан И Чанг, доктор медицины, магистр медицины, является членом следующие медицинские общества: Американское общество гематологии, Американское общество генетики человека, Американское общество детской гематологии / онкологии
Раскрытие информации: Ничего не раскрывать.
Соавтор (ы)
Марк Э. Грин, доктор медицины Начальник отдела неотложной медицины, экстренной медицины, Gateway Medical System
Марк Э. Грин, доктор медицины, является членом следующих медицинских обществ: Американский колледж врачей неотложной помощи, Американская медицинская ассоциация
Раскрытие информации: Нечего раскрывать.
Лоуренс С. Франкель, доктор медицины Директор отделения детской гематологии / онкологии, Клиника Скотта и Уайта; Профессор кафедры педиатрии, отделение гематологии / онкологии, Медицинский факультет Техасского университета A&M
Раскрытие информации: раскрывать нечего.
Ноа К. Федерман, доктор медицины Директор программы по лечению саркомы костей и мягких тканей у детей, адъюнкт-профессор педиатрии, кафедра педиатрии, кафедра детской гематологии / онкологии, адъюнкт-профессор, кафедра ортопедии, Детская больница Маттел, Калифорнийский университет , Лос-Анджелес, Медицинская школа Дэвида Геффена; Медицинский директор Центра клинических трансляционных исследований, председатель Совета по мониторингу безопасности данных, заместитель председателя Комитета по научному обоснованию, Институт клинических и трансляционных наук (CTSI) в UCLA
Ноа Федерман, доктор медицины, является членом следующих медицинских обществ: Американского общества клинической онкологии, Американское общество детской гематологии / онкологии, Группа детской онкологии, Общество онкологов соединительной ткани, Международный форум по исследованию саркомы Юинга, Альянс по совместным исследованиям саркомы, Общество педиатрических исследований
Раскрытие: нечего раскрывать.
Специальная редакционная коллегия
Мэри Л. Виндл, PharmD Адъюнкт-профессор фармацевтического колледжа Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: нечего раскрывать.
Джеймс Л. Харпер, доктор медицины Доцент кафедры педиатрии отделения гематологии / онкологии и трансплантации костного мозга, заместитель председателя отдела образования педиатрии Медицинского центра Университета Небраски; Адъюнкт-профессор кафедры педиатрии медицинского факультета университета Крейтон; Директор отделения непрерывного медицинского образования Детской мемориальной больницы; Педиатрический директор, Региональный центр лечения гемофилии Небраски
Джеймс Л. Харпер, доктор медицинских наук, является членом следующих медицинских обществ: Американского общества детской гематологии / онкологии, Американской федерации клинических исследований, Совета по педагогическому образованию студентов-медиков в области педиатрии, исследований гемофилии и тромбоза Общество, Американская академия педиатрии, Американская ассоциация исследований рака, Американское общество гематологии
Раскрытие: Ничего не раскрывать.
Главный редактор
Роберт Дж. Арчечи, доктор медицины, доктор философии. Директор Детского центра рака и заболеваний крови, отделение гематологии / онкологии, содиректор Института молекулярной медицины Рона Матрикария, детская больница Феникса; Главный редактор журнала Pediatric Blood and Cancer; Профессор Департамента здоровья детей Медицинского колледжа Университета Аризоны
Роберт Дж. Арчечи, доктор медицинских наук, является членом следующих медицинских обществ: Американской ассоциации содействия развитию науки, Американской ассоциации исследований рака, Американского педиатрического общества, Американского Общество гематологов, Американское общество детской гематологии / онкологии
Раскрытие информации: нечего раскрывать.
Дополнительные участники
Дж. Мартин Джонстон, доктор медицины Адъюнкт-профессор педиатрии медицинского факультета Университета Мерсера; Директор отделения гематологии / онкологии детской больницы Медицинского центра Университета Мемориал; Онколог-консультант / гематолог, Детская больница Святого Дамьена
Дж. Мартин Джонстон, доктор медицинских наук, является членом следующих медицинских обществ: Американская академия педиатрии, Американское общество детской гематологии / онкологии, Международное общество детской онкологии
Раскрытие информации: не раскрывать .
Благодарности
Авторы и редакторы eMedicine выражают признательность предыдущему автору Кэтлин М. Сакамото, доктору медицины, за вклад в написание и разработку этой статьи.
Технология— Protege Biomedical LLC
Обзор технологии:
Ионная гемостатическая минеральная технология Protégé Biomedical ™, также известная как IHM Technology ™, представляет собой запатентованную, специально обработанную смесь полностью натуральных минералов, которая обеспечивает комплексный процесс, который включает 1) набор клеток (флокуляцию) , 2) немедленное начало каскада свертывания фактора XII, 3) сужение сосудов и 4) абсорбция плазмы, которая в совокупности ускоряет свертывание крови, чтобы быстро остановить кровотечение из ран.Он действует на незначительные поверхностные раны и глубокие порезы или колотые раны, в том числе с разрывами артерий.
Как это работает:
IHM Technology ™ работает, воздействуя как на биохимические (растворимые факторы), так и на клеточные части системы гемостаза. Один компонент активирует растворимый фактор XII внутреннего пути коагуляции. Другой компонент вызывает флокуляцию (слипание) клеток крови с ионным притяжением, в результате чего тромбоциты становятся ближе, чем обычно.Поскольку ранней стадией коагуляции является образование агрегатов тромбоцитов, что требует, чтобы тромбоциты были близко друг к другу, флокуляция тромбоцитов с помощью IHM Technology ™ от Protégé Biomedical означает, что общий эффект заключается в ускорении образования сгустка и значительном уменьшении свертывания. время.
Резюме независимого лабораторного исследования:
Исследование было проведено независимой лабораторией для оценки эффективности ионной гемостатической минеральной технологии Protégé Biomedical ™ по сравнению с некоторыми из наиболее часто используемых гемостатических продуктов.Действие компонентов Protégé, по отдельности и в комбинации, на образование тромбов было изучено с помощью импедансной агрегометрии (IA). IA измеряет образование сгустка, отслеживая изменение импеданса образца крови с течением времени после обработки кровоостанавливающим средством. По мере образования сгустка и увеличения массы к нему за счет привлечения большего количества тромбоцитов и эритроцитов (эритроцитов) сопротивление образца крови увеличивается. Чем быстрее увеличивается импеданс, тем быстрее образуется сгусток.Кроме того, чем выше конечный импеданс образца, тем массивнее и прочнее сгусток.
Рисунок 1:
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.



 Препарат безопасен и эффективен для борьбы с геморрагическими осложнениями у больных гемофилией, а также для купирования кровотечений другой этиологии.
Препарат безопасен и эффективен для борьбы с геморрагическими осложнениями у больных гемофилией, а также для купирования кровотечений другой этиологии.
 Понимание этих различий важно для принятия наиболее подходящих и экономически эффективных решений относительно их использования.
Понимание этих различий важно для принятия наиболее подходящих и экономически эффективных решений относительно их использования.