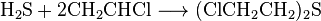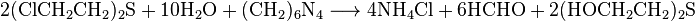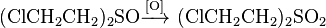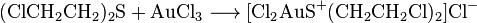Иприт | Info-Farm.RU
Иприт, бис (2-хлороетил) сульфид — сульфуроорганична соединение состава (ClCH 2 CH 2)2 S. Иприт впервые был получен немецким химиком Виктором Меером в 1886 году. Этому предшествовали работы химиков Деспре (1822), Немана (1859), Гутмана (1860), которые исследовали данный класс соединений, однако не выделили ее в чистом виде.
Чистый иприт представляет собой бесцветную маслянистую веществом без запаха (технический иприт имеет чесночно-горчичный запах и желто-коричневый цвет). Плохо растворяется в воде и неограниченно — во многих органических растворителях.
Во времена Первой мировой войны иприт применялся как боевое отравляющее вещество кожно-нарывного действия. Международное обозначение иприта как химического оружия — HD. Боеприпасы с ипритом в Германии сказывались желтым крестом (он входит в состав боевой смеси желтый крест, нем. Gelbkreuz), в США кодируются двумя зелеными кольцами.
В 1993 году, в результате подписания Конвенции о химическом оружии, использование иприта как химического оружия было запрещено. Его включили в список 1, который регламентирует производство и оборот опасных веществ.
Срок иприт происходит от названия бельгийского города Ипр, вблизи которого в ночь на 13 июля 1917 немецкими войсками впервые применен данное вещество как химическое оружие.
Токсическое действие иприта заключается в повреждении глаз, кожи, дыхательных путей. Симптомы отравления проявляются со скрытым периодом в 2:00, но при жаркой погоде и влажной кожи они появляются сразу. Следствием контакта с веществом появление пузырьки с желтоватой жидкостью, которые долго заживают и оставляют рубцы. При концентрации иприта в воздухе 0,03 мг / л смерть наступает в течение 2-5 минут.
Вещество быстро проникает в строительные материалы, поглощается текстилем, резиной, бумагой, поэтому отравления возможно и при контакте с зараженными предметами.
Физические свойства
Чистый иприт представляет собой бесцветную маслянистую жидкость со слабым запахом касторки, технический продукт имеет цвет от желтого до темно-коричневого и резкий запах (чеснока или горчицы). Плотность паров по воздуху составляет 3,5. Давление пара при 20 ° С — 0,072 мм рт. ст.
Температура плавления чистого вещества составляет 14,5 ° C, а у технического иприта, вследствие наличия примесей, она несколько ниже. Для предотвращения замерзания во время Первой мировой войны в него добавляли хлоропикрин, хлоробензен, Тетрахлорметан.
Плохо растворяется в воде (менее 1%), неограниченно растворяется в маслах, жирах, бензине, керосине, ацетоне, Тетрахлорметан, спиртах, хлоропикрини. Смешивается с другими ядовитыми веществами: етилдихлороарсином, фенилдихлороарсином, люизитом.
Летучесть иприта: 75 мг / м³ при 0 ° C (твердый), 610 мг / м³ при 20 ° C (жидкий), 2 860 мг / м³ при 40 ° C (жидкий).
Не вызывает коррозии при хранении его в алюминиевых контейнерах; латунь быстро корродирует при температуре 65 ° C. Во влажном воздухе технический иприт с примесями, которые образуются в результате его разложения (сероводород, хлороводород, этилен), вызывает коррозию стали.
Получение
Существует три основных способа синтеза иприта: с оксиран (оксида этилена), этилена и винилхлорида.
Синтез с оксиран проводится при температуре 80 ° C в две стадии: сульфированием с помощью сероводорода или гидросульфидов для получения тиодигликолю, а впоследствии — хлорированием соединения:
После вакуумной дистилляции получают иприт с чистотой 95%. Выход синтеза составляет 90%. Этот способ впервые был проведен немецким химиком В. Меером в 1886 году.
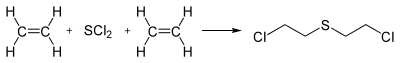
Синтез иприта из этилена и хлоридов серы разрабатывался во времена Первой мировой войны, а после ее окончания. Преобладающим способом получения является реакция с SCl 2:
Хлорид серы (II) обычно имеет примеси дихлорополисульфидив (S 2 Cl 2, S 3 Cl 2, S 5 Cl 2), поэтому конечный продукт может быть загрязнен хлороетилполисульфидамы (ClCH 2 CH 2)2S x. Имеющийся в реакционной смеси свободный хлор может образовывать полихлорированные примеси.
Получение иприта с винилхлорида является наиболее целесообразным, учитывая легкость протекания реакции — она происходит уже при комнатной температуре (15-25 ° C):
Как инициаторы реакции используют органические перекиси и ультрафиолетовое излучение. Реакция в течение 10 минут с выходом продукта около 75%. При использовании вместо сероводорода 1-меркапто-2-хлороетану HSCH
Химические свойства
Иприт медленно гидролизуется с образованием соляной кислоты и тиодигликолю:
Он слабо растворяется в воде, поэтому может не испытывать гидролиза длительное время. Процесс гидролиза ускоряют повышение температуры и присутствие щелочей.
Одной из важнейших реакции является действие уротропина при гидролиза: продуктом взаимодействия создаваемой соляной кислоты с уротропином является формальдегид, который способствует заживлению ран:
При действии сильных окислителей (перманганата калия, хроматных кислоты, азотной кислоты, гипохлоритов), сульфид окисляется до сульфоксида, а затем — в сульфона:
Несмотря на то, что продукты окисления также являются ядовитыми веществами, этот способ применяется для дегазации, потому как они являются кристаллическими веществами и не оказывают воздействия на кожу.
Подобно другим тиоетерив, иприт способен образовывать с солями металлов сульфониеви соединения. Образуемые комплексы имеют характерную окраску, а иногда и низкую растворимость, поэтому иногда применяются в аналитической химии. Чаще реакция проводится с галогенидами тяжелых металлов: йодидами и хлоридами меди, цинка, титана, платины, ауру:
Токсичность
Иприт действует на организм человека или ингаляционная и контактный яд: капли и аэрозоли иприта поражают дыхательные пути, кожу, глаза.
Вещество способно проникать в организм через кожу. Эта способность зависит от температуры окружающей среды: при 21-23 ° C проникновения составляет 1,4 · 10 -3 мг / (см² · мин), при высоких — около 2,7 · 10 -3 мг / (см² · мин). Проникновение в организм иприта в количестве 6 · 10 -3 в половине случаев вызывает появление волдырей. Образование небольших эритем происходит при дозе 0,01 мг / см кожи, крупных — при дозе 0,5 мг / см. Глаза поражаются даже ипритом небольшой концентрации: его действие при концентрации 1,2 · 10 -3 мг / л в течение 45 минут вызывает воспаление глаз, спазмы век, светобоязнь, которые продолжаются до 4 недель.
Действие иприта концентрацией 0,03 мг / л в течение 2-5 минут является летальной. Концентрация 0,01 мг / л опасна в течение 15 минут и ведет к сильным повреждений глаз, кожи.
Контакт иприта за кожей первоначально не вызывает никаких неприятных ощущений. В течение первых 2-5 минут он проникает сквозь кожу, далее растворяется в подкожном жире и впоследствии, через 20-30 минут, полностью всасывается и попадает в кровь. После всасывания наступает скрытый период продолжительностью от 2:00 до суток в зависимости от дозы, температуры и влажности воздуха, структуры и влажности кожи. В жаркую погоду, при горячей, влажной кожи или нежных её участков период скрытого действия значительно сокращается и может быть почти отсутствующим.
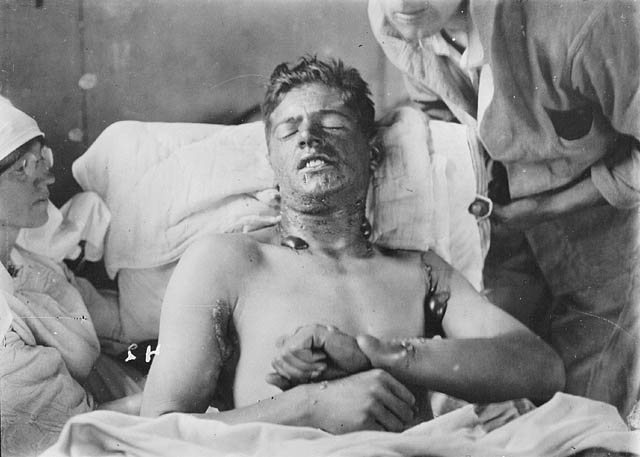
Первые признаки поражения после окончания периода скрытого действия проявляются в виде зуда, жжения и покраснения кожи (эритемы) в местах контакта с жидким или газообразным ипритом. Кожа натягивается, становится сухой и теплой. При небольших дозах эти явления через несколько суток проходят. При более высоких дозах развивается отечность, по краям которой через 16-30 часов после контакта с ядом появляется множество мелких пузырьков. В дальнейшем они сливаются в большие или один большой пузырь с бесцветной или желтоватой жидкостью. Пузырьки прорываются и на коже образуются болезненные ипритни язвы, заживление которых может продолжаться более 2 месяцев. Вторичная инфекция может привести к гнойным воспалениям пораженных участков кожи. На их месте остаются рубцы.
Защита
Основной защитой от иприта, в частности, глаз, лица и дыхательных путей, является противогаз. После попадания на хлопчатобумажную одежду иприт за 3:00 полностью пропитывает его, что может в дальнейшем повлечь дополнительные поражения. Для предотвращения попадания соединения на одежду и под него, пользуются специальными защитными костюмами.
Для обработки кожи (устранение незначительных капель иприта), одежды или предметов, которые контактировали с ипритом, применяют окислители и агенты хлорирования (гипохлориты, хлорная известь, хлороамиды).
Изображения по теме
1917 год — впервые на поле боя применен иприт — История — EADaily
12 июля 1917 года, у бельгийского города Ипр англо-французские войска были обстреляны немецкими минами, содержавшими маслянистую жидкость. Так, впервые Германией было совершено боевое применение иприта. В результате этой химатаки 87 военнослужащих стран Антанты погибли, еще 2490 получили поражения различной тяжести.
Первая мировая война после довольно динамичного начала быстро превратилась в «окопное» противостояние. На Западном фронте противоборствующие армии зарылись в землю, ощетинились минными полями и проволочными заграждениями. Наступательные операции стали совершенно неэффективными и обе стороны оказались в патовой ситуации. В результате, для прорыва обороны противника стали применять химическое оружие.
Применение ядовитых газов в Первой мировой войне было крупной военной инновацией. Диапазон действия отравляющих веществ шёл от просто вредоносных (таких, как слезоточивый газ) до смертельно ядовитых, как хлор и фосген. Химическое оружие является одним из основных в Первой мировой войне и в общей сложности на всём протяжении XX века. Смертельный потенциал газа был ограничен — лишь 4% смертей от общего количества поражённых. Тем не менее, доля смертельных случаев была высокой, а газ оставался одной из главных опасностей для солдат. Впоследствии появились средства защиты от газовых атак, в связи с чем, на более поздних этапах войны стала снижаться эффективность его использования, и он почти вышел из оборота.
Химическое оружие стало применяться с самого первого дня Первой мировой войны. Вопреки расхожему убеждению пионерами химических атак стали вовсе не немцы, а французы, которые в августе 1914 года применили против немецких солдат гранаты со слезоточивым газом (этилбромацетат). Однако запасы этилбромацетата у союзников быстро подошли к концу.
Первым же смертельным газом, использованным немецкими военными, был хлор — побочный продукт от производства красителей. 22 апреля 1915 года немецкая армия распылила 168 тонн хлора около реки Ипр. После битвы на Ипре отравляющие газы были применены Германией ещё несколько раз: 24 апреля против 1-й канадской дивизии, 2 мая около «Фермы-мышеловки», 5 мая против британцев и 6 августа против защитников русской крепости Осовец.
Иприт же был первым отравляющим газом, созданным специально для убийства людей — это жидкий отравляющий горчичный газ кожно-нарывного действия. Иприт обладает отчетливо выраженным местным действием — он поражает глаза и органы дыхания, желудочно-кишечный тракт и кожные покровы. Всасываясь в кровь, он проявляет и общеядовитое действие. Иприт поражает кожные покровы при воздействии, как в капельном, так и в парообразном состоянии. От капель и паров иприта обычное летнее и зимнее армейское обмундирование не защищает кожные покровы, как и практически любые виды гражданской одежды.
Первое применение иприта состоялось в ночь с 12 на 13 июля 1917 года под все тем же многострадальным городом Ипр, который и дал название газу. Поражения различной тяжести получили 2490 человек, из которых 87 скончались.
Ради справедливости стоит сказать, что под самый конец войны иприт успели применить и британцы. В Англии быстро расшифровали его формулу, но наладить производство нового отравляющего вещества удалось лишь в 1918 году, из-за чего использовать иприт в военных целях удалось лишь в сентябре 1918 года (за 2 месяца до перемирия).
Иприт — Википедия
У этого термина существуют и другие значения, см. Lost.| Иприт | |||
|---|---|---|---|
| |||
| Систематическое наименование | Иприт, горчичный газ, b-дихлордиэтилсульфид, 2,2′-дихлордиэтиловый тиоэфир, 2,2′-дихлордиэтилсульфид, 1-хлор-2-(2′-хлорэтилтио)-этан | ||
| Сокращения | B | ||
| Хим. формула | C4H8Cl2S | ||
| Состояние | жидкость | ||
| Молярная масса | 159 г/моль | ||
| Плотность | 1,280 г/см3 (15 °C) | ||
| Температура | |||
| • плавления | 14,5 °C | ||
| • кипения | 217 °C | ||
| Растворимость | |||
| • в воде | 0,05 % | ||
| Рег. номер CAS | 505-60-2 | ||
| PubChem | 10461 | ||
| Рег. номер EINECS | 684-527-7 | ||
| SMILES | |||
| InChI | |||
| RTECS | WQ0900000 | ||
| ChEBI | 25434 | ||
| Номер ООН | 2810 | ||
| ChemSpider | 21106142 | ||
| ЛД50 | 0,7 мг/кг (человек, перорально). | ||
| Токсичность | чрезвычайно токсичен, обладает сильным кожно-нарывным действием. | ||
| Пиктограммы ECB | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
Ипри́т (или горчичный газ, синонимы: 2,2′-дихлордиэтиловый тиоэфир, 2,2′-дихлордиэтилсульфид, 1-хлор-2-(2′-хлорэтилтио)-этан, «Lost») — химическое соединение с формулой S(CH2CH2Cl)2. Боевое отравляющее вещество кожно-нарывного действия, по механизму действия — ОВ цитотоксического действия, алкилирующий агент.
Был синтезирован Сезаром Депре (англ.) в 1822 году и (независимо) британским учёным Фредериком Гутри (англ.) в 1860 году[1].
Первоначально веществу было присвоено название Lost — сокращение от фамилий учёных Wilhelm Lommel и Wilhelm Steinkopf, создавших в 1916 году метод его выработки в промышленных масштабах для Германской имперской армии[2].
Впервые иприт был применён Германией 12 июля 1917 года против англо-французских войск, которые были обстреляны минами, содержавшими маслянистую жидкость, у бельгийского города Ипра (откуда и произошло название этого вещества)[3].
Кроме того, иприт применялся в итало-эфиопскую войну 1935-1936 годов.
В декабре 1943 года в результате налёта немецкой авиации на город Бари был потоплен американский транспорт «Джон Харви», перевозивший бомбы, начинённые ипритом (см. Бомбардировка Бари). В результате утечки газа большое количество американских моряков и местных жителей получили отравления, в том числе со смертельным исходом[4].
Сернистый иприт.
Сернистый иприт относится к группе кожно — нарывных отравляющих
веществ и прошел боевую проверку на полях сражений первой мировой
войны, войны Италии в Абисиннии в 1936 году и в войне Японии и против
Китая в период 1937 — 1941 годов.
Впервые сернистый иприт был применен немцами в ночь на 13 июня 1917
года в долине реки Ипр в Западной Бельгии. Боевая эффективность
применении иприта в годы первой мировой войны оценивается 400 000
пораженных при расходе 12 000 тонн отравляющего вещества.
Несмотря на появление нервно-паралитических ОВ , сернистый иприт
остается одним из основных отравляющих веществ, является табельным ОВ
в армии США.
Иприт был открыт Депре в 1822 году. Впервые в чистом виде был получен и
всесторонне изучен в Германии в 1896 году В. Майером совместно с Н.Д.
Зелинским.
1. Физические и химические свойства сернистого иприта. Физические свойства.
Технический иприт — темно коричневая жидкость с запахом чеснока или
горчицы, ощущается по запаху уже в концентрации 0,001 — 0,002 мг/л;
химически чистый (перегнанный) иприт — прозрачная тяжелая маслянистая
жидкость, практически без запаха или со слабым запахом касторового масла
Ткип.-+217° , Тзам.= +14,4° , летучесть С мак(20°) = 0,6 мг/л.
Высокая температура замерзания делает затруднительным применение
иприта в зимнее время.
Малая летучесть позволяет судить о его большой стойкости на местности в
капельно — жидком состоянии, и в тоже время, затрудняет создание
поражающих концентраций в паровой фазе, т.к. полевые концентрации в
десятки раз меньше максимальных.
Иприт в 5,4 раза тяжелее воздуха, поэтому облако паров и тумана будет
хорошо следовать за неровностями рельефа, распространяясь в основном по
низинам, оврагам.
Хорошо поглощаясь волокнистыми (ткани) и пористыми (бетон, грунт,
древесина) материалами, иприт надолго заражает их.
Удельный вес 1,27. Растворимость в воде невелика 0,05% при 20°С. Поэтому
капли иприта при попадании в воду будут долгое время находиться на дне
водоемов, надолго заражая их.
Вязкость иприта в 5 раз больше вязкости воды и поэтому капли ОВ будут
хорошо прилипать к любым, в том числе и вертикальным поверхностям. А
хорошая растворимость в органических растворителях, жирах, маслах
позволяет сделать вывод о том, что иприт будет надежно заражать
замасленные поверхности техники и оружия.
При попадании на зеленую растительность сернистый иприт вызывает ее побурение, что очень важно для распознавания зараженных участков местности при ведении химической разведки. Подводя итоги физическим свойствам ,следует отметить:
Перегнанный иприт обладает большой стойкостью в капельножидком состоянии;
Способен заражать любые поверхности и впитываться вглубь материалов;
Имеет различные боевые состояния, вследствие чего его можно применять с помощью любых средств доставки к цели;
В зимнее время иприт должен применяться в смесях, понижающих его температуру замерзания.
Химические свойства.
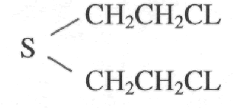
Химическое название ВВ’ — дихлордиэтилсульфид.
Это вещество является одновременно тиоэфиром и галоидпроизводным предельных углеводородов. Поэтому для иприта характерны как реакции нуклеофильного замещения галоида, так и реакции окисления коордиционно — ненасыщенного атома серы,
Реакция гидролиза.
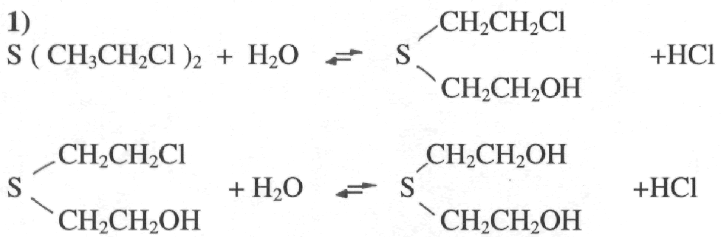
(Тиодигликоль)
Реакция протекает очень медленно. Влага воздуха, а так же дождевые капли не приводят к завершению гидролиза в течение многих часов. Установлено, что в водоемах гидролизуется только растворенная часть иприта, а реакция на разделе фаз, вода — капля иприта, не идет. Поэтому воздействие влаги не будет влиять на стойкость иприта на местности, а непроточные водоемы будут заражаться на практически неопределенное время. Кипячение ос щелочами обеспечивает полное разрушение иприта в течение одного часа.

В результате реакции не возникает кислых или щелочных продуктов, что надежно защищает тару от ржавления. С водными или лучше спиртовыми растворами сульфидов щелочных металлов сернистый иприт легко реагирует с образованием твердого дитиана.
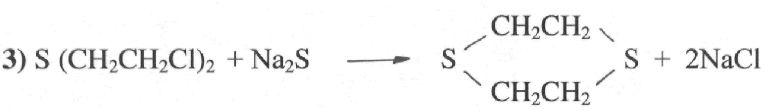
Реакция кипячения 5% раствором сульфида натрия применяется для дегазации тары.
Реакция алкилирования.
Иприт является достаточно сильным алкилирующим агентом, замещающим в соединениях подвижные функциональные группы -NH2 , -SH, -ОН и другие.
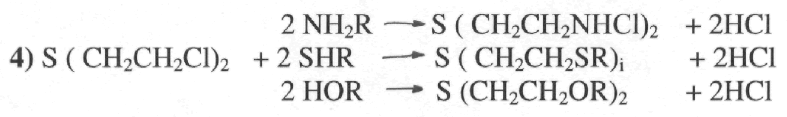
В обычных условиях эта реакция требует нагревания и идет в органических
растворителях,
В физиологической среде (живой организм) активность алкирующего
действия иприта значительно возрастает, особенно при действии на белковые
молекулы. А так как белковые молекулы входят в состав каждой клетки
живой ткани, иприт называют «клеточным ядом». Реакция алкилирования
белков является причиной токсического действия сернистого иприта,
Реакция окисления.
Окисление иприта может идти с образованием различных продуктов.
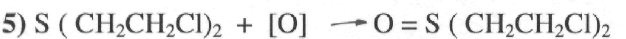
( ββ ‘ — Дихлордиэтилсульфоксид)
Продукт реакции образуется при мягких условиях окисления, при обычных или низких температурах, под воздействием разбавленных растворов обычных окислителей. Это твердое кристаллическое вещество кожно-нарывным действием не обладает. Реакция применяется для дегазации иприта солями гипохлорита кальция, хлораминами и др.
При более жестких условиях, при нагревании с избытком окислителей при окислении сильными окислителями в кислой среде.
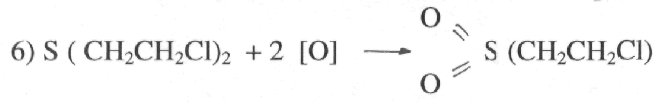
Продукт реакции — дихлордиэтилсульфон он обладает столь же сильным
кожно-нарывным действием, как иприт, практически в реакциях дегозации
такой продукт может образоваться при неправильном приготовлении
дегазирующего раствора — №1.
При еще более энергичном окислении происходит расщепление молекулы
иприта.
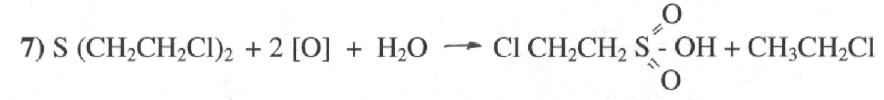
( β — хлорэтансульфокислота)
Реакция характерна для разложения иприта при дегазации его в лаборатории сильными окислителями (конц. HNO3).
8) При нагревании иприта в воздухе.

Иприт горит красным коптящим пламенем. Сжигание можно осуществить не ближе 5-6 км от населенных пунктов и расположения войск, т.к. значительные количества иприта при этом испаряются и образуют мощное облако паров. Реакция применяется для уничтожения иприта и для дегазации местности с высокой травой, зараженной ипритом.
Реакция хлорирования.
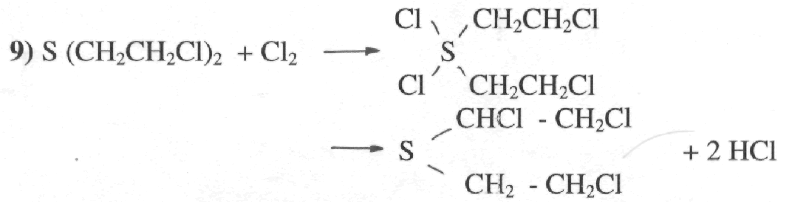
В качестве хлорагентов используются такие, как вещества ДТ-2 (С6Н5SО2
NCl2) и ДТ-6 (C3N6Cl6).
Продукты реакции не обладают кожно-нарывным действием. Реакция
положена в основу дегазации вооружения и боевой техники.
В присутствии влаги процесс сопровождается одновременным окислением и
хлорированием молекулы иприта.
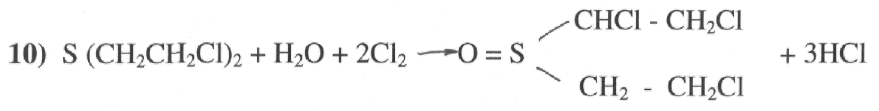
Окисление обеспечивает быструю и надежную дегазацию иприта при любых температурах.
Реакция присоединения.
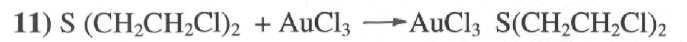
(красно-желтый цвет)
Реакция присоединения используется для индикации иприта в лабораториях. Чувствительность — 4мг в литре раствора с хлористыми солями тяжелых металлов Pt C12 , AuC13 , HgC12 , CuC12 , HgCl и др. Иприт также образует прочные комплексные продукты, в большинстве нерастворимых в воде.
Отношение к металлам.
Чистый иприт при обычной температуре не действует на железо, медь, аммоний, бронзу, олово, и цинк.
Молекулярная масса иприта
Молярная масса of C4H8Cl2S = 159,07732 г / моль
Перевести граммы иприта в моль или моль иприта в граммы
Расчет молекулярной массы:
12,0107 * 4 + 1,00794 * 8 + 35,453 * 2 + 32,065
| Элемент | Условное обозначение | Атомная масса | Количество атомов | Массовый процент |
| Хлор | Класс | 35.453 | 2 | 44,573% |
| Водород | H | 1,00794 | 8 | 5,069% |
| Углерод | С | 12.0107 | 4 | 30,201% |
| Сера | S | 32.065 | 1 | 20,157% |
В химии вес формулы — это величина, вычисляемая путем умножения атомного веса (в единицах атомной массы) каждого элемента в химической формуле на количество атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов вместе.
Формула веса особенно полезна при определении относительного веса реагентов и продуктов в химической реакции. Эти относительные веса, вычисленные по химическому уравнению, иногда называют весами по уравнениям.
Атомные веса, используемые на этом сайте, получены от NIST, Национального института стандартов и технологий. Мы используем самые распространенные изотопы. Вот как рассчитать молярную массу (среднюю молекулярную массу), которая основана на изотропно взвешенных средних.Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов. Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
Часто на этом сайте просят перевести граммы в моль. Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать. Причина в том, что на конверсию влияет молярная масса вещества. Этот сайт объясняет, как найти молярную массу.
Если формула, используемая при вычислении молярной массы, является молекулярной формулой, вычисленная формула веса является молекулярной массой. Массовое процентное содержание любого атома или группы атомов в соединении можно вычислить, разделив общий вес атома (или группы атомов) в формуле на вес формулы и умножив на 100.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные веса и вычислить молекулярную массу вещества.
Определение молярной массы начинается с единиц граммов на моль (г / моль). При расчете молекулярной массы химического соединения он говорит нам, сколько граммов содержится в одном моль этого вещества. Вес формулы — это просто вес в атомных единицах массы всех атомов в данной формуле.
.Перевести моль иприта в граммы
›› Перевести моль иприта в грамм
Пожалуйста, включите Javascript использовать конвертер величин
›› Дополнительная информация в конвертере величин
Сколько молей горчичного газа в 1 грамме?
Ответ: 0,0062862512393344.
Мы предполагаем, что вы конвертируете моль горчичного газа в грамм .
Вы можете просмотреть более подробную информацию о каждой единице измерения:
молекулярная масса иприта или
грамм
Молекулярная формула иприта — C4H8Cl2S.
Основной единицей СИ для количества вещества является моль.
1 моль равен 1 моль горчичного газа, или 159,07732 грамма.
Обратите внимание, что могут возникнуть ошибки округления, поэтому всегда проверяйте результаты.
Используйте эту страницу, чтобы узнать, как преобразовать количество молярного горчичного газа в грамм.
Введите свои числа в форму для преобразования единиц!
›› Таблица перевода моль горчичного газа в
граммов1 моль горчичного газа в граммах = 159,07732 грамма
2 моля горчичного газа в граммах = 318.15464 грамма
3 моля горчичного газа в граммах = 477,23196 граммов
4 моля горчичного газа в граммах = 636,30928 граммов
5 моль горчичного газа в граммах = 795,3866 грамма
6 моль горчичного газа в граммах = 954,46392 грамма
7 моль горчичного газа в граммах = 1113,54124 грамма
8 моль горчичного газа в граммах = 1272,61856 граммов
9 моль горчичного газа в граммах = 1431,69588 граммов
10 моль горчичного газа в граммах = 1590,7732 грамма
›› Хотите другие единицы?
Вы можете выполнить обратное преобразование единиц измерения из граммы иприта в моль, или введите другие единицы для преобразования ниже:
›› Общее количество преобразований веществ
моль горчичного газа на миллимоль
моль горчичного газа на децимоль
моль горчичного газа на атом
моль горчичного газа на наномоль
моль горчичного газа на сантимоль
моль горчичного газа на моль
моль горчичного газа на молекулу
моль горчичного газа на километр
моль иприт в пикомоле
моль иприт в микромоле
›› Подробная информация о расчетах молекулярной массы
В химии вес формулы — это величина, вычисляемая путем умножения атомного веса (в единицах атомной массы) каждого элемента в химической формуле на количество атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов вместе.
Определение молярной массы начинается с единиц граммов на моль (г / моль). При расчете молекулярной массы химического соединения он говорит нам, сколько граммов содержится в одном моль этого вещества. Вес формулы — это просто вес в атомных единицах массы всех атомов в данной формуле.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные веса и вычислить молекулярную массу вещества.
Если формула, используемая при расчете молярной массы, является молекулярной формулой, вычисленная формула веса является молекулярной массой.Весовой процент любого атома или группы атомов в соединении можно вычислить, разделив общую массу атома (или группы атомов) в формуле на вес формулы и умножив на 100.
Атомные веса, используемые на этом сайте, получены от Национального института стандартов и технологий NIST. Мы используем самые распространенные изотопы. Вот как рассчитать молярную массу (среднюю молекулярную массу), которая основана на изотропно взвешенных средних. Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов.Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
Формула веса особенно полезна при определении относительного веса реагентов и продуктов в химической реакции. Эти относительные веса, вычисленные по химическому уравнению, иногда называют весами по уравнениям.
Часто на этом сайте просят перевести граммы в моль. Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать.Причина в том, что на конверсию влияет молярная масса вещества. Этот сайт объясняет, как найти молярную массу.
›› Метрические преобразования и др.
ConvertUnits.com предоставляет онлайн калькулятор преобразования для всех типов единиц измерения. Вы также можете найти метрические таблицы преобразования для единиц СИ. в виде английских единиц, валюты и других данных. Введите единицу символы, сокращения или полные названия единиц длины, площадь, масса, давление и другие типы.Примеры включают мм, дюйм, 100 кг, жидкая унция США, 6 футов 3 дюйма, 10 стоун 4, кубический см, метры в квадрате, граммы, моль, футы в секунду и многое другое!
.Горчичный газ — молекула месяца — июнь 1998 г.
горчичный газ — молекула месяца — июнь 1998 — HTML версияГорчичный газ — это общее название 1,1-тиобис (2-хлорэтан), боевого химического агента, который, как полагают, впервые был использован около Ипра во Фландрии 12 июля 1917 года. Его химическая формула — Cl-CH 2 -CH 2 -S-CH 2 -CH 2 -Cl
Его другие названия включают H, иприт, серную горчицу и Kampstoff Lost , но название Горчичный газ стал более широко использоваться, поскольку считается, что нечистый «агент качества» имеет запах, похожий на запах горчицы, чеснока или хрена.(8) В чистом виде он фактически не имеет ни запаха, ни цвета. (6)
Он был синтезирован намного раньше, чем его первое зарегистрированное использование, человеком по имени Фредерик Гатри в 1860, который прореагировал этиленом с Cl 2 и заметил его токсическое воздействие на свою кожу. (1) Воздействие горчичного газа включает покраснение и образование пузырей на коже, а при вдыхании также вызывает образование пузырей на слизистой оболочке легких, вызывая хронические нарушения или, в худшем случае, смерть.Воздействие высоких концентраций будет поражать роговицы глаз, в конечном итоге делая жертву слепой. (6)
Любая влажная область тела особенно восприимчива к воздействию иприта, потому что, хотя он лишь слабо растворяется в воде, что затрудняет смывание, гидролиз (расщепление соединения водой) происходит быстро и происходит свободно.
Реакция идет по следующему пути:
горчичный газ
| нуклеофильная атака углерода
| сульфидом
В
промежуточная соль сульфония
| атака водой
|
В
горчичный + HCl
| атака водой
|
В
тиодигликоль + HCl
| внутреннее перемещение
|
В
1,4 тиоксан + HCl
Здесь важно отметить, что не только горчичный газ и полу-иприт являются везикантами (кожа волдырей), но в результате реакции гидролиза также образуются три молекулы HCl, который сам по себе является раздражителем кожи.
Несмотря на легкость гидролиза, горчичный газ в твердой форме может сохраняться под землей. на срок до десяти лет. Это связано с тем, что в среде, где концентрация воды относительно низкая, путь реакции может протекать один раз, тиодигликоль образуется с использованием большей части воды, доступной на твердой поверхности, но затем промежуточное соединение сульфония реагирует с этим вместо другого молекулы воды, так как концентрация молекул воды на основной поверхности теперь ниже, чем концентрация тиодигликоля.При этом образуются стабильные, нереакционноспособные соли сульфония, которые образуют защитный слой вокруг сыпучего материала и, следовательно, предотвращают дальнейшую реакцию. (8)
| Горчичный газ | Горчичный N |
|---|---|
Горчичный газ является особенно смертельным и обеззараживающим ядом, но его реальная опасность, когда он впервые был использован во время Первой мировой войны, по сравнению с другими боевыми химическими агентами того времени, заключалась в том, что он мог проникать через все защитные материалы и маски, которые у них были в наличии. время.(5) В последние годы было обнаружено, что уретан устойчив к иприту, а также обладает такими преимуществами, как прочность, устойчивость к росту порезов и стабильность в широком диапазоне температур. (9)
Одна из причин того, что воздействие горчичного газа необходимо предотвращать, а не лечить, заключается в том, что детоксикация довольно сложна из-за его нерастворимости, и что действие горчичного газа разрушительно — в основном, если вдыхание самого горчичного газа не происходит. убить вас, очень вероятно, что это вызовет рак в более позднем возрасте.(7) Во время Первой мировой войны врачи были практически беспомощны в лечении жертв, поскольку единственным средством детоксикации было окисление гипохлоритными отбеливателями — NaOCl — и (CaCOCl — ) 2 (суперхлорированный отбеливатель) были наиболее эффективными. обычно используется. (8)
Детоксикация больше не является такой проблемой, так как в последние годы, которые весьма эффективны. Было обнаружено, что как амины серы (сера, растворенная в аминах) (4), так и монопероксифталат магния (10) являются достаточно хорошими дезактивирующими средствами, но лучшим методом является использование пероксикислот (RC (O) OOH, где R = C 7 H 15 , C 9 H 19 , C 11 H 23 , C 13 H 27 ), поскольку они вступают в реакцию в течение нескольких секунд, и эта скорость реакции может быть увеличена далее с использованием катализатора.(11)
Горчичный газ как противораковое средство
Горчичный газ всегда считался особенно опасным ядом, приводящим к болезненной и часто медленной смерти, и, по иронии судьбы, хотя он и вызывает рак, его также использовали для его лечения. Это было в 1919 году, вскоре после первого применения горчичного газа, когда было отмечено, что у жертв было низкое количество кровяных телец, потому что горчичный газ атаковал белые кровяные тельца и аплазию костного мозга (разрушение).
Затем в 1946 году начались исследования, чтобы показать, что азотные иприты (отличающиеся от иприта только наличием атома азота, а не серы) снижают рост опухоли у мышей с помощью механизма, при котором 2 нити ДНК связаны молекулой. азотной горчицы.
Горчичный газ (серный горчичный) Азотная горчица
CH 2 -CH 2 -Cl CH 2 -CH 2 -Cl
/ /
S N
\ \
CH 2 -CH 2 -Cl CH 2 -CH 2 -Cl
Уже было показано, что чувствительность костного мозга мышей к горчичному газу аналогична чувствительности человека, и поэтому повторные исследования привели к клиническим испытаниям, и азотный иприт стал частью современной химиотерапевтической терапии, в основном используемой в качестве лекарства от рак лимфатической железы — болезнь Ходжкина.(3)
Ссылки:
- Жак Дж. Первые жертвы иприта. Новый химический журнал . 15 p3-4 (1991).
- Ruff, B. Что такое горчичный газ?
- Leinhard, J.H. Двигатели нашей Изобретательности № 1190: Горчичный газ.
- Гу У. и Пэн З. Система обеззараживания для быстрого уничтожения горчичного газа. Труды Международного симпозиума по защите от боевых отравляющих веществ, 3-й .(PB 89-255379) p379-330 (1989).
- Талле К. Отравление горчичным газом.
- Агентство регистрации токсичных веществ и заболеваний.
- ChronicIllNet
- Mitretek Systems. Химия H (горчица).
- MacPhee, K.E. И Бартон, Дж. Л. Эластомерный материал на основе полиуретана. Патент США 4 689 385 (Cl 528-58) C08G18 / 327 25 августа 1987 г. Заявка CA 499 244 8 января 1986 г.
- Лев, К. и др. . Новые дезинфицирующие средства. Действие моноперфталата магния (MPPM) на некоторые фосфорорганические или сероорганические инсектициды и боевые отравляющие вещества. Фосфор, сера, кремний и родственные элементы 56 (1-4) p213-217 (1991).
- Лев К. и др. . Новые реагенты для дезактивации. Легкое и мягкое уничтожение некоторых инсектицидов и боевых агентов пероксикислотами. Бюллетень обществ химикатов Бельгии 99 (2) стр. 127-133 (1990).
Эта страница была названа Молекулой месяца за июнь 1998 г. и с тех пор не обновлялась.
Вернуться на страницу «Молекула месяца». [DOI: 10.6084 / m9.figshare.5271895]
.Перевести граммы иприта в моль
›› Перевести граммы горчичного газа в
мольПожалуйста, включите Javascript использовать конвертер величин
›› Дополнительная информация в конвертере величин
Сколько граммов горчичного газа в 1 моль?
Ответ — 159.07732.
Мы предполагаем, что вы конвертируете граммов горчичного газа и моль .
Вы можете просмотреть более подробную информацию о каждой единице измерения:
молекулярная масса иприта или
моль
Молекулярная формула иприта — C4H8Cl2S.
Основной единицей СИ для количества вещества является моль.
1 грамм горчичного газа равен 0,0062862512393344 моля.
Обратите внимание, что могут возникнуть ошибки округления, поэтому всегда проверяйте результаты.
Используйте эту страницу, чтобы узнать, как переводить между граммами горчичного газа и моль.
Введите свои числа в форму для преобразования единиц!
›› График перевода граммов горчичного газа в
моль1 грамм горчичного газа на моль = 0,00629 моль
10 граммов иприта на моль = 0.06286 моль
50 граммов иприта на моль = 0,31431 моль
100 граммов горчичного газа на моль = 0,62863 моль
200 граммов горчичного газа на моль = 1,25725 моль
500 граммов иприта на моль = 3,14313 моль
1000 граммов горчичного газа на моль = 6.28625 моль
›› Хотите другие единицы?
Вы можете выполнить обратное преобразование единиц измерения из моль иприта в граммы, или введите другие единицы для преобразования ниже:
›› Общее количество преобразований веществ
граммов горчичного газа на наномоль
граммов горчичного газа на атом
граммов горчичного газа на микромоль
граммов горчичного газа на пикомоль
граммов горчичного газа на сантимоль
граммов горчичного газа на децимоль
граммов горчичного газа на киломоль
граммов горчичного газа на миллимоль
граммов на миллимоль горчичный газ к молекуле
›› Подробная информация о расчетах молекулярной массы
В химии вес формулы — это величина, вычисляемая путем умножения атомного веса (в единицах атомной массы) каждого элемента в химической формуле на количество атомов этого элемента, присутствующего в формуле, с последующим сложением всех этих продуктов вместе.
Атомные веса, используемые на этом сайте, получены от Национального института стандартов и технологий NIST. Мы используем самые распространенные изотопы. Вот как рассчитать молярную массу (среднюю молекулярную массу), которая основана на изотропно взвешенных средних. Это не то же самое, что молекулярная масса, которая представляет собой массу одной молекулы четко определенных изотопов. Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую также можно назвать стандартной атомной массой или средней атомной массой.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем сложить атомные веса и вычислить молекулярную массу вещества.
Формула веса особенно полезна при определении относительного веса реагентов и продуктов в химической реакции. Эти относительные веса, вычисленные по химическому уравнению, иногда называют весами по уравнениям.
Определение молярной массы начинается с единиц граммов на моль (г / моль). При расчете молекулярной массы химического соединения он говорит нам, сколько граммов содержится в одном моль этого вещества.Вес формулы — это просто вес в атомных единицах массы всех атомов в данной формуле.
Часто на этом сайте просят перевести граммы в моль. Чтобы выполнить этот расчет, вы должны знать, какое вещество вы пытаетесь преобразовать. Причина в том, что на конверсию влияет молярная масса вещества. Этот сайт объясняет, как найти молярную массу.
Если формула, используемая при расчете молярной массы, является молекулярной формулой, вычисленная формула веса является молекулярной массой.Весовой процент любого атома или группы атомов в соединении можно вычислить, разделив общую массу атома (или группы атомов) в формуле на вес формулы и умножив на 100.
›› Метрические преобразования и др.
ConvertUnits.com предоставляет онлайн калькулятор преобразования для всех типов единиц измерения. Вы также можете найти метрические таблицы преобразования для единиц СИ. в виде английских единиц, валюты и других данных. Введите единицу символы, сокращения или полные названия единиц длины, площадь, масса, давление и другие типы.Примеры включают мм, дюйм, 100 кг, жидкая унция США, 6 футов 3 дюйма, 10 стоун 4, кубический см, метры в квадрате, граммы, моль, футы в секунду и многое другое!
.