Три способа отличить этиловый спирт от метилового
Если вы выпили некачественный алкоголь и отравились, последствия будут, конечно, неприятные, но со временем здоровье вернется. Но вот когда напиток был не просто некачественным, а на основе не этилового, а метилового спирта — последствия плачевны. Эти жидкости совершенно одинаковые по вкусу, запаху и цвету.
Сало и водка.
whenonearth.net
После массовой гибели людей после употребления жидкости с метанолом в Иркутске, мы решили рассказать, как отличить эти жидкости и последствия при употреблении.
1 Как отличить этиловый спирт от метилового?
- поджечь жидкость и проследить за цветом огня. Если спирт горит синим пламенем, то, скорее всего, перед вами этанол. Метиловый спирт полыхает зеленым.
- очистить сырую картошку и положить небольшой кусочек в емкость. Через несколько часов она может поменять свой цвет. Если порозовеет, то спирт метиловый.

- взять медную проволоку, накалить ее над огнем и опустить в исследуемый раствор. Если в нем содержался метанол, то появится запах формалина — резкий и очень неприятный. С этанолом такого эффекта не будет.
2 Признаки интоксикации при чрезмерном употреблении алкоголя на основе этилового спирта (появляются через 12−18 часов):
- тошнота;
- рвота;
- жидкий стул;
- боли в животе;
- сильнейшая головная боль;
- судороги;
- тахикардия;
- сухость слизистых оболочек.
Аптечный спирт.
www.medikforum.ru
3 Признаки интоксикации при употреблении спиртосодержащей жидкости на основе метанола:
- помутнение (спутанность) сознания, снижения чувствительности, пошатывание при ходьбе, сонливость;
- характерное (специфическое) действие на органы зрения — светобоязнь и
- нечеткое изображение предметов, расширение зрачков, нарушенная или отсутствует реакция на свет;
- результаты лабораторных исследований — в крови возрастает уровень гемоглобина и эритроцитов, в моче появляется белок и гиалиновые цилиндры;
- отек зрительного нерва и сетчатки, которые в результате приводят к их атрофии и слепоте;
- расширяются зрачки и падает острота зрения;
- дыхание становится глубоким и неэффективным;
- появляется цианоз (посинение) кожи и слизистых оболочек.

При появлении данных симптомов необходимо срочно вызвать машину скорой медицинской помощи.
Роспотребнадзор по Алтайскому краю напоминает, что метанол — сильнейший яд, который вызывает двухстороннее воспаление зрительного нерва. Употребление во внутрь от 30 до 100 мл метанола приводит к летальному исходу.
этиловый спирт отличие от метилового
Спирт этиловый отличие от метилового — вопрос, которым, рано или поздно, задаются начинающие винокуры. Или люди, которые дорожат не только своим здоровьем, но и жизнью. Поскольку разница между напитком и ядом может быть совсем мала.
Метил и этил, как два брата. Они схожи по вкусу и запаху. Поэтому знать методы по их определению важно для здоровья, так сказать.
Как определить? Какие методы по определению существуют? Каковы симптомы при отравлении? Разбираем в нашей статье.
Спирты.
 Определения и виды
Определения и виды Спирты — органические соединения, полученные в результате гидрогенизации окиси углерода, под действием катализатора.
Ничего не понятно, если вы не микробиолог.
В общем это химическая реакция присоединения водорода к различным видам связей молекулы. Углубляться не стоит.
Для нас главное уметь отличать.
Итак…
—
Этиловый спирт
Прозрачная жидкость, не имеющая цвета. Но имеет специфический слабый запах и сладковато-обжигающий привкус. “На ура” растворяет органические вещества. Горит, образуя диоксид углерода и воды, в которой успешно может растворяться.
Собственно это тот спирт, который мы пьем. Пищевой.
Получается в результате процессов брожения и дистилляции.
Чтобы получить, необходимо использовать продукты, содержащие сахара. Или крахмал. А также применяются различные бактерии, дрожжи и ферменты.
—
Метиловый спиртА этот спирт, как вы догадались — яд.
Он используется в промышленной сфере в качестве растворителя для красок. Еще в производстве формальдегида.
В отличие от этанола, метанол всасывается намного медленнее. Поэтому в процессе окисления, в организме превращается в ядовитые вещества.
При употреблении недоброкачественного алкоголя человек просто слепнет. Наглухо. Если жив остается, конечно.
—
50 граммов достаточно, чтобы человек обзавелся собакой-поводырем. 100 гр. — заказывай плюшки и деревянный макинтош.
Так что.
Как уже говорили, эти спирты братья — схожи по вкусу и запаху. Метанол тоже горит. Однако воспламенение происходит при меньших температурах.
Раньше способы получения были такие: из древесины, муравьиной кислоты, лигнина.
Теперь метанол можно получить путем синтеза оксида углерода и водорода при помощи катализаторов.
Не простой процесс, но…
Продолжим.
—
Как отличить метиловый спирт от этилового?
На цвет, вкус, запах никак. По крайней мере человеческое обоняние не сможет уловить мельчайшие различия в запахе. Так что, придется воспользоваться “подручными средствами”. Рассмотрим эти способы, которые могут сохранить ваше здоровье.
—
Поджигать спирт в емкостях или смоченные алкоголем пальцы не обязательно.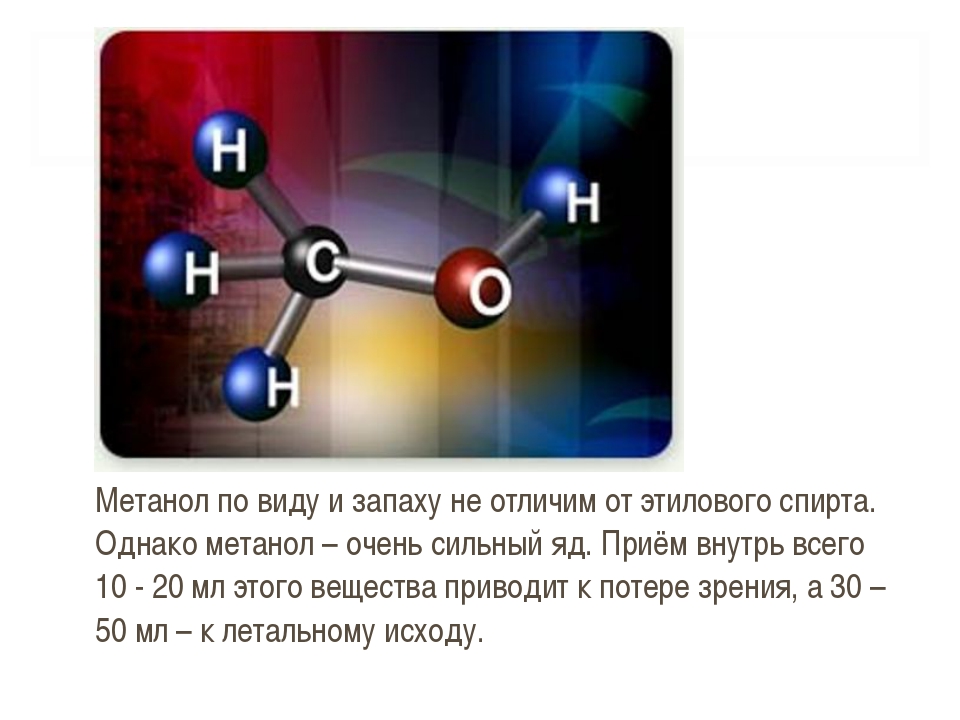 Достаточно использовать ватный тампон.
Достаточно использовать ватный тампон.
Этанол (пищевой спирт) должен гореть синим пламенем, а метанол (яд) – зелёным. Если он чистый, конечно.
Важно учитывать, что при наличии примесей в метиловом спирте, зеленое пламя может и не появиться.
—
Проверка картофелем
Чтобы проверить, необходимо очистить картофель небольшого размера, отрезать половинку и поместить в жидкость. Так, чтобы она скрылась в алкоголе целиком.
Спустя 3-5 часов, необходимо проверить результат.
Этиловый спирт останется прозрачным и не изменит цвет картофеля. Если испытуемой жидкостью окажется спирт МЕтиловый, то картофель окрасится в розовый цвет. А сама жидкость станет мутной.
—
Пищевая сода и марганец
Если налить этиловый спирт в стакан и насыпать в него немного соды, то после перемешивания на дне стакана останется осадок желтого цвета.
Если сделать то же самое с метилом, то сода полностью раствориться и жидкость останется абсолютно прозрачной.
Ситуация с марганцовкой будет немного другой. При добавлении ее в этанол и нагреве никакой реакции не произойдет.
В эксперименте с метилом, при добавлении марганца, жидкость начнет шипеть и выделять острый запах формалина. Вы узнаете его, если хоть раз бывали в морге.
—
Температура кипения
Этанол кипит при температуре 80 градусов цельсия. Метанол 60 градусов. Конечно же для этого вам понадобиться термометр.
—
Формальдегидное исследованиеГоворят, что наиболее эффективный прием, чтобы определить наличие метанола в стакане. Для этого тонкую медную проволоку раскаляют огне.
Затем погружают в экспериментируемую жидкость. Выделяется резкий едкий запах формалина? Этот алкоголь пить нельзя. Этанол будет выделять запах яблочного уксуса.
Выделяется резкий едкий запах формалина? Этот алкоголь пить нельзя. Этанол будет выделять запах яблочного уксуса.
—
Проба Ланга
50 гр. “подопытного” алкоголя и нагревают до 18 °С. Предварительно смешивают 2 гр. воды с 0,2 гр. перманганата калия. Добавляют в нагретую жидкость и тщательно перемешивают.
Смесь марганца должна поменять цвет с фиолетового на светло-розовый.
Тут важно время переход от одного цвета в другой.
Чем дольше процесс этого перехода, тем качественнее продукт.
В этаноле этот процесс будет значительно дольше — около 20 минут. крайний показатель — 10 минут. В метаноле все происходит гораздо быстрее.
Здесь также необходимо учитывать, что этот способ поможет выявить метил, если в алкоголе его содержание будет более 50% общего объема. В противном случае, определение метилового спирта будет невозможным.
В противном случае, определение метилового спирта будет невозможным.
Не стоит думать, что вышеперечисленные способы дают 100% гарантию на определение метанола в алкоголе. Отсюда вытекает еще один способ.
Если происхождение какого либо напитка вызывает у вас недоверие и подозрение, лучше не проверить его качество на себе.
Именно поэтому мы всегда говорим:
Делайте свое и будьте уверены в том, что вы пьете.
—
Симптомы отравления
Если симптомы отравления этиловым спиртом известны практически всем, то признаки присутствия метанола в организме мало кто знает. Поэтому может показаться, что “перепил”, а на самом деле — “хлебнул мертвой воды”.
При переборе с этиловым спиртом
Помимо этого может появляться непереносимость еды и отвращение к запаху алкоголя.
В случае отравления метанолом:
-
Резкая, внезапная головная боль. Часто меняющаяся — то болит, то не болит
-
Проблема с дыханием. Нехватка воздуха. Боль в груди
-
Слабость, вялость и недомогание
-
Боль в области живота
И главный отличительный признак:
—
Нарушение зрения.
—
Размытие объектов, не четкая фокусировка на предметах. Боязнь света, но зрачки расширены.
—
Первая помощь при отравлении метилом
Естественно, необходима неотложная помощь медиков и госпитализация. Но до приезда врачей надежда только на свои силы.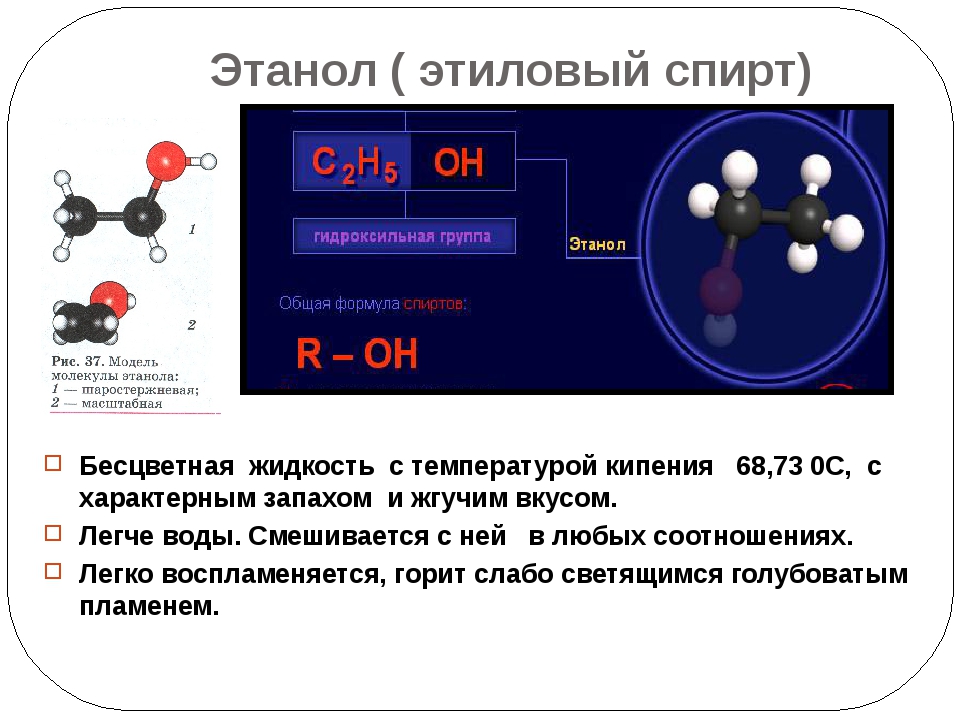 Поэтому, что можно сделать дома:
Поэтому, что можно сделать дома:
-
Промыть желудок.
Как ни странно, у метилового спирта есть плюс — он медленно всасывается в кровь, как мы разбирали выше. Поэтому, если не мешкать, можно избежать осложнений.
На 1 литр воды развести несколько кристаллов перманганата калия. До приобретения розового оттенка. Смесь необходимо выпить залпом — добиться рвотного рефлекса.
-
Выпить 50-100 мл этанола. Он будет способствовать более быстрому выведению яда из организма.
Если отравление критически-острое — молитесь на благополучную дорогу неотложки.
—
Вывод:
Не уверены в качестве алкоголя — не пейте.
Делайте собственные напитки и будьте уверены.
Отличить метиловый спирт от этилового можно при помощи проволоки
+ A —
Еще отраву можно выявить по запаху
После трагедии c «Боярышником» в Иркутске местные жители объявили бойкот нелегальному алкоголю.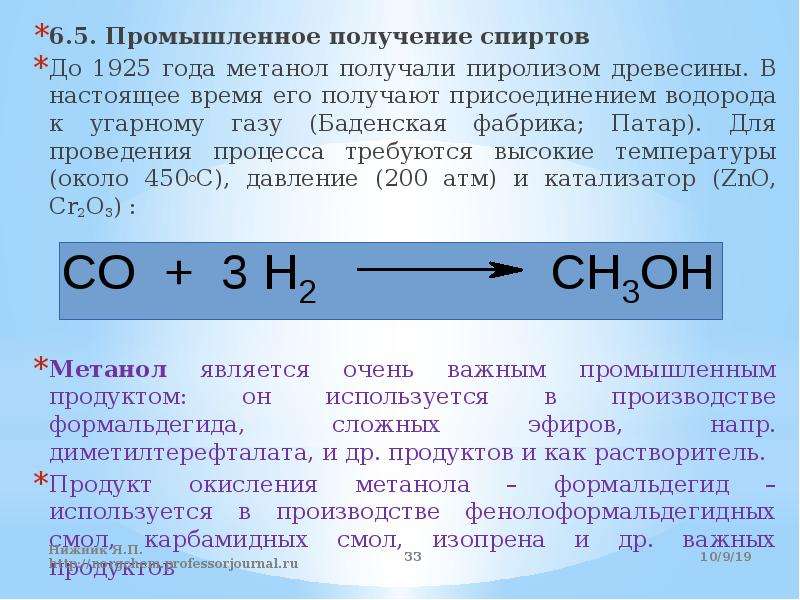 Население даже организовало патруль, который выявляет места незаконной продажи спиртного. Тем не менее на сегодняшний день по-прежнему никто не застрахован от попадания на стол напитков на основе метилового спирта. Мы узнали, существует ли способ проверить в домашних условиях наличие метанола в алкоголе.
Население даже организовало патруль, который выявляет места незаконной продажи спиртного. Тем не менее на сегодняшний день по-прежнему никто не застрахован от попадания на стол напитков на основе метилового спирта. Мы узнали, существует ли способ проверить в домашних условиях наличие метанола в алкоголе.
Для этого мы обратились к профессору Института общей и неорганической химии РАН Александру Терентьеву.
Главная проблема с определением наличия метанола в водке или, допустим, в том же «Боярышнике» кроется в недостаточной концентрации этого вещества в жидкости. Способы выявления яда существуют, но применимы только в тех случаях, если метанол в емкости чистый или его концентрация больше половины всего объема.
— Есть мудреный способ, для которого понадобится небольшая раскаленная проволока, — рассказывает Александр Терентьев. — Надо опустить ее в жидкость, а затем вытащить и принюхаться. Если в емкости метанол, то запах будет очень неприятный, если этанол — нейтральный.
Для второго способа понадобится обычный термометр. Поставьте жидкость на плиту, включите огонь, опустите градусник и наблюдайте, на какой отметке начнется процесс кипения. Метанол начнет кипеть примерно на 60 градусах, а этанол — в районе 80.
— Оба эти способа вполне доступны, но опять-таки в случаях, если мы имеем дело с большой концентрацией метанола, — объясняет профессор. — Самая неприятная ситуация, когда метанол будет с примесями или его будет меньше половины. Тут я не представляю, как в домашних условиях это выявить. Простыми манипуляциями это практически невозможно.
В химической лаборатории можно было бы провести опыт с марганцовкой, но он тоже очень ненадежен в случае с покупным алкоголем. Ведь его редко продают в чистом виде, как правило, производители добавляют экстракты (того же боярышника), а значит, анализ будет неточным.
В принципе можно отличить метанол от этанола по запаху.
Для химика это вообще не составит труда. Но и обычным людям стоит помнить, что у метанола нет ярко выраженного запаха, он почти нейтральный. В то время как запах обычного этилового спирта знаком каждому из нас.
В то время как запах обычного этилового спирта знаком каждому из нас.
Поэтому — нюхайте. Если вам кажется, что алкогольный напиток почему-то не пахнет привычно спиртом, стоит как минимум насторожиться. А лучше вылить его в раковину — здоровее будете.
И наоборот, насыщенный запах из бутылки будет означать, что напиток — на безопасном спирту, потому что эталон усиливает запахи. А в разные настойки и в некачественную водку часто добавляют чрезмерно насыщенные компоненты. И ярко выраженный запах не спирта, а чего-то другого, скорее всего, тоже будет говорить о том, что напиток безопасен. Относительно, конечно: отравление вы все равно можете заработать. Но хотя бы в морге не окажетесь.
— Метанол — это самое страшное, — предостерегает Терентьев. — 30–50 граммов — это уже слепота, а 100 граммов и выше — смертельная доза. То есть даже если человек выживет, то, скорее всего, он ослепнет. Кстати, в Советском Союзе были агитационные картиночки «Не пей метилового спирта!». На них изображен человек в темных очках и с палкой.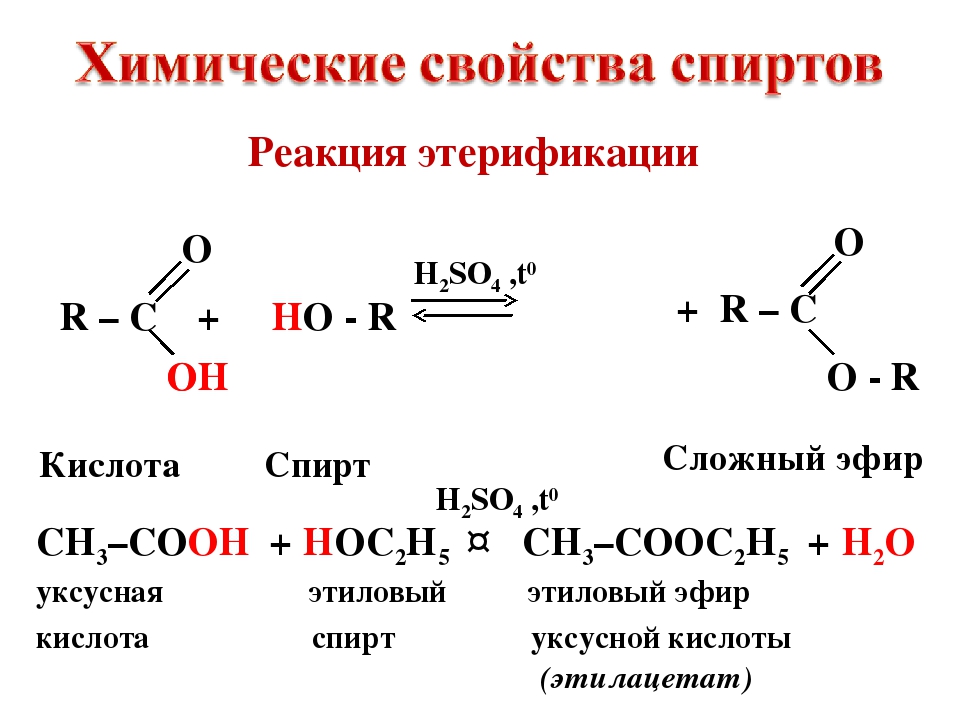
Похоже, такие картинки пора снова выпускать в печать и раздавать на выходах из метро.
Читайте материалы: Врач, спасший 86 человек после метила: «Большинство продолжили пьянствовать»
«Исповедь метанолового отравителя: причастный к смерти 68 человек живет счастливо»
Опубликован в газете «Московский комсомолец» №27289 от 26 декабря 2016
Заголовок в газете: Как опознать отраву?
Как мы пытались отличить метиловый спирт от этилового
Выявить яд помогут народные советы
Фото: Юлия ПЫХАЛОВА
О массовом отравлении метиловым спиртом в Иркутске говорят по всей стране. Напомним, в минувшие выходные, 17 и 18 декабря горожане, распивавшие сомнительную спиртосодержащий концентрат для ванн «Боярышник», начали поступать в больницы города в тяжелом состоянии. В бутылках, как оказалось позже, содержался метанол – яд. В понедельник, 19 декабря, от отравления скончались уже 33 человека ( по данным на 19. 00 местного времени).
00 местного времени).
Известно, что на вкус, запах, и цвет метанол от этанола не отличим. Определить, как говорится, «на глазок», что там налито в склянку с надписью «Боярышник», невозможно. Точный ответ нам могут дать только в лаборатории. Естественно, исследование требует времени, очень кстати придется народная смекалка. Итак, самый известный способ определить метиловый спирт от этилового – поджечь. Внимательно смотрим: этанол горит синим пламенем, метанол выдает зеленоватый оттенок.
Нам как раз удалось раздобыть фанфурик того самого концентрата для ванн, которым, предположительно, отравились иркутяне. Наливаем немного в ложку, поджигаем. Горит, еле заметен зеленоватый оттенок. Для чистоты эксперимента берем 96%-ный этиловый спирт, тоже поджигаем – полыхает синим. Результат на лицо.
Еще один способ выявить яд в стакане – накалить медную проволоку и опустить в жидкость. Если поднялся резкий и очень неприятный запах формалина, как пить дать перед нами метиловый спирт. Этанол такого эффекта не даст. Кроме того, можно взять картофелину, почистить, промыть и бросить в емкость, где находится испытуемая жидкость. Где-то через пару часов должен проявиться результат – в метаноле картошка станет слегка розоватой.
Кроме того, можно взять картофелину, почистить, промыть и бросить в емкость, где находится испытуемая жидкость. Где-то через пару часов должен проявиться результат – в метаноле картошка станет слегка розоватой.
Честно говоря, последние два способа мы проверять не стали, но ими тоже можно воспользоваться, особенно в домашних условиях, чтобы не устроить пожар.
Но есть один способ, стопроцентный. Рекомендуем. Пить качественный алкоголь, покупая его в магазине. И помнить, что злоупотребление им вредит вашему здоровью.
Этиловый и метиловый спирт — симптомы и признаки отравления спиртом
Главная>Статьи>Как отличить метиловый спирт от этилового, чтобы предотвратить негативные последствия отравления
Многие люди даже не задумываются о том, чем отличается этиловый и метиловый спирт. Иногда эти знания способны спасти человеку жизнь. Жидкости внешне очень схожи между собой. У них даже одинаковый запах. Но каждая оказывает разное действие на организм. Чтобы минимизировать риск отравления, необходимо знать, как отличить метиловый спирт от этилового, а также правильно распознавать признаки отрицательных реакций, которые представляют угрозу для жизни человека.
Чтобы минимизировать риск отравления, необходимо знать, как отличить метиловый спирт от этилового, а также правильно распознавать признаки отрицательных реакций, которые представляют угрозу для жизни человека.
Способы определения метилового и этилового спирта
Последнее время качество алкоголя стало заметно падать. Сегодня опасно покупать спиртные напитки даже в специализированных магазинах. Причиной этого является большое количество контрафактной продукции, которая попадает на прилавки без соответствующих проверок и должного контроля.
Подделки часто содержат в составе вместо этилового спирта метиловый, который является самым настоящим ядом для организма. Выпив всего 30 грамм такого алкоголя, можно спровоцировать серьезные повреждения, которые носят необратимый характер, или даже смерть. Поэтому покупать алкоголь можно только у надёжных и проверенных поставщиков, которые гарантируют высокое качество своей продукции.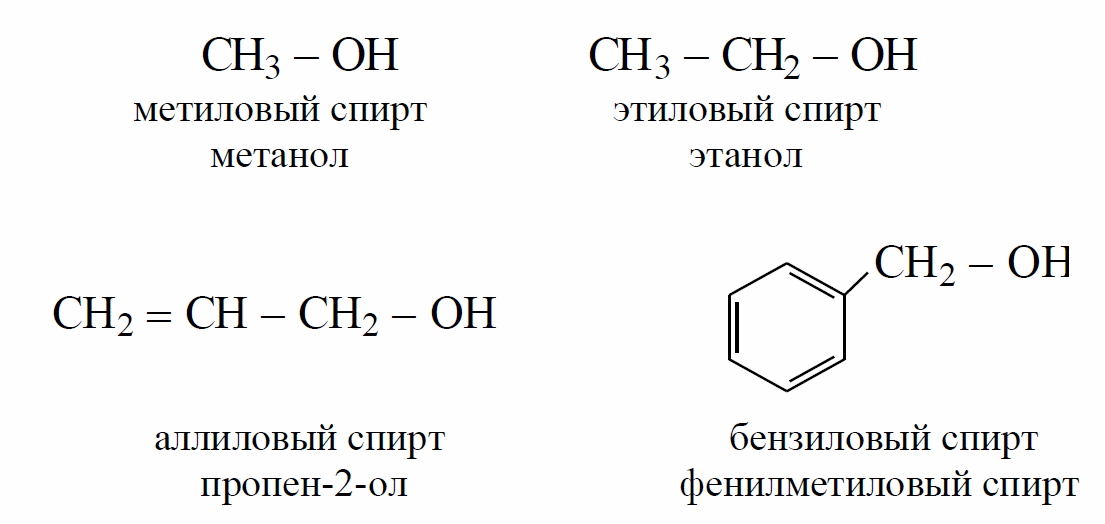
Есть несколько способов, как отличить метиловый спирт от этилового самостоятельно в домашних условиях. К ним относятся:
- Поджигание. Это один из самых простых методов, как можно максимально проверить алкогольный напиток на качество. Для этого в рюмку наливается около 10 грамм жидкости, затем она слегка взбалтывается и поджигается. У этилового спирта пламя окрашивается в синий тон, у метилового – в зеленый.
- Опыт с медной проволокой. Для того, чтобы определить вид спирта, нужно сильно наколоть проволоку, после чего окунуть ее в посуду с жидкостью. Если налит метил, то человек сразу почувствует крайне неприятный запах, напоминающий формалин. В случае с этилом, аромат может полностью отсутствовать или будет слышен едва уловимый запах яблок.
- Картофель. Корнеплод полностью очищается от кожуры и режется на небольшие кусочки. Для проведения опыта достаточно одной дольки овоща, брошенного в емкость со спиртом. Если налит метил, то картофель через несколько часов окраситься в розовый тон, а в этиле цвет овоща не изменится.
 Опыт не даст достоверных результатов, когда в алкогольном напитке присутствуют дополнительные добавки. Они также могут привести к окрашиванию корнеплода в разные оттенки.
Опыт не даст достоверных результатов, когда в алкогольном напитке присутствуют дополнительные добавки. Они также могут привести к окрашиванию корнеплода в разные оттенки. - Марганцовка. Если в спиртосодержащую жидкость попадает хотя бы небольшое количество кристаллов марганцовки, то в случае с метиловым спиртом выделяются вонючие газы формальдегида, а у этила может ощущается легкий аромат уксуса или полное наблюдается полное отсутствие запаха.
- Нагрев. Это один из самых спорных способов, чтобы правильно определить вид спирта. Для проведения опыта нужно воспользоваться методом кипячения. У метилового спирта первые пузырьки появляются при температуре 65 градусов, у этилового – при 80.
Если есть сомнения в качестве алкогольного напитка, лучше провести несколько проверок. Это займет немного больше времени, зато результаты будут максимально точными и правдивыми, что сможет уберечь человека от отравления метиловым спиртом.
Признаки отравления метанолом
Каждый человек хотя бы раз в жизни пробовал алкогольные напитки. К самым популярным видам относится коньяк, водка, вино, виски, текила и пиво. В их составе обязательно присутствует этиловый спирт в разных пропорциях. Чтобы придать напитку определенный вкус, используются специальные добавки в виде воды, растительных экстрактов, ароматизаторов и красящих веществ.
Обратите внимание
Для создания разнообразных химических или бытовых продуктов применяется метиловый спирт. Из полученных на его основе суррогатов изготавливают жидкости для чистки автомобильных стекол, добавки в топливо, а также сильнодействующие растворители. В организм метанол проникает через дыхательные пути, кожные покровы и пищеварительную систему. В каждом из этих случаев жидкость становится настоящим ядом, который способен убить человека. При употреблении 10 мл наступает тяжелое отравление, а 80-150 мл приводит к летальному исходу. Все зависит от индивидуальных особенностей организма.
Все зависит от индивидуальных особенностей организма.
Человек должен не только знать, чем отличается этиловый спирт от метилового, но также первые признаки отравления. Это поможет предотвратить развитие осложнений, а в некоторых случаях даже спасти жизнь.
Симптомы метилового отравления в легкой степени проявляются следующим образом:
- головокружение;
- бледность кожных покровов;
- тошнота и рвота;
- головная боль, начинающаяся внезапно и быстро;
- общее недомогание;
- сильные болевые ощущения в области печени при нажатии;
- расширенные зрачки, вяло реагирующие на свет;
- кожные покровы и слизистые оболочки приобретают синеватый оттенок;
- нарушена координация движений.
Если своевременно не обратить внимания на симптомы легкой формы недомогания, то у человека отравление метиловым спиртом начинает переходить в тяжёлую степень. К основным признакам негативной реакции организма в данном случае относятся:
К основным признакам негативной реакции организма в данном случае относятся:
- снижение артериального давления;
- учащенное сердцебиение;
- потеря сознания;
- нарушение координации движения;
- ухудшение зрения вплоть до слепоты;
- моча и пот приобретают резкий специфический запах алкоголя;
- плохое восприятие света.
Организм человека всасывает метил гораздо медленнее, чем этанол. Первые симптомы появляются только спустя 12-24 часа после употребления напитка с ним в составе. В результате этого в организме начинают образовывать вещества, обладающие сильным токсическим действием, что крайне негативно отражается на здоровье человека.
Отравление метиловым спиртом, прежде всего, сказывается на нервной системе, дыхательных путях, слизистых оболочках, коже, органах пищеварения, а также может привести к полной слепоте.
Когда у человека наблюдается хотя бы один из данных симптомов, необходимо незамедлительно обратиться за квалифицированной медицинской помощью. Любое промедление чревато серьезными осложнениями, которые носят необратимый характер или даже летальным исходом.
Любое промедление чревато серьезными осложнениями, которые носят необратимый характер или даже летальным исходом.
Как проверить качество водки?
Чтобы предотвратить отравление этиловым спиртом, необходимо убедиться в качестве алкогольного напитка перед его употреблением. Первый тест проводиться еще в магазине перед покупкой. Все акцизы и этикетки должны быть ровно наклеены на бутылке. Если они располагаются криво или визуально заметны следы от повторного нанесения, то для собственной безопасности лучше отказаться от покупки такого вида бутылки.
Помимо этого, нужно обратить внимание на другие важные критерии, которые помогут выбрать качественный продукт. К ним относятся:
- Пробка. Она не должна прокручиваться в холостую. При переворачивании бутылки жидкость не подтекает через негерметичную пробку.
- Стоимость. Чаще всего поддельные напитки стоят гораздо дешевле. Лучше потратить немного больше денег, но купить более качественный алкоголь.

- Содержимое. Внутри бутылки не должно присутствовать осадка и постороннего мусора. Если встряхнуть емкость по спирали, то можно увидеть змейку из мелких пузырьков воздуха, которые подтверждают хорошее качество напитка.
- Запах. После покупки нужно открыть не охлажденную бутылку, чтобы понюхать ее содержимое. Водка должна пахнуть только спиртом без посторонних специфических запахов. Если аромат жидкости напоминает ацетон или парфюмерию, то лучше отказаться от употребления данного продукта.
- Вес. Масса литра чистой водки без бутылки составляет 953 грамма. Допускается погрешность значения в 5-6 грамм в большую или меньшую сторону. Если это значение сильно отличается, значит, в составе напитка присутствуют посторонние примеси, которые могут в дальнейшем негативно отразиться на здоровье человека.
- Заморозка. Температура в морозильной камере обычно колеблется в пределах от -18 до -25 градусов. Если поместить туда бутылку, то хорошая водка внутри не замерзнет.

- Поджигание. Данный способ проверки качества водки называется дедовским методом. Он считается одним из самых действенных. Для проведения опыта нужно налить в столовую ложку немного водки и подержать ее над огнем в течение нескольких секунд. Если жидкость горит ровным пламенем синего цвета, то продукт настоящий и его можно употреблять. Когда напиток резко вспыхивает или совсем не загорается, это говорит о наличии в составе суррогата.
Чтобы не допустить признаки отравления этиловым спиртом, нужно более тщательно и внимательно выбирать алкоголь перед покупкой. Но также не стоит забывать, что длительное употребление спиртных напитков приводит к развитию зависимости.
Первая помощь при отравлении метиловым спиртом
При появлении первых признаков нужно незамедлительно вызвать бригаду скорой помощи. Квалифицированные врачи смогут максимально быстро и правильно предпринять ряд действий, которые предотвратят развитие серьезных осложнений. Очень часто вовремя приехавшие медики спасают людям жизни.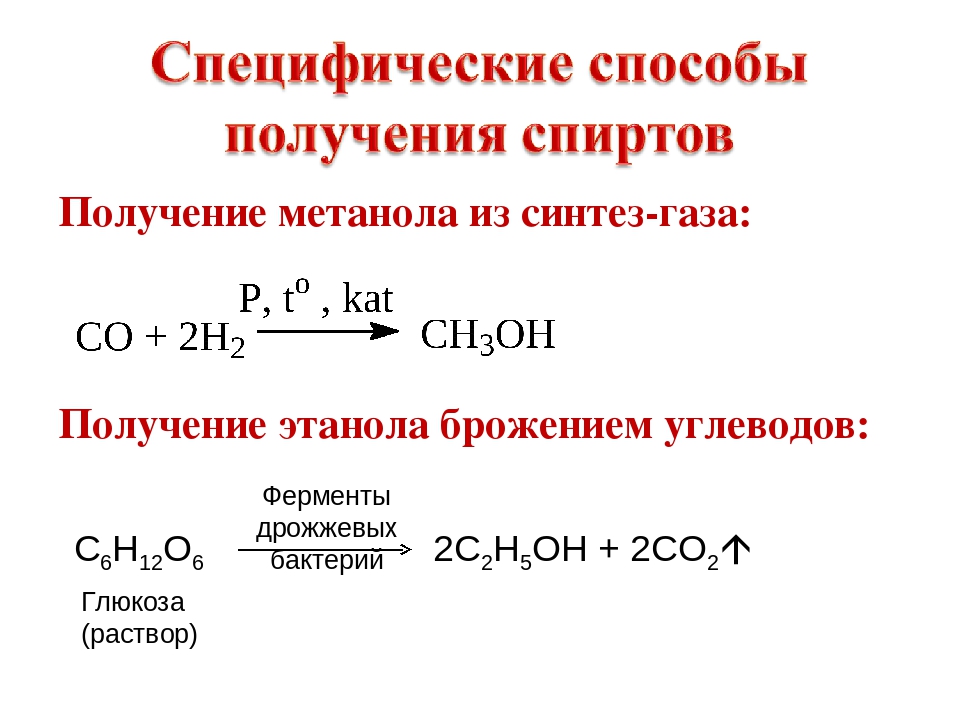
До приезда специалистов можно помочь человеку, у которого стали резко проявляться симптомы метилового отравления, выполняя следующие действия:
- Освободить организм от токсичных веществ, попавших внутрь. Для этого можно быстро промыть желудок теплым раствором пищевой соды.
- Обеспечить обильное питье. Человек должен выпить от 8 до 12 литров жидкости.
- Дать приток свежего воздуха.
Все эти действия допускается делать только в том случае, если человек находится в сознании. Если у него пульс не прощупывается или отсутствует дыхание, то нужно переходить к реанимационным мероприятиям, а после переложить пострадавшего на бок и накрыть теплым покрывалом.
Самостоятельное лечение при отравлении спиртными напитками полностью исключено. Только квалифицированный врач может подобрать оптимальный курс терапии, обследовав пациента, а также полностью изучив его анализы. Специалист также при назначении дозировки и курса приема препаратов учитывает возраст человека и индивидуальные особенности организма.
Как отличить метиловый спирт от этилового
Все мы знаем, что этанол — это основа любого алкогольного напитка. А вот созвучный ему спирт метанол — жуткий яд. Последний в большом количестве содержится в “головной” фракции самогона, поэтому при больших погрешностях в технологии перегонки таким напитком сильно травились вплоть до слепоты и летального исхода.
Если Вы начинающий винокур, то в целях безопасности отбирайте “головы” с запасом, не рискуйте. Или же приобретайте высокотехнологичные аппараты, позволяющие проводить точное разделение фракций (например, Люкссталь 8).
Метанол — это древесный (метиловый) спирт. Смертельная
норма при приеме внутрь составляет всего 1-2 мл на 1 кг веса тела. Т.е.
человеку с массой тела 70 кг достаточно выпить около 70 мл этого яда.
Токсичность обусловлена тем, что в организме метанол окисляется до
формальдегида, а тот в свою очередь взаимодействует с белками и нарушает
функционирование нервной системы.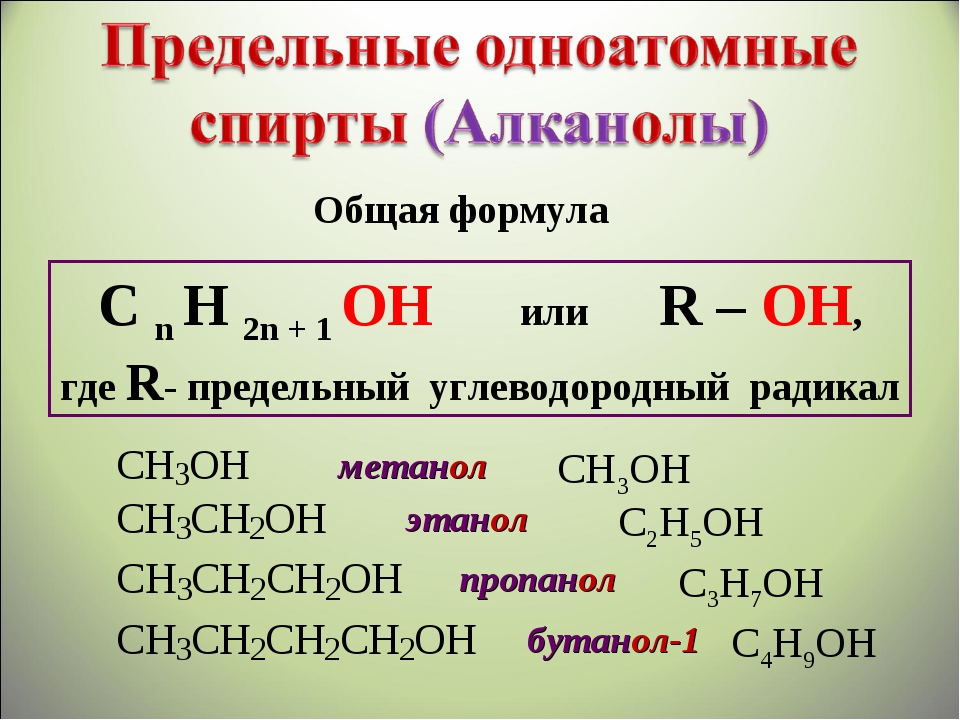 Разница этилового и метилового спирта с точки
зрения химического строения небольшая, а сила токсического воздействия на
организм отличается на порядок.
Разница этилового и метилового спирта с точки
зрения химического строения небольшая, а сила токсического воздействия на
организм отличается на порядок.
Как отличить метиловый спирт от этилового
Этиловый спирт от метилового отличается химической формулой, но стоят они в одном ряду одноатомных спиртов сразу друг за другом. Коварство древесного спирта заключается в том, что его трудно по запаху и вкусу отличить от этанола. Поэтому им так часто и травятся. Определить, что перед Вами, можно с помощью йода:
- йод с этанолом дает осадок желтого цвета;
- йод с метанолом осадка не даст, раствор так и останется прозрачным и желтым.
Однако, способ этот подойдет только в том случае, если Вы уверены, что спирт чистый. Помочь отыскать примеси метанола в этаноле он не сможет.
Примечательно, что антидотом к ядовитому метанолу является этанол. Последний вводят внутривенно или перорально, тем самым “отвлекая внимание” нужных ферментов на него.
При этом метанол не окисляется и постепенно выводится из организма.
Как отличить питьевой спирт от технического
Технический спирт как правило имеет маркировку “спирт этиловый ректификованный технический сорт 1” и содержание этанола в нем согласно ГОСТу не должно опускаться ниже 96%. Производят его обычно из пищевого сырья или из “головной” фракции после перегонки с получением этанола пищевого сорта (также из пищевого сырья).
Бывает также спирт этиловый технический марки А или Б. Первый производят из гидролизных субстратов, а второй — из щелоков целлюлозного производства. Содержание этанола соответственно не ниже 95% и 94%.
Проверить спирт на то, питьевой он или технический, без специального анализа на примеси не удастся. Придется либо верить этикетке (или источнику его появления у Вас) или не рисковать вовсе. В технических спиртах казалось бы незначительное количество примесей может очень негативно сказаться на здоровье.
Единственное применение для технического спирта 1 сорта можно найти в рецептах настоек на спирту для наружного лечебного применения: компрессы, растирания, ушные капли.
Спирт этиловый технический. Метод определения метилового спирта – РТС-тендер
ГОСТ 10749.14-80
Группа Л29
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
СПИРТ ЭТИЛОВЫЙ ТЕХНИЧЕСКИЙ
Метод определения метилового спирта
Ethyl alcohol for industrial use. Method for determination of methyl alcohol
ОКСТУ 2409
Дата введения 1982-01-01
ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного комитета СССР по стандартам от 29 декабря 1980 г. N 6048
Ограничение срока действия снято по протоколу Межгосударственного Совета по стандартизации, метрологии и сертификации (ИУС 5-6-93)
ВЗАМЕН ГОСТ 10749-72 в части разд.15
ПЕРЕИЗДАНИЕ (март 1997 г.) с Изменением N 1, утвержденным в сентябре 1985 г. (ИУС 12-85)
Настоящий стандарт распространяется на технический этиловый спирт и устанавливает метод определения метилового спирта.
1. ОТБОР ПРОБ
1.1. Пробы отбирают в соответствии с требованиями НТД на этиловый спирт.
2. ПРИБОРЫ, ПОСУДА, РЕАКТИВЫ И РАСТВОРЫ
Весы лабораторные технические с наибольшим пределом взвешивания 500 или 1000 г любого типа с ценой деления не более 0,01 г 1 или 2-го класса точности.
Колбы 2-100-1(2), 2-500-1(2) и 2-1000-1(2) по ГОСТ 1770-74.
Склянки из темного стекла вместимостью 1,5-2 дм с пришлифованной пробкой.
Пробирки П4-20-14/23 ХС по ГОСТ 25336-82.
Цилиндр 1(2)-100 по ГОСТ 1770-74.
Пипетки 4-1(2)-1-0,01 и 6-1(2)-5-0,1 по НТД.
Бюретка 1-1(2)-10-0,05 по НТД.
Вода дистиллированная по ГОСТ 6709-72.
Кислота серная по ГОСТ 4204-77, х.ч. или ч.д.а., выдерживающая пробу Савалля, концентрированная и 65%-ный раствор.
Кислота щавелевая по ГОСТ 22180-76, х.ч., насыщенный раствор.
Калий марганцовокислый по ГОСТ 20490-75, х.ч., 1%-ный раствор.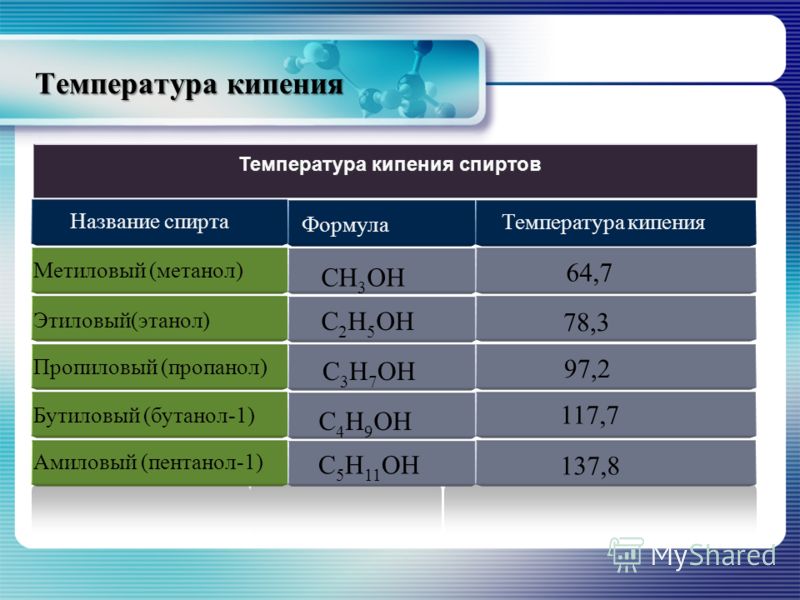
Натрий сернистокислый пиро по ТУ 6-09-4327-78, раствор готовят следующим образом: 40 г пиросернистокислого натрия (результаты взвешивания, в граммах, записывают с точностью до второго десятичного знака) помещают в мерную колбу вместимостью 100 см, приливают 40 см дистиллированной воды и выдерживают 5-6 ч при комнатной температуре. Полученный насыщенный раствор отфильтровывают через бумажный складчатый фильтр на воронке, прикрытой часовым стеклом. Фильтрат собирают в цилиндр и доводят его плотность дистиллированной водой до 1,260 г/см. Раствор готовят непосредственно перед его использованием. Реактив следует хранить в склянке с пришлифованной пробкой.
Фуксин основной для фуксинсернистой кислоты.
Спирт этиловый бессивушный и безальдегидный.
Метанол-яд по ГОСТ 6995-77, х.ч., перегнанный, температурой кипения 64,7 °С, плотностью 0,7964 г/см, 0,1%-ный раствор по объему в бессивушном и безальдегидном этиловом спирте (раствор сравнения) или типовые растворы метилового спирта.
Реактив фуксинсернистый, готовят следующим образом: 0,55 г основного фуксина (результаты взвешивания, в граммах, записывают с точностью до второго десятичного знака) помещают в мерную колбу вместимостью 500 см, приливают 200 см дистиллированной воды и нагревают на кипящей водяной бане 1 ч, периодически помешивая раствор до полного растворения фуксина. Затем раствор охлаждают до температуры 20 °С, доводят объем до метки дистиллированной водой и перемешивают. Полученный раствор переливают в склянку с пришлифованной пробкой вместимостью 600 см и прибавляют к нему 12,5 см раствора пиросернистого натрия (плотность 1,260 г/см) и 2,5 см концентрированной серной кислоты (плотность 1,830 г/см). Реактив выдерживают 24 ч при температуре 8-10 °С; хранят в склянке из темного стекла не более 2 мес.
(Измененная редакция, Изм. N 1).
3. ПРОВЕДЕНИЕ АНАЛИЗА
3.1. 1 см анализируемого спирта смешивают в пробирке с 5 смраствора марганцовокислого калия и 0,4 см 65%-ного раствора серной кислоты и тщательно перемешивают.
По истечении ровно 3 мин при перемешивании к смеси приливают 1 см раствора щавелевой кислоты. Когда жидкость приобретает слабо-желтую окраску, для полного обесцвечивания к ней приливают из бюретки 1 см концентрированной серной кислоты и перемешивают.
После этого прибавляют 5 см фуксинсернистого реактива, перемешивают и оставляют в покое на 20 мин. Одновременно проводят контрольный опыт с раствором сравнения, применяя его вместо анализируемого спирта в тех же объемах.
(Измененная редакция, Изм. N 1).
3.2. Окраска анализируемого раствора не должна быть интенсивнее окраски раствора сравнения.
Текст документа сверен по:
официальное издание
Спирт этиловый технический.
Методы анализа: Сб. ГОСТов. —
М.: ИПК Издательство стандартов, 1997
Тест для различения этанола и метанола | Эксперимент
Этот эксперимент занимает около 20 минут. Он в высшей степени подходит для студентов, у которых указана йодоформная реакция. Для других это хорошее упражнение по наблюдению и дополнение для более способных учеников.
Для других это хорошее упражнение по наблюдению и дополнение для более способных учеников.
И метанол, и этанол (а также другие спирты и органические жидкости) можно хранить в пластиковых пипетках, из которых их можно легко распределять. Основная трудность для студентов возникает из-за того, что при слишком сильном сжатии пипетки спирты выходят из пипетки струей (из-за их низкого поверхностного натяжения).Студенты должны обращаться с пипетками очень осторожно, и перед продолжением этого эксперимента потребуется некоторая практика.
Оборудование
Аппарат
- Защита глаз (очки)
- Пробирки по 2 шт. Для каждой группы учеников
Химическая промышленность
- Жидкости или растворы в пластиковых пипетках-капельницах (по одной каждой):
- Метанол (легковоспламеняющийся, токсичный)
- Этанол (легковоспламеняющийся) или промышленный денатурированный спирт, IDA (легковоспламеняющийся, вредный)
- Гидроксид натрия, 1 М (КОРРОЗИОННЫЙ)
- Раствор йода, 0.
 5 М (растворен в растворе йодида калия 0,2 М)
5 М (растворен в растворе йодида калия 0,2 М)
Примечания по технике безопасности, охране труда и технике
- Прочтите наше стандартное руководство по охране труда и технике безопасности
- Носите защитные очки.
- Метанол, CH 3 OH (l), (легковоспламеняющийся, токсичный) — см. Карту CLEAPSS Hazcard HC040b.
- Этанол, CH 3 CH 2 OH (l), (легковоспламеняющийся) и IDA (легковоспламеняющийся, вредный) — см. CLEAPSS Hazcard HC040a.
- Гидроксид натрия, NaOH (водн.), (КОРРОЗИОННО в используемой концентрации) — см. CLEAPSS Hazcard HC091a и CLEAPSS Recipe Book RB085.
- Раствор йода, I 2 (водный), растворенный в растворе йодида калия, KI (водный), — см. CLEAPSS Hazcard HC054 и CLEAPSS Recipe Book RB050.
- Продукт: Трийодметан, CHI 3 (s), (ВРЕДНО) — см. CLEAPSS Hazcard HC104.
Процедура
- Практикуйтесь (над раковиной), производя отдельные капли этанола из пипетки.

- Добавьте 10 капель метанола в одну пробирку.
- Добавьте 10 капель этанола в другую пробирку.
- Добавьте 25 капель раствора йода в каждый спирт.
- Добавьте 10 капель раствора гидроксида натрия в каждый спирт.
- Осторожно покрутите пробирки несколько раз. Темный цвет йода должен начать тускнеть.
- Через две минуты внимательно осмотрите две пробирки. Какие различия вы заметили?
Учебные заметки
Раствор в пробирке с этанолом должен стать мутным, а затем должен появиться желтый осадок трийодметана (йодоформа).У него отчетливый «антисептический» запах. Пробирка с метанолом должна оставаться чистой.
Йодоформная реакция осуществляется соединениями с метильной группой рядом с карбонильной группой. Вторичные спирты с CH 3 на углероде, несущем ОН (например, пропан-2-ол), который может окисляться до карбонильных соединений этого типа, также дают положительный результат теста на йодоформ. (NB карбоновые кислоты не содержат)
(NB карбоновые кислоты не содержат)
Этанол — единственный первичный спирт, который дает реакцию, а этаналь — единственный альдегид.Объяснение реакции:
Показать в полноэкранном режимеОтрицательный заряд углерода в ионе I 3 C — стабилизируется тремя электроотрицательными атомами йода.
Дополнительная информация
Это ресурс из проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Этот сборник из более чем 200 практических занятий демонстрирует широкий спектр химических концепций и процессов.Каждое упражнение содержит исчерпывающую информацию для учителей и технических специалистов, включая полные технические примечания и пошаговые инструкции. Практическая химия сопровождает практическую физику и практическую биологию.
© Фонд Наффилда и Королевское химическое общество
Проверено на здоровье и безопасность, июль 2016 г.
Номенклатура спиртов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Введение
- Правила наименования спиртов
- Примеры
- Внешние ссылки
- Ссылки
- Проблемы
- Участники
Спирты — одна из наиболее важных функциональных групп в органической химии. Спирты — хороший источник реагентов для реакций синтеза. Способность идентифицировать спирты важна, особенно при просмотре ИК- и ЯМР-спектров. Сигнал алкоголя очень легко обнаружить на ИК-графиках, потому что они имеют сильный сигнал в области 3200 см –1 .
Спирты — хороший источник реагентов для реакций синтеза. Способность идентифицировать спирты важна, особенно при просмотре ИК- и ЯМР-спектров. Сигнал алкоголя очень легко обнаружить на ИК-графиках, потому что они имеют сильный сигнал в области 3200 см –1 .
Введение
Ниже приводится список некоторых распространенных первичных спиртов, основанный на системе именования IUPAC.
Имя | Молекулярная формула |
Метанол (метиловый спирт) | CH 3 OH |
Этанол (этиловый спирт) | С 2 H 5 ОН |
Пропанол | С 3 H 7 ОН |
Бутанол | С 4 H 9 ОН |
Пентанол | С 5 H 11 ОН |
Гексанол | С 6 H 13 ОН |
Гептанол | С 7 H 15 ОН |
Октанол | С 8 H 17 ОН |
Правила наименования спиртов
- Найдите самую длинную цепь, содержащую гидроксигруппу (ОН).
 Если существует цепь с большим количеством атомов углерода, чем та, которая содержит группу ОН, она будет названа заместителем.
Если существует цепь с большим количеством атомов углерода, чем та, которая содержит группу ОН, она будет названа заместителем. - Поместите OH на наименьшее возможное число для цепи. За исключением карбонильных групп, таких как кетоны и альдегиды, спиртовые или гидроксильные группы имеют первый приоритет для наименования.
- При названии циклической структуры предполагается, что -ОН находится на первом атоме углерода, если не присутствует карбонильная группа, и в этом случае последняя получит приоритет у первого атома углерода.
- Если в циклической структуре присутствует несколько групп -ОН, пронумеруйте атомы углерода, на которых расположены группы -ОН.
- Удалите последний e из родительской алкановой цепи и добавьте — ol . Когда присутствует несколько спиртов, используйте di, tri, et.c перед ol, после имени родителя. бывший. 2,3-гексан диол . Если присутствует карбонильная группа, группа -ОН обозначается с префиксом «гидрокси», при этом карбонильная группа присоединяется к имени родительской цепи так, чтобы она оканчивалась на — al или — единица.

Примеры
Ethan e : CH 3 CH 3 ——> Ethan ol : (алкоголь, содержащийся в пиве, вине и других потребляемых спиртных напитках)
Вторичный спирт: 2-пропанол
Другие функциональные группы в спирте: 3-бром-2-пентанол
Циклический спирт (две -ОН группы): циклогексан-1,4-диол
Другая функциональная группа в циклической структуре: 3-гексагон ен ол (алкен выделен жирным шрифтом и обозначен нумерацией атома углерода, ближайшего к спирту)
Сложный спирт: 4-этил-3-гексанол (исходная цепь — красным, а заместитель — синим)
Список литературы
- Терлоу, К.J .. Химическая номенклатура. Нидерланды: Kluwer Academic Publishers, 1998.
Проблемы
Назовите следующие спирты:
1.
14.2: Спирты — Номенклатура и классификация
- Последнее обновление
- Сохранить как PDF
- Номенклатура спиртов
- Классификация спиртов
- Резюме
- Упражнения на обзор концепции
- Ответы
- Упражнения
- Ответы
Цели обучения
- Определите общую структуру спирта.
- Укажите структурную особенность, которая классифицирует спирты как первичные, вторичные или третичные.
- Назовите спирты как с общепринятыми названиями, так и с названиями ИЮПАК
Спирт — это органическое соединение с гидроксильной (ОН) функциональной группой на алифатическом атоме углерода. Поскольку ОН является функциональной группой всех спиртов, мы часто представляем спирты общей формулой ROH, где R представляет собой алкильную группу. Спирты распространены в природе. Большинство людей знакомы с этиловым спиртом (этанолом), активным ингредиентом алкогольных напитков, но это соединение является лишь одним из семейства органических соединений, известных как спирты.В семейство также входят такие привычные вещества, как холестерин и углеводы. Метанол (CH 3 OH) и этанол (CH 3 CH 2 OH) являются первыми двумя членами гомологического ряда спиртов.
Номенклатура спиртов
Спирты с одним-четырьмя атомами углерода часто называют общими названиями, в которых после названия алкильной группы стоит слово спирт :
Согласно Международному союзу чистой и прикладной химии (IUPAC), спирты получают название, изменяя окончание названия исходного алкана на — ol .Вот несколько основных правил ИЮПАК для наименования спиртов:
- Самая длинная непрерывная цепь (LCC) атомов углерода, содержащая группу ОН, берется за исходное соединение — алкан с таким же числом атомов углерода. Цепь пронумерована от конца, ближайшего к группе ОН.
- Число, обозначающее положение группы ОН, ставится перед названием исходного углеводорода, а окончание — e исходного алкана заменяется суффиксом — ol . (В циклических спиртах атом углерода, несущий группу ОН, обозначен как C1, но в названии не используется 1.) Заместители названы и пронумерованы, как в алканах.
- Если в одной и той же молекуле присутствует более одной группы ОН (полигидроксоспирты), используются суффиксы, такие как — диол и — триол . В этих случаях сохраняется окончание — e исходного алкана.
На рисунке \ (\ PageIndex {1} \) показаны некоторые примеры применения этих правил.
Рисунок \ (\ PageIndex {1} \): Правила ИЮПАК для спиртов. Названия и структуры некоторых спиртов демонстрируют использование правил IUPAC.
Пример \ (\ PageIndex {1} \)
Укажите название IUPAC для каждого соединения.
- HOCH 2 CH 2 CH 2 CH 2 CH 2 OH
Решение
- Десять атомов углерода в LCC делают соединение производным декана (правило 1), а ОН на третьем атоме углерода делает его 3-деканолом (правило 2).
Атомы углерода пронумерованы от конца, ближайшего к группе ОН. Это фиксирует две метильные (CH 3 ) группы на шестой и восьмой позициях. Название — 6,8-диметил-3-деканол (не 3,5-диметил-8-деканол).
- Пять атомов углерода в LCC делают соединение производным пентана. Две группы ОН на первом и пятом атомах углерода превращают соединение в диол и дают название 1,5-пентандиол (правило 3).
Упражнение \ (\ PageIndex {1} \)
Укажите название IUPAC для каждого соединения.
Пример \ (\ PageIndex {2} \)
Изобразите структуру каждого соединения.
- 2-гексанол
- 3-метил-2-пентанол
Решение
- Окончание — ol указывает на спирт (функциональную группу ОН), а шестнадцатеричный стержень — говорит нам, что в LCC шесть атомов углерода. Начнем с рисования цепочки из шести атомов углерода: –C – C – C – C – C – C–.
2 указывает, что группа ОН присоединена ко второму атому углерода.
Наконец, мы добавляем достаточно атомов водорода, чтобы у каждого атома углерода образовалось четыре связи.
- Окончание — ol указывает на функциональную группу ОН, а стержень pent — говорит нам, что в LCC пять атомов углерода. Начнем с рисования цепочки из пяти атомов углерода: –C – C – C – C – C–
Цифры указывают на наличие метильной (CH 3 ) группы на третьем атоме углерода и группы ОН на втором атоме углерода.
Упражнение \ (\ PageIndex {2} \)
Изобразите структуру каждого соединения.
Сводка
В системе ИЮПАК спирты именуются изменением окончания имени исходного алкана на — ol . Спирты классифицируются по количеству атомов углерода, присоединенных к атому углерода, который присоединен к группе ОН.
Упражнения по обзору концепции
Изобутиловый спирт является первичным, вторичным или третичным? Объяснять.
Что такое LCC в 2-этил-1-гексаноле? Что принимается за LCC при наименовании соединения? Объяснять.
ответы
первичный; атом углерода, несущий группу ОН, присоединен только к одному другому атому углерода
7 атомов углерода; 6-атомная цепь включает атом углерода, несущий группу ОН
ответы
- 1-гексанол; первичный
- 3-гексанол; вторичный
- 3,3-дибром-2-метил-2-бутанол; высшее образование
Разница между этилом и метилом
Основное различие — этил против метила
Термины этил и метил используются для обозначения группы атомов, которые присоединены к основной углеродной цепи.Они известны как алкильных заместителей . Этильная группа состоит из двух атомов углерода и пяти атомов водорода. Когда эта этильная группа связана с группой –ОН, она известна как этиловый спирт. Метильная группа состоит из одного атома углерода и трех атомов водорода. И этильная, и метильная группы являются насыщенными группами, что означает отсутствие двойных или тройных связей между атомами. Основное различие между этилом и метилом состоит в том, что этильная группа состоит из двух атомов углерода, тогда как метильная группа состоит из одного атома углерода.
Основные зоны покрытия
1. Что такое этил
— Определение, свойства, этилирование
2. Что такое метил
— Определение, свойства, метилирование
3. Каковы сходства между этилом и метилом
— Обзор общих характеристик
4. В чем разница между этилом и метилом
— Сравнение основных различий
Ключевые термины: бензол, этил, этилирование, углерод, водород, метил, метилирование
Что такое этил
Этильная группа представляет собой алкильный заместитель, состоящий из двух атомов углерода и пяти атомов водорода.Химическая формула этильной группы –C 2 H 5 . Его получают из этана (C 2 H 6 ) путем удаления одного атома водорода. это насыщенная группа атомов, не имеющая двойных или тройных связей между атомами.
Рисунок 1: Группы атомов синего цвета представляют собой этильные группы
Молярная масса этильной группы составляет 29 г / моль. У него есть одна свободная точка, к которой может присоединиться атом или группа атомов. Соединения, содержащие этильные группы, обозначаются с помощью префикса –ethyl.Например, когда группы –OH присоединены к этильной группе, соединение называется этиловым спиртом, а когда этильная группа присоединена к галогенидной группе, это называется этилгалогенидом, таким как этилхлорид.
Этилирование — это процесс введения этильной группы в другую молекулу. Здесь этильная группа присоединяется к свободной точке этой молекулы. Например, когда бензол реагирует с этилхлоридом в присутствии FeCl 3 и HCl, происходит реакция электрофильного замещения с образованием этилзамещенного бензола.
Что такое метил
Метильная группа — это группа атомов, состоящая из одного атома углерода и трех атомов водорода. Это насыщенная группа, в которой отсутствуют двойные или тройные связи. Химическая формула метильной группы –CH 3 . Молярная масса группы 15 г / моль.
Рисунок 2: Метилирование
Метильная группа имеет одну свободную точку, к которой может присоединиться другой атом или группа атомов. Метильная группа является производным метана (CH 4 ).Когда один атом водорода удаляется из метана, образуется метильная группа. Метильная группа — простейший алкильный заместитель.
Метилирование — это введение метильной группы в другую молекулу. Например, когда бензол реагирует с метилхлоридом в присутствии FeCl 3 и HCl, образуется метилзамещенный бензол (толуол).
Метильная группа чрезвычайно реактивна. Он может существовать в форме катиона (CH 3 + ), анионной формы (CH 3 —) или радикальной формы (CH 3 .). Но реакционная способность сильно зависит от соседних заместителей. Метильная группа может быть окислена до карбоксильных групп с использованием сильного окислителя, такого как перманганат калия.
Сходства между этилом и метилом
- Оба являются алкильными заместителями
- Оба являются производными углеводородных соединений
- Обе группы являются насыщенными атомами
- Оба состоят только из атомов углерода и водорода
Разница между этилом и метилом
Определение
Этил: Этильная группа представляет собой алкильный заместитель, состоящий из двух атомов углерода и пяти атомов водорода.
Метил: Метильная группа — это группа атомов, состоящая из одного атома углерода и трех атомов водорода.
Химическая формула
Этил: Химическая формула этильной группы –C 2 H 5
Метил: Химическая формула метильной группы –CH 3 .
Молярная масса
Этил: Молярная масса этильной группы составляет 29 г / моль.
Метил: Молярная масса метильной группы составляет 15 г / моль.
Формация
Этил: Этильная группа образуется из этана путем удаления одного атома водорода.
Метил: Метильная группа образуется из метана путем удаления одного атома водорода.
Алкилирование
Этил: Этильные группы могут принимать участие в реакциях этилирования.
Метил: Метильные группы могут принимать участие в реакциях метилирования.
Заключение
Этильные и метильные группы представляют собой группы атомов, содержащие только атомы углерода и водорода.Они известны как алкильные заместители, потому что они могут присоединяться к другим молекулам, заменяя водород или другие атомы. Основное различие между этилом и метилом состоит в том, что этильная группа состоит из двух атомов углерода, тогда как метильная группа состоит из одного атома углерода.
Артикул:
1. «Алкилирование Фриделя-Крафтса». Органическая химия, доступно здесь.
2. «Этильная группа». Википедия, Фонд Викимедиа, 19 декабря 2017 г., доступно здесь.
3. Гельменстин, Энн Мари, «Определение метила (метильная группа).”ThoughtCo, 16 августа 2017 г., доступно здесь.
Изображение предоставлено:
1. «Этильная группа V» Джу — собственная работа (общественное достояние) через Commons Wikimedia
2. «Цитозинметилирование» Ссридхар17 — собственная работа (CC BY-SA 4.0) через Commons Wikimedia
спиртов и эфиров | Химия
ЦЕЛИ ОБУЧЕНИЯ
К концу этого раздела вы сможете:
- Описать строение и свойства спиртов
- Опишите строение и свойства эфиров
- Назовите и начертите структуру спиртов и простых эфиров
Спирты
Включение атома кислорода в углерод- и водородсодержащие молекулы приводит к новым функциональным группам и новым семействам соединений.Когда атом кислорода связан одинарными связями, молекула представляет собой спирт или эфир.
Спирты представляют собой производные углеводородов, в которых группа –ОН заменяет атом водорода. Хотя все спирты имеют одну или несколько гидроксильных (–OH) функциональных групп, они не ведут себя как основания, такие как NaOH и KOH. NaOH и KOH — ионные соединения, содержащие ионы OH —. Спирты — ковалентные молекулы; группа –ОН в молекуле спирта присоединена к атому углерода ковалентной связью.
Этанол, CH 3 CH 2 OH, также называемый этиловым спиртом, является особенно важным спиртом для использования человеком. Этанол — это спирт, производимый некоторыми видами дрожжей, который содержится в вине, пиве и дистиллированных напитках. Его уже давно приготовили люди, использующие метаболические усилия дрожжей для ферментации различных сахаров:
Большие количества этанола синтезируются в результате реакции присоединения воды к этилену с использованием кислоты в качестве катализатора:
Могут быть получены спирты, содержащие две или более гидроксильных группы.Примеры включают 1,2-этандиол (этиленгликоль, используемый в антифризах) и 1,2,3-пропантриол (глицерин, используемый в качестве растворителя для косметики и лекарств):
Именование спиртов
Название спирта происходит от углеводорода, из которого он был получен. Окончательный — e в названии углеводорода заменяется на -ol , а атом углерода, с которым связана группа –OH, обозначается числом перед названием.
Пример 1
Именование спиртов
Рассмотрим следующий пример.Как его назвать?
Решение
Углеродная цепь содержит пять атомов углерода. Если бы гидроксильная группа отсутствовала, мы бы назвали эту молекулу пентаном. Чтобы решить тот факт, что гидроксильная группа присутствует, мы меняем окончание названия на –ol . В этом случае, поскольку –ОН присоединен к углероду 2 в цепи, мы назвали бы эту молекулу 2-пентанолом.
Проверьте свои знания
Назовите следующую молекулу:
Ответ: 2-метил-2-пентанол
эфиров
Простые эфиры — это соединения, содержащие функциональную группу –O–.У эфиров нет обозначенного суффикса, как у других типов молекул, которые мы до сих пор называли. В системе IUPAC атом кислорода и меньшая углеродная ветвь называются алкоксизаместителем, а остальная часть молекулы — основной цепью, как в алканах. Как показано в следующем соединении, красные символы представляют меньшую алкильную группу и атом кислорода, который будет называться «метокси». Более крупной углеродной ветвью будет этан, образующий молекулу метоксиэтана. Многие эфиры упоминаются под общими именами вместо системных имен IUPAC.Для общепринятых названий две ветви, связанные с атомом кислорода, называются отдельно, за ними следует –ether. Обычное название соединения, показанного в примере 2, — этилметиловый эфир:
.Пример 2
Именование эфиров
Укажите IUPAC и общее имя для показанного здесь эфира:
Решение
ИЮПАК: молекула состоит из этоксигруппы, присоединенной к цепи этана, поэтому название ИЮПАК будет этоксиэтан.
Общее: Обе группы, присоединенные к атому кислорода, являются этильными группами, поэтому общее название — диэтиловый эфир.
Проверьте свои знания
Укажите IUPAC и общее название для показанного эфира:
Ответ: ИЮПАК: 2-метоксипропан; обычный: изопропилметиловый эфир
Эфиры могут быть получены из спиртов путем отщепления одной молекулы воды от двух молекул спирта. Например, когда этанол обрабатывают ограниченным количеством серной кислоты и нагревают до 140 ° C, образуются диэтиловый эфир и вода:
В общей формуле простых эфиров R- O -R углеводородные группы (R) могут быть одинаковыми или разными.Диэтиловый эфир, наиболее широко используемое соединение этого класса, представляет собой бесцветную летучую жидкость, которая легко воспламеняется. Впервые он был использован в 1846 году в качестве анестетика, но теперь его место в значительной степени заняли более качественные анестетики. Диэтиловый эфир и другие простые эфиры в настоящее время используются в основном в качестве растворителей для камедей, жиров, восков и смол. Третичный -бутилметиловый эфир, C 4 H 9 OCH 3 (сокращенно МТБЭ — выделенные курсивом части названий не учитываются при ранжировании групп по алфавиту — поэтому бутил стоит перед метилом в общем названии). как добавка к бензину.МТБЭ принадлежит к группе химических веществ, известных как оксигенаты, из-за их способности увеличивать содержание кислорода в бензине.
Хотите попрактиковаться в присвоении имен эфирам? Этот краткий видеообзор обобщает номенклатуру эфиров.
Углеводы и диабет
Углеводы — это большие биомолекулы, состоящие из углерода, водорода и кислорода. Диетические формы углеводов — это продукты, богатые этими типами молекул, например паста, хлеб и конфеты.Название «углевод» происходит от формулы молекул, которые можно описать общей формулой C m (H 2 O) n , которая показывает, что они в некотором смысле являются «углеродом и водой» или «Гидраты углерода». Во многих случаях m и n имеют одинаковое значение, но могут быть разными. Меньшие углеводы обычно называют «сахарами», биохимический термин для этой группы молекул — «сахарид» от греческого слова, обозначающего сахар (рис. 1).В зависимости от количества соединенных вместе сахарных единиц они могут быть классифицированы как моносахариды (одна сахарная единица), дисахариды (две сахарные единицы), олигосахариды (несколько сахаров) или полисахариды (полимерная версия сахаров — полимеры были описаны в раздел, посвященный переработке пластмасс ранее в этой главе). Научные названия сахаров можно узнать по суффиксу –ose в конце названия (например, фруктовый сахар — это моносахарид, называемый «фруктоза», а молочный сахар — это дисахарид, называемый лактозой, состоящий из двух моносахаридов, глюкозы и галактозы. , соединены вместе).Сахара содержат некоторые из функциональных групп, которые мы обсуждали: Обратите внимание на спиртовые группы, присутствующие в структурах, и то, как моносахаридные звенья связаны с образованием дисахарида путем образования простого эфира.
Рис. 2. На рисунках показаны молекулярные структуры фруктозы, пятиуглеродного моносахарида, и лактозы, дисахарида, состоящего из двух изомерных шестиуглеродных сахаров.
Организмы используют углеводы для различных функций. Углеводы могут накапливать энергию, такую как полисахариды гликоген у животных или крахмал у растений.Они также обеспечивают структурную поддержку, такую как полисахаридная целлюлоза в растениях и модифицированный полисахарид хитин в грибах и животных. Сахара рибоза и дезоксирибоза являются компонентами скелета РНК и ДНК соответственно. Другие сахара играют ключевую роль в функции иммунной системы, в распознавании клеток и во многих других биологических функциях.
Диабет — это группа метаболических заболеваний, при которых у человека повышена концентрация сахара в крови (рис. 2).Диабет может быть вызван недостаточной выработкой инсулина поджелудочной железой или клетками организма, которые не реагируют должным образом на вырабатываемый инсулин. У здорового человека инсулин вырабатывается, когда он необходим, и выполняет функцию транспортировки глюкозы из крови в клетки, где ее можно использовать для получения энергии. Долгосрочные осложнения диабета могут включать потерю зрения, болезни сердца и почечную недостаточность.
По оценкам, в 2013 году примерно 3,3% населения мира (~ 380 миллионов человек) страдали диабетом, что приводило к более чем миллиону смертей ежегодно.Профилактика включает в себя здоровое питание, много физических упражнений и поддержание нормальной массы тела. Лечение включает в себя все эти методы образа жизни и может потребовать инъекций инсулина.
Рисунок 2. Диабет — это заболевание, характеризующееся высокой концентрацией глюкозы в крови. Лечение диабета включает изменение образа жизни, контроль уровня сахара в крови и иногда инъекции инсулина. (Источник: «Blausen Medical Communications» / Википедия)
Ключевые концепции и резюме
Многие органические соединения, не являющиеся углеводородами, можно рассматривать как производные углеводородов.Производное углеводорода может быть образовано заменой одного или нескольких атомов водорода углеводорода функциональной группой, которая содержит, по меньшей мере, один атом элемента, отличного от углерода или водорода. Свойства углеводородных производных во многом определяются функциональной группой. Группа –OH представляет собой функциональную группу спирта. Группа –R – O – R– представляет собой функциональную группу простого эфира.
Химия: упражнения в конце главы
- Почему гексан, гексанол и гексен имеют такие похожие названия?
- Напишите сокращенные формулы и укажите названия по ИЮПАК для следующих соединений:
- спирт этиловый (в напитках)
- спирт метиловый (используется в качестве растворителя, например, в шеллаке)
- этиленгликоль (антифриз)
- изопропиловый спирт, CH 3 CH (OH) CH 3 , используется в медицинском спирте)
- глицерин
- Дайте полное название ИЮПАК для каждого из следующих соединений:
- Дайте полное название ИЮПАК и общее название для каждого из следующих соединений:
- Запишите конденсированные структуры обоих изомеров по формуле C 2 H 6 O.Обозначьте функциональную группу каждого изомера.
- Запишите конденсированные структуры всех изомеров по формуле C 2 H 6 O 2 . Обозначьте функциональную группу (или группы) каждого изомера.
- Нарисуйте сокращенные формулы для каждого из следующих соединений:
- дипропиловый эфир
- 2,2-диметил-3-гексанол
- 2-этоксибутан
- МТБЭ, метил трет -бутиловый эфир, CH 3 OC (CH 3 ) 3 , используется в качестве источника кислорода в кислородсодержащих бензинах.МТБЭ получают путем реакции 2-метилпропена с метанолом.
- Используя структуры Льюиса, напишите химическое уравнение, представляющее реакцию.
- Какой объем метанола плотностью 0,7915 г / мл требуется для производства ровно 1000 кг МТБЭ при 100% выходе?
- Напишите два полных сбалансированных уравнения для каждой из следующих реакций, одно с использованием сжатых формул и одно с использованием структур Льюиса.
- пропанол превращается в дипропиловый эфир Пропен
- обрабатывают водой в разбавленной кислоте.
- Напишите два полных сбалансированных уравнения для каждой из следующих реакций, одно с использованием сжатых формул и одно с использованием структур Льюиса.
- 2-бутен обрабатывают водой в разбавленной кислоте Этанол
- дегидратируют с получением этена
Избранные ответы
2. (а) этиловый спирт, этанол: CH 3 CH 2 OH
(б) метиловый спирт, метанол: CH 3 OH
(c) этиленгликоль, этандиол: HOCH 2 CH 2 OH
(d) изопропиловый спирт, 2-пропанол: CH 3 CH (OH) CH 3
(д) глицерин, 1,2,3-тригидроксипропан: HOCH 2 CH (OH) CH 2 OH
4.{2} \ text {L} \ end {array} [/ latex]
10. (a) [латекс] {\ text {CH}} _ {3} \ text {CH} = {\ text {CHCH}} _ {3} + {\ text {H}} _ {2} \ текст {O} \ rightarrow {\ text {CH}} _ {3} {\ text {CH}} _ {2} {\ text {CH (OH) CH}} _ {3} [/ latex]
(b) [латекс] {\ text {CH}} _ {3} {\ text {CH}} _ {2} \ text {OH} \ rightarrow {\ text {CH}} _ {2} = {\ текст {CH}} _ {2} + {\ text {H}} _ {2} \ text {O} [/ latex]
Глоссарий
спирт
органическое соединение с гидроксильной группой (–OH), связанной с атомом углерода
эфир
органическое соединение с атомом кислорода, связанным с двумя атомами углерода
| Метанол | 3D |
Метанол , также известный как метиловый спирт и древесный спирт , самый простой из спиртов.Имя происходит от греческих слов «мети» (вино) и «хуле». (древесина). Метанол содержится в древесном дыме и способствует запах вина. Метаболизируется в организм вырабатывает формальдегид и муравьиную кислоту, и токсичен, если более 50 расходуется мл; меньшие количества могут вызвать слепоту. В промышленности метанол получают путем синтеза . газ , смесь окиси углерода и водорода, полученная из кокса ( уголь, а не сода) или метан.Метанол используется в качестве топлива в некоторых гоночных автомобилей, и исследуется как возобновляемая альтернатива использование топлива на нефтяной основе. Однако в основном метанол используется при производстве других химикатов, таких как формальдегид, который используется при производстве пластмасс, красок, фанеры и т. д. | |
| Этанол | 3D |
| Скачать 3D | |
Этанол , также известный как этиловый спирт и зерновой спирт — это спирт, содержащийся в алкогольных напитках.Ферментация сахар, содержащийся в меде, зерне или фруктовые соки на дрожжах для производства пива и вина были, вероятно, первым химическим веществом. реакция должна быть обнаружена. Этанол можно очищать и концентрируется фракционной перегонкой, но этанол и вода образуют азеотроп постоянного кипения с концентрацией 95% этанола и 5% воды которые нельзя отделить перегонкой; абсолютный этанол , который не содержит воды, производится фракционной перегонкой 95% этанола с небольшим количеством бензола.Этанол, предназначенный для промышленное использование «денатурируется» (становится непригодным для употребления в пищу) добавление небольшого количества метанола, бензоата денатония или других неприятных или токсичные вещества, освобождающие алкоголь от уплаты налогов на спиртные напитки. Этанол метаболизируется в организме, главным образом ферментом алкогольдегидрогеназа , чтобы произвести ацетальдегид; накопление ацетальдегида в крови является одним из факторов, которые способствует появлению симптомов похмелья.С физиологической точки зрения этанол действует как депрессант, но поскольку он освобождает части коры от тормозящего контроля, для своего потребителя, это кажется стимулятором. Этанол — это первичный (1) спирт, и легко окисляется мягкими окислителями, такими как хромовая кислота (H 2 CrO 4 ) или дихромат калия (K 2 Cr 2 O 7 ), в что хром находится в степени окисления +6. Эти вещества претерпевают отчетливое изменение цвета при реакции с этанолом: в +6 степень окисления соединения хрома обычно темного цвета. красновато-оранжевый цвет; после окисления спирта хром восстановлен до степени окисления +3, что означает зеленый цвет.Цвет переход от красно-оранжевого к зеленому составляет основу некоторых простых алкотестеры, которые используются для проверки автомобилистов, подозреваемых в вождение в нетрезвом виде. Этанол также может окисляться на воздухе, образуя уксусную кислоту, активный ингредиент уксуса. Алкогольный напитки, которые не хранятся должным образом, могут иметь привкус уксуса из-за образования уксусной кислоты (см. запись для уксусной кислоты). | |
| 1-пропанол (пропиловый спирт) | 3D |
| Скачать 3D | |
1-пропанол или пропиловый спирт , представляет собой трехуглеродный спирт с группой ОН на конце углерода.Его структурный изомер, 2-пропанол, описан ниже. | |
| 2-пропанол (изопропиловый спирт) | 3D |
| Скачать 3D | |
2-пропанол или изопропиловый спирт , представляет собой трехуглеродный спирт с группой ОН на среднем углероде. Изопропиловый спирт — вторичный спирт, Медицинский спирт представляет собой раствор 70% изопропилового спирта и 30% воды, который обычно используется для стерилизации тампонов и дезинфицирующих средств. Изопропиловый спирт вторичный (2) спирт, легко окисляется мягкими окислителями. | |
| 1-бутанол (бутиловый спирт) | 3D |
| Скачать 3D | |
1-бутанол или бутиловый спирт , представляет собой четырехуглеродная цепь с группой ОН на конце углерода.Это использовано в качестве растворителя и разбавителя для краски, а также может использоваться в качестве биотопливо. Бутиловый спирт первичный (1) спирт, легко окисляется. Есть три других структурных изомера 1-бутанола: 2-бутанол ( сек -бутиловый спирт), 2-метил-1-пропанол (изобутиловый спирт) и 2-метил-2-пропанол ( трет-бутиловый спирт ). | |
| 2-бутанол ( сек -бутил спирт) | 3D |
| Скачать 3D | |
2-бутанол , или сек -бутанол , или sec -бутиловый спирт или s -бутиловый спирт , представляет собой четырехуглеродная цепь с группой ОН на втором углероде.(С спиртовой углерод связан с двумя другими атомами углерода, он вторичен, отсюда и приставка «сек».) Он используется как растворитель и полупродукт при производстве других соединений. сек -Бутиловый спирт вторичный (2) спирт, легко окисляется. 2-Бутанол — хиральное соединение, существует в двух энантиомерные формы: (R) -2-бутанол и (S) -2-бутанол: | Трехмерная структура, показанная выше, представляет собой стереоизомер R . |
| 2-метил-1-пропанол (Изобутиловый спирт) | 3D |
| Скачать 3D | |
2-метил-1-пропанол или изобутанол или изобутиловый спирт , представляет собой трехуглеродную цепь с группой ОН и концевой углерод и метильная группа на среднем углероде.Он используется как растворитель, в красках и чернилах, а также при производстве некоторых покрытий и лаки. Изобутиловый спирт — первичный (1) спирт, легко окисляется. | |
| 2-метил-2-пропанол ( трет -бутил спирт) | 3D |
| Скачать 3D | |
2-метил-2-пропанол или трет -бутанол , или трет -бутиловый спирт , или t -бутиловый спирт , представляет собой трехуглеродную цепь с группой ОН и метильной группой на средний углерод.(Поскольку спиртовой углерод связан с тремя другие атомы углерода, это третичный, отсюда и префикс «трет».) используется в качестве растворителя, денатурирующего агента для этанола, в качестве усилителя октанового числа в бензин и в некоторых болеутоляющих. трет -Бутиловый спирт третичный (3) спирт, не вступает в реакцию с окислителями. Это полезно в органический синтез в виде аниона-бутоксида t , который образуется при реакции трет -бутанола с натрием или сильным основание, такое как гидрид натрия, который удаляет слабокислый водород от группы ОН, оставляя отрицательный заряд на кислороде. Бутоксид-анион t является сильным основанием, но его стерический объем делает он медленно участвует в реакциях нуклеофильного замещения, что делает его с большей вероятностью будет участвовать в реакциях элиминации. | |
| Этиленгликоль (1,2-этандиол) | 3D |
| Скачать 3D | |
| 1,2-этандиол , более известный как этиленгликоль , представляет собой
спирт, содержащий две группы ОН.Молекулы, содержащие два ОН
группы на соседних атомах углерода часто известны как гликоли . это
Вязкая бесцветная жидкость со сладким запахом и запахом. это
смешивается с водой, так как в молекуле есть два места, которые
может образовывать водородные связи с водой. Обладает чрезвычайно высокой температурой кипения.
точка для такой маленькой молекулы, 197 ° C; это
потому что эти молекулы могут образовывать более одного набора водородных связей с
друг с другом. Этиленгликоль промышленно производят из этилен: этилен окисляется с образованием оксида этилена, который реагирует с водой с образованием этиленгликоля. Он используется в производство полиэфирного полиэтилентерефталана (ПЭТ), а также для удаления водяного пара из природного газа. Этиленгликоль используется в антифриз — чистый этиленгликоль замерзает при -12,9 ° C (8,8 ° F), но смесь 50:50 этиленгликоль и вода замерзают при температуре около -40 ° C (-40 ° F).Он также используется как антиобледенитель самолета, увлажнитель (средство против высыхания, которое удерживает другие вещества во влажном состоянии), используемое в чернилах для шариковых ручек. Этиленгликоль токсичен; в организме метаболизируется в гликолевую кислота (если одна спиртовая группа окисляется до карбоновой кислоты) и щавелевая кислоты (если обе группы спирта окислены), которая может вызвать нерегулярное сердцебиение и дыхание, а также почки отказ. Противоядием при отравлении этиленгликолем является этанол: поскольку этанол конкурирует за тот же фермент алкогольдегидрогеназа, что метаболизирует этиленгликоль, наполнение организма алкоголем может помочь промойте этиленгликоль из системы. | |
| Пропиленгликоль (1,2-пропандиол) | 3D |
| Скачать 3D | |
1,2-пропандиол или пропиленгликоль , представляет собой безвкусная, без запаха, прозрачная жидкость.Как и этиленгликоль, он смешивается с водой из-за водородных связей. Он используется в антифриз, как увлажняющий крем в лосьонах, продуктах питания, некоторых лекарствах и косметика, а также как растворитель пищевых красителей. Он также используется для изготовления искусственный дым. | |
| Глицерин / Глицерин (1,2,3-пропанетриол) | 3D |
1,2,3-пропанетриол , более известный как глицерин или глицерин , представляет собой вязкую, бесцветную, без запаха, сладкую на вкус жидкость.Используется как смягчающее средство (смягчающее средство) в косметике; как увлажнитель (средство против высыхания) в зубной пасте, конфетах, лекарствах, табаке (где предотвращает высыхание листьев и крошится), и клеи (предотвращают высыхание клея в бутылке). это также используется в некоторых пластмассах, особенно в целлофане, в качестве пластификатора для держите пластик мягким и податливым. Глицерин также способствует сладкий, мягкий вкус некоторых вин. Потому что он может образовывать три набора водородных связей, он чрезвычайно растворим в воде и имеет очень высокий точка кипения (290 ° C). Глицерин соединяется с жирными кислотами (длинноцепочечные карбоновые кислоты), образуя образуют ряд биологически важных молекул, называемых триглицеридами , (жиры и масла). | Скачать 3D |
| Бензиловый спирт | 3D |
| Скачать 3D | |
Бензиловый спирт или фенилметанол используется в парфюмерии, ароматизаторах, мыло, косметика, мази и чернила для шариковых ручек; он также используется в некоторые лекарства от зуда. | |
| Коричный спирт | 3D |
| Скачать 3D | |
Коричный спирт , или коричный спирт, содержится в листья корицы (отсюда и название), обычно в виде сложного эфира; это также содержится в толуском бальзаме, смоле Myroxylon toluifera дерево.Он имеет запах, похожий на запах гиацинта, и используется в парфюмерии. (особенно в сиреневых и других цветочных ароматах), дезодоранты, ароматизаторы средство, мыло и косметика. | |
| Диэтиленгликоль | 3D |
| Скачать 3D | |
| Диэтиленгликоль (DEG) — используемая токсичная жидкость без цвета и запаха.
в качестве промышленного растворителя, а также при синтезе других органических
молекулы.Он также используется в качестве увлажнителя для табака, а некоторые
чернила и клеи. В 1937 г. Выход на рынок Massengill Co. сульфаниламид (сульфамидный препарат), растворенный в диэтиленгликоле как «Эликсир Сульфаниламид »; более ста человек умерли от отравления ДЭГ, и этот инцидент послужил катализатором принятия Федерального закона 1938 г. Закон о косметике, который значительно расширил возможности пищевых продуктов и лекарств. Администрация (FDA) по регулированию безопасности пищевых продуктов, лекарств и косметические средства.Несколько других случаев отравления ДЭГ возникли в результате DEG либо добавляют в вина в попытке подсластить их, либо из-за его присутствия в неправильно очищенных лекарствах и косметические средства. В мае 2007 года несколько дешевых марок зубной пасты происходящие из Китая были сняты с рынка в нескольких странах потому что они были загрязнены ДЭГ (помечены на контейнеры как «глицерин»). | |
| Грандисоль | 3D |
| Скачать 3D | |
| Грандисол , или (+) — (1 R , 2 S ) -1- (2′-гидроксиэтил) -1-метил-2-изопропенилциклобутан, представляет собой феромон, который действует как сексуальный аттрактант хлопкового долгоносика. ( Anthonomus grandis ) и некоторых родственных насекомых.Это использовано в инсектициде под названием grandlure , который привлекает и улавливает или убивает этих вредных насекомых. | |
| Циклогексанол | 3D |
| Скачать 3D | |
Циклогексанол — циклический вторичный спирт. Он используется в некоторых реакциях органического синтеза, при производстве целлулоид, текстиль и некоторые инсектициды. | |
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
.


 Опыт не даст достоверных результатов, когда в алкогольном напитке присутствуют дополнительные добавки. Они также могут привести к окрашиванию корнеплода в разные оттенки.
Опыт не даст достоверных результатов, когда в алкогольном напитке присутствуют дополнительные добавки. Они также могут привести к окрашиванию корнеплода в разные оттенки.

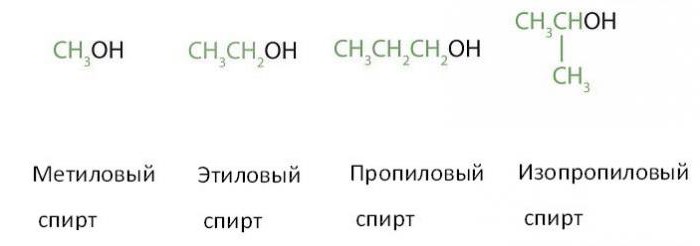 При этом метанол не окисляется и постепенно выводится из организма.
При этом метанол не окисляется и постепенно выводится из организма.  5 М (растворен в растворе йодида калия 0,2 М)
5 М (растворен в растворе йодида калия 0,2 М)
 Если существует цепь с большим количеством атомов углерода, чем та, которая содержит группу ОН, она будет названа заместителем.
Если существует цепь с большим количеством атомов углерода, чем та, которая содержит группу ОН, она будет названа заместителем.