Современные раневые покрытия
По статистике 40% пациентов хирургических отделений больниц России составляют пациенты с ранами. В связи с этим раневые покрытия являются одной из важнейших групп медицинских изделий, находящихся в обращении на территории Российской Федерации.
Применение современных раневых покрытий основано на принципе «влажного заживления раны». Влажная абактериальная среда является оптимальной для поддержания нормального деления клеток в ране, а также обеспечивает высокую активность раневых протеаз – ферментов, ответственных за быстрое очищение раневой поверхности. Кроме того, во влажной среде предотвращается высыхание нервных окончаний и, тем самым, заметно уменьшается болевой синдром.
По структуре выделяют следующие виды раневых покрытий:
- Пленочные раневые покрытия.
Такие покрытия состоят из прозрачного тонкого листка полимера, покрытого с одной стороны клеем. Существуют простые пленочные покрытия и содержащие активные вещества. Так, в состав активных пленочных покрытий могут входить:
Показаниями к применению данного вида покрытий служат чистые раны на стадии эпителизации с низкой или умеренной степенью экссудации.
- Гидроколлоидные покрытия.
Гидроколлоидные покрытия выпускаются в виде пластин или аморфной массы. Пластины представляют собой тонкую полиуретановую губку или пленку, которая при контакте с раневой поверхностью переходит в желеобразное состояние, сорбируя раневой секрет. Применяются такие покрытия на слабо и умеренно экссудирующих ранах.
- Альгинаты.
Альгинатные раневые покрытия представляют собой биодеградирующие раневые покрытия, производимые из морских водорослей. В состав таких раневых покрытий входят кальциевые альгинатные соли, нерастворимые в воде, которые при взаимодействии с раневым секретом превращаются в альгинат натрия и образуют гель. Данный гель представляет собой оптимальную среду для размножения и миграции раневых клеток, чем и объясняются ранозаживляющие свойства альгинатных покрытий.
- Коллагеновые раневые покрытия.
Коллагеновые раневые покрытия используют, когда необходимо стимулировать рост грануляционной ткани и краевой эпителизации, плохо поддающихся лечению другими препаратами. Механизм действия коллагена на заживление ран обусловлен его стимулирующим влиянием на пролиферацию фибробластов и способностью превращаться на поверхности ран в мягкий гель, являющийся оптимальной средой для размножения и миграции раневых клеток.
- Гидроцеллюлярные раневые покрытия
Основным компонентом гидроцеллюлярных раневых покртыий является губка из синтетического материала. Обычно это пена из поролона или силикона. Разветвленная система пор
- Гидрогелевые покрытия
Гидрогелевые покрытия состоят из полимеров с гидрофильными центрами, благодаря чему они способны абсорбировать и удерживать в своей структуре значительное количество воды. Основное предназначение гидрогелей — гидратировать раневую поверхность, стимулируя тем самым аутолиз некротических тканей и защищая растущие грануляции и эпителий от высыхания. Это актуально, прежде всего, для «сухих» язв при облитерирующем атеросклерозе.
- Атравматические раневые покрытия
Атравматичные раневые покрытия представляют собой сетки или перфорированные пленки. Сетчатые атравматичные покрытия могут состоять из марли, пропитанной гидрофобным составом (парафин, вазелин, ланолин, триглицериды жирных кислот и др.). Некоторые атравматичные раневые покрытия содержат лекарственные вещества (например, антибиотик фузидат натрия). Выполняют двоякую роль. Во-первых, за счет того, что эти покрытия не прилипают ни к раневой поверхности, ни к вторичной впитывающей повязке, смена последней происходит безболезненно, без повреждения грануляций и эпителия. Во-вторых, покрытия, содержащие лекарственные вещества, повышают эффективность вторичной повязки.
- Сорбирующие покрытия
Обычно состоят из трех слоев. Первый — мягкая оболочка из неприклеивающегося к ране материала, легко проницаемого для раневого секрета, второй — сорбирующая прокладка и
Также существуют комбинированные раневые покрытия, объединяющие в себе свойства, например, альгинатных и гидроцеллюлярных покрытий.
Таким образом, столь широкое разнообразие раневых покрытий свидетельствует об актуальности проблемы лечения ран и о важности данной группы медицинских изделий на российском рынке.
Статьи по теме:
Современные раневые покрытия часть 1
Современные раневые покрытия часть 2
Похожее
Современные перевязочные средства и раневые покрытия
Мазевые повязки;
- «Branolind» (USA), мазевая повязка на тканной основе, пропитанная перуанским бальзамом;
- «Atrauman», гидрофобный материал, пропитанный нейтральным жиром;
- «Grassolind neutral» — крупноячеистая ткань, пропитанная индиферентной жировой основой;
- «Pyolysin» (Германия).
Мази:
- левомиколь, левосин (Россия), дермазин (Словения), далацин (США), Д-Пантенол (Хорватия).
- Альгинины;
Производятся из морских бурых водорослей. Являются гидрофильными материалами и соединяясь с эксудатом раны превращяются в гелеобразный материал.
«Sorbalgon» (Германия).
Адсорбирующие повязки;
- «ВоскоСорб» (Россия) — полиэфирное нетканное волокно, покрытое чистым пчелиным воском и прополисом в комбинации с сорбирующим слоем из хлопка и вискозы.
- «Mepilex lite» (Швеция) — адсорбирующее мягкое покрытие из пористого силикона.
- «Mepitel» (Швеция) — атравматичная повязка с мягким силиконовым покрытием сетчатой структуры, поверх которой накладывается адсорбирующая эксудат повязка.
- «Актисорб Плюс 25» (США) состоит из 2-х слойной оболочки из нетканного нейлона, между слоями которой проложен активированный уголь, насыщенный серебром.
Гелевые покрытия;
- «Гелепран» (Россия) — атравматичная, термо- и формоустойчивая раневая гелевая повязка. Выпускается в чистом виде и с мирамистином.
- Гидроколлоиды:
Прозрачные гидрогелевые повязки с верхним слоем из воздухопроницаемой, препятствующей проникновению микроорганизмов и влаги пленки. Нижний слой повязки — гидрогелевый:
- Hydrosorb (США), Hydrocoll (США)
- Лита-Цвет(Россия) — повязка марлевая, пропитанная раствором эксолина.
- «Гиаплюс» (Россия) — повязки на основе гиалуроновой кислоты и фибринных покрытий.
- Aguacel Ag (Англия). Сухая повязка, основанная на технологии Hydrofiber адсорбирует эксудат и превращается в гель с ионами серебра.
- Пленки;
- Полупроницаемые полиуретановые пленки, проницаемые для газов и непроницаемые для жидкостей. На поверхности имеют поры величиной около 2 мкм. Сквозь эти поры происходит газообмен между раневой поверхностью и средой, но для проникновения микроорганизмов они слишком малы.
- Silon-TSR, Telfa, Protective Dressing (USA).
- «Op-Site», «Tegaderm», «Cutinova hydro», Omiderm (США).
- Пленкообразующие аэрозоли: Лифузоль, Статизоль, Наксол.
При покрытии ран непроницаемыми для воды и бактерий пленками, которые позволяют осуществляться нормальному газообмену, в ране создается влажная среда, которая стимулирует выведение продуктов аутолиза некротизированных тканей и разрушение избытка коллагена.
На пленках также выращивается культура кератиноцитов и фибробластов. Такие клеточные композиции накладываются клетками вниз на рану. Благодаря действию цитокинов происходит качественная и быстрая эпителизация.
Пленки: «Биокол», «Фолидерм» (Россия).
Пантенол, Олазоль, Диоксизоль, (Россия).
- Комбинированные средства;
Коллагеновые губки:
Раневые покрытия на коллагене, в состав которых входят различные биостимулирующие, антисептические, бактерицидные компоненты не требуют ежедневных перевязок, самостоятельно лизируются.
- Губка коллагеновая с сангвиритрином (Россия).
- «Метуракол» (Россия). — коллагеновая губка с метилурацилом
- «Альгикол» (Россия) — коллагеновая губка с фурагином.
- Пористая пластина «Комбутек» (Россия) с коллагеном, борной кислотой и др.
- «Дигиспон» (Россия) — пластина с коллагеном, диоксидином. глутаровым альдегидом и др.
- «Альгипор» (Россия) — губка с альгинатами.
- Губка «Колоцил» (Россия), с коллагеном, фурациллином, новокаином и др.
- «Коллахит-ФА» (Россия). В состав входит коллаген-хитозановый комплекс с добавлением фурагина и анилокаина.
- «ВоскоПран» (Россия). Мазевая повязки на эластично-сетчатой основе, пропитана пчелиным воском и прополисом. Выпускается несколько вариантов: без дополнительного лекарственного средства, с 10% метилурациловой мазью, с левомиколем. Пациентам с аллергией на продукты пчеловодства применять не рекомендуется!
- «ПараПран» (Россия). Атравматичная повязка из хлопчатобумажного волокна, пропитана парафином. Выпускается в нескольких вариантах: в чистом виде без лекарственных средств, с хлоргексидином, химотрипсином, лидокаином.
- «Коллост» (Россия). Коллагеновая мембрана.
Одним из вариантов лечебных средств для ведения рубцов кожи после шлифовки являются гели. Гелевые лечебные формы — это безжировые влагоемкие композиции, в состав которых помимо гидрофильной основы входят различные компоненты. К гелям, которые могут быть использованы для лечения раневых поверхностей, предъявляются особые требования. Известно, что раны, сохраненные во влажном, антисептическом состоянии имеют оптимальные условия для эпителизации. Более того, в опытах на животных и на эмбрионах плода человека доказана возможность безрубцового заживления ран, которые ведутся во влажной среде.
Гелевые композиции, которые можно использовать в качестве раневых покрытий должны быть абсолютно биологически совместимы с тканями, не вызывать токсико-аллергических реакций, обладать антисептическими и иммуностимулирующими свойствами, какое-то время сохранять раневую поверхность во влажном состоянии, по прошествии которого превращаться в воздухопроницаемую пленку. На сегодняшний день, на наш взгляд, такими свойствами обладает только препарат гель «Куриозин гель» (Гедеон Рихтер А.О., Венгрия), на основе гиалуроната цинка. Основным действующим веществом препарата является гиалуронат цинка. Гиалуроновая кислота (ГК), входящая в состав препарата представляет собой натуральный мукополисахарид, составляющий основу мукополисахаридов дермы человека. Кроме того, гиалуроновая кислота не является видоспецифическим веществом, поэтому, полученная любым способом и из любого вида ткани, воспринимается организмом, как собственная. Гиалуроновая кислота в куриозине получена из гребешков кур. Известно, что 1 молекула гиалуроновой кислоты удерживает возле себя около 500 молекул воды, за счет чего она является супергидрофильной субстанцией. Гиалуроновая кислота обладает также как и микроэлемент цинк иммуномодулирующим действием. Ко всем перечисленным свойствам, привлекательность куриозина для лечения поверхностей после шлифовки или после удаления различных доброкачественных образований кожи, или после оперативных вмешательств состоит в том, что пациенты могут сами пользоваться этим препаратом. Особенно это актуально, когда посещение врача для перевязок оказывается по какой-то причине невозможным. Мы рекомендуем пациентам несколько раз в день аккуратно выдавливать гель на раневую поверхность и распределять его уголком стерильной салфетки и они с успехом справляются с этой задачей.
Рекомендации по уходу за раневыми поверхностями после шлифовки с помощью геля Куриозин.
Сразу после операции дермабразии рубца, промывании и высушивании раневой поверхности, мы смазываем толстым слоем всю эрозивную поверхность гелем и в таком виде отпускаем пациента домой или, если поверхности большие (все лицо), оставляем в стационаре. Разумеется, такое ведение раневых поверхностей возможно только на открытых участках тела. Раневая поверхность выглядит незащищенной, однако этого не нужно опасаться, так как гель, как мы уже говорили, обладает защитным и иммуностимулирующим действием. В этот день и на следующий рекомендуется обрабатывать поверхность шлифовки каждые 1,5-2 часа, чтобы создать наиболее благоприятные условия клеткам кожи для взаимодействия и обмена информацией. К концу вторых суток, как правило, на месте шлифовки начинает образовываться эластичная корочка. Несмотря на это, ее продолжаем обрабатывать, но уже более редко- 2-3 раза в день до полного отпадения корки через 6-8 дней.
Рекомендации по работе с другими гелями аналогичны.
- «Солкосериловое (актовегиновое) желе» (Болгария).
- Хитозановый гель, «Арговасна» (Россия).
Русские ученые разработали уникальную технологию перевода хитозана из линейной в микрогранулированную форму, что позволило уменьшить размеры молекулы более чем в 8 раз. Таким образом, во много раз была увеличена проницаемость хитозана через кожу. По химическому строению он родственен целлюлозе и представляет собой природный полисахарид 1,3-бетта-глюкан. Связываясь с клеточной стенкой бактерий, грибов и вирусов проявляет свою фунгицидную, противовирусную и бактерицидную активность. При накожном применении проявляет также регенерирующее, иммуностимулирующее и гемостатическое действие. Есть данные о его противоопухолевых свойствах. Благодаря высокой влагоудерживающей способности хитозан взаимодействуя с белками и липидами эпидермиса, образует связанную с ними пленку. В результате прекращается трансдермальная потеря кожей воды и в ране создается влажная среда, необходимая для оптимального клеточного взаимодействия и эпителизации. Хитозановые композиции оказываются весьма эффективны после различных видов шлифовки и ведения послеоперационных швов. Хитозановый гель можно использовать не только путем нанесения на кожу, но и для введения с помощью микрогальваники и электрофореза с положительного полюса. Рекомендуется использовать по аналогичной с куриозином методике.
- «Алоэ Вера гель» (США).
О иммуностимулирующих, адсорбирующих, бактерицидных, регенерирующих и увлажняющих свойствах Алоэ Вера известно давно. Благодаря уникальным свойствам алоэ создает в ране условия для быстрой репарации. Используется по аналогии с куриозином.
- Аллогенная кожа и ее заменители.
Аллогенная свежая и трупная кожа могла бы стать идеальным биологическим покрытием, если бы не сложности с получением. Она может долго храниться в замороженном состоянии. Относится данный вид раневого покрытия к биологическим, совместимо с тканями реципиента. После наступления эпителизации раны, покрытие отторгается.
- «AlloDerm», (Integra).
- Ксенодерма (Россия).
Из ксеногенной кожи используется кожа свиньи, так как ткани свиньи и человека близки по своему строению. Так же как и трупная кожа, она отторгается после эпителизации раневой поверхности.
Из раневых покрытий, близких к данной группе и имеющих очень высокий ранозаживляющий потенциал, следует отметить пленки из амниона. Они также относятся к биологическим раневым покрытиям, обладают бактериостатическим действием, стимулируют синтез проколлагена, эластичны, легко ложатся на раневую поверхность, прозрачны, что позволяет наблюдать за состоянием раневой поверхности и реэпителизацией.
Культивируемые заменители кожи: «Фибродермис», «Фибропор» (Россия).
- Другие технологии.
- Возможен уход за раневыми поверхностями открытым способом с многократным обмыванием водой или физиологическим раствором. Можно сочетать с обработкой пантенолом, бепантеном, солкосерилом.
- Можно также вести раневые поверхности под стерильным вазелином, порошком висмута и др.
- В научной литературе даже есть сведения об использовании в качестве биологического раневого покрытия кожуры вареной картошки, которую обрабатывают, стерилизуют и достаточно широко используют для лечения ожогов в развивающихся странах (138).
- Обработку ран антисептиками местного действия также можно рассматривать, как один из простых вариантов ухода за раневыми поверхностями. В связи с появлением новых штаммов микроорганизмов, резистентных к антибиотикам в профилактике и лечении раневой инфекции все более возрастает практическое значение химических дезинфицирующих средств.
«Лавасепт» (Россия) — антисептик местного действия, разводится 1 мл. в 1 литре дистиллированной воды (0,1 % раствор). Рана обрабатывается аспирационно-промывным методом, после чего салфетка, смоченная в растворе оставляется в ране до следующей перевязки.
 [1], [2], [3], [4], [5], [6], [7]
[1], [2], [3], [4], [5], [6], [7]
Современные раневые покрытия. Лекция 2.
Б. Анатомия кожи и подкожных тканей
 Б. Анатомия кожи и подкожных тканей А. КОЖА 1. Эпидермис a. Роговой слой б. Ростковый слой в. Базальная мембрана 2. Дерма (фиброзная соединительная ткань и сосуды) Б. ГИПОДЕРМА (жировая и соединительная
Б. Анатомия кожи и подкожных тканей А. КОЖА 1. Эпидермис a. Роговой слой б. Ростковый слой в. Базальная мембрана 2. Дерма (фиброзная соединительная ткань и сосуды) Б. ГИПОДЕРМА (жировая и соединительная
ОПРЕДЕЛЕНИЕ ПОНЯТИЯ «ХРОНИЧЕСКАЯ РАНА»
 ОПРЕДЕЛЕНИЕ ПОНЯТИЯ «ХРОНИЧЕСКАЯ РАНА» Единого определения понятия «хроническая рана» до сих пор не существует. Принято считать хронической рану, существующую более 4 недель без признаков активного заживления.
ОПРЕДЕЛЕНИЕ ПОНЯТИЯ «ХРОНИЧЕСКАЯ РАНА» Единого определения понятия «хроническая рана» до сих пор не существует. Принято считать хронической рану, существующую более 4 недель без признаков активного заживления.
Ведение ран в паллиативной медицине
 Ведение ран в паллиативной медицине г.москва, 20 марта 2019 года Докладчик: Марк Азриельевич Вайсман, к.м.н., доцент кафедры паллиативной медицины МГМСУ им. А.И. Евдокимова, Москва ОПРЕДЕЛЕНИЕ ПОНЯТИЯ
Ведение ран в паллиативной медицине г.москва, 20 марта 2019 года Докладчик: Марк Азриельевич Вайсман, к.м.н., доцент кафедры паллиативной медицины МГМСУ им. А.И. Евдокимова, Москва ОПРЕДЕЛЕНИЕ ПОНЯТИЯ
МЕТОДЫ ИММОБИЛИЗАЦИИ. Лекция 3
 МЕТОДЫ ИММОБИЛИЗАЦИИ Лекция 3 План лекции 1. Классификация методов иммобилизации. Способы физической и химической иммобилизации биокатализаторов. 2. Адсорбционная иммобилизация: типы носителей, природа
МЕТОДЫ ИММОБИЛИЗАЦИИ Лекция 3 План лекции 1. Классификация методов иммобилизации. Способы физической и химической иммобилизации биокатализаторов. 2. Адсорбционная иммобилизация: типы носителей, природа
Современные средства для ухода за ранами
 Современные средства для ухода за ранами На шаг впереди в лечении ран Уход за ранами Содержание ИНФИЦИРОВАННЫЕ И КРИТИЧЕСКИ КОНТАМИНИРОВАННЫЕ РАНЫ Антисептик для ран Лавасепт 3 Раствор и гель для очищения
Современные средства для ухода за ранами На шаг впереди в лечении ран Уход за ранами Содержание ИНФИЦИРОВАННЫЕ И КРИТИЧЕСКИ КОНТАМИНИРОВАННЫЕ РАНЫ Антисептик для ран Лавасепт 3 Раствор и гель для очищения
Ткани человеческого организма
 Ткани человеческого организма Ткань эволюционно сложившаяся совокупность клеток и межклеточного вещества, обладающая общностью строения, развития и выполняющая определенные функции. В человеческом организме
Ткани человеческого организма Ткань эволюционно сложившаяся совокупность клеток и межклеточного вещества, обладающая общностью строения, развития и выполняющая определенные функции. В человеческом организме
SENSATION LIFT MASK NEW SENSATION LIFT MASK
 ПРЕЗЕНТАЦИЯ NEW СТОИТ ПОПРОБОВАТЬ, ЧТОБЫ ПРИЯТНО УДИВИТЬСЯ! Ощутите на себе силу лифтинга этой маски, преображение здесь и сейчас! В составе маски уникальные пептиды, которые противодействуют обвисанию
ПРЕЗЕНТАЦИЯ NEW СТОИТ ПОПРОБОВАТЬ, ЧТОБЫ ПРИЯТНО УДИВИТЬСЯ! Ощутите на себе силу лифтинга этой маски, преображение здесь и сейчас! В составе маски уникальные пептиды, которые противодействуют обвисанию
Уж если медь, гранит, земля и море Не устоят, когда придет им срок, Как может уцелеть, со смертью споря, Краса твоя беспомощный цветок?
 Уж если медь, гранит, земля и море Не устоят, когда придет им срок, Как может уцелеть, со смертью споря, Краса твоя беспомощный цветок? ИННОВАЦИОННАЯ ФОРМУЛА ШВЕЙЦАРСКИХ КОСМЕТОЛОГОВ ПРОТИВ СТАРЕНИЯ. Разглаживающий
Уж если медь, гранит, земля и море Не устоят, когда придет им срок, Как может уцелеть, со смертью споря, Краса твоя беспомощный цветок? ИННОВАЦИОННАЯ ФОРМУЛА ШВЕЙЦАРСКИХ КОСМЕТОЛОГОВ ПРОТИВ СТАРЕНИЯ. Разглаживающий
ТЕХНОЛОГИИ МОЛОДОСТИ 2016 СЕРИЯ МАТРИКСИЛ
 ТЕХНОЛОГИИ МОЛОДОСТИ 2016 СЕРИЯ МАТРИКСИЛ ПРОБЛЕМЫ УВЯДАЮЩЕЙ КОЖИ ВОЗРАСТНАЯ ПИГМЕНТАЦИЯ СНИЖЕНИЕ ТОНУСА, УПРУГОСТИ И ЭЛАСТИЧНОСТИ КОЖИ ГЛУБОКИЕ И МЕЛКИЕ МОРЩИНЫ ГРАВИТАЦИОННЫЙ ПТОЗ СУХОСТЬ И ИСТОНЧЕНИЕ
ТЕХНОЛОГИИ МОЛОДОСТИ 2016 СЕРИЯ МАТРИКСИЛ ПРОБЛЕМЫ УВЯДАЮЩЕЙ КОЖИ ВОЗРАСТНАЯ ПИГМЕНТАЦИЯ СНИЖЕНИЕ ТОНУСА, УПРУГОСТИ И ЭЛАСТИЧНОСТИ КОЖИ ГЛУБОКИЕ И МЕЛКИЕ МОРЩИНЫ ГРАВИТАЦИОННЫЙ ПТОЗ СУХОСТЬ И ИСТОНЧЕНИЕ
СОВРЕМЕННЫЕ СРЕДСТВА ДЛЯ УХОДА ЗА РАНАМИ
 СОВРЕМЕННЫЕ СРЕДСТВА ДЛЯ УХОДА ЗА РАНАМИ На шаг впереди в лечении ран СОДЕРЖАНИЕ ИНФИЦИРОВАННЫЕ И КРИТИЧЕСКИ КОНТАМИНИРОВАННЫЕ РАНЫ 3 Антисептик для ран Лавасепт 3 Раствор и мазь для лечения ран с антисептическим,
СОВРЕМЕННЫЕ СРЕДСТВА ДЛЯ УХОДА ЗА РАНАМИ На шаг впереди в лечении ран СОДЕРЖАНИЕ ИНФИЦИРОВАННЫЕ И КРИТИЧЕСКИ КОНТАМИНИРОВАННЫЕ РАНЫ 3 Антисептик для ран Лавасепт 3 Раствор и мазь для лечения ран с антисептическим,
Для тех, кому не все равно
 0% Для тех, кому не все равно БЕЗ SLS, SLES, парабенов, красителей, силиконов, отдушек, минеральных масел, вазелина ПРОДУКТЫ Dr. Sante «0 %» НЕ ВЫЗЫВАЮТ АЛЛЕРГИЧЕСКИХ РЕАКЦИЙ ДЕРМАТОЛОГИЧЕСКИ ПОДТВЕРЖДЕНО
0% Для тех, кому не все равно БЕЗ SLS, SLES, парабенов, красителей, силиконов, отдушек, минеральных масел, вазелина ПРОДУКТЫ Dr. Sante «0 %» НЕ ВЫЗЫВАЮТ АЛЛЕРГИЧЕСКИХ РЕАКЦИЙ ДЕРМАТОЛОГИЧЕСКИ ПОДТВЕРЖДЕНО
ПРИКОСНОВЕНИЕ ДЛЯ ВСЕХ ТИПОВ КОЖИ
 НЕЖНОЕ ШЕЛКА ПРИКОСНОВЕНИЕ ДЛЯ ВСЕХ ТИПОВ КОЖИ ШЕЛКОВЫЕ МАСКИ «EXTRA RICH» ПОКАЗАНИЯ К ПРИМЕНЕНИЮ ЭКСПРЕСС УХОД ДЛЯ ВСЕХ ТИПОВ КОЖИ ТОНКАЯ, ЧУВСТВИТЕЛЬНАЯ И ГИПЕРЧУВСТВИТЕЛЬНАЯ КОЖА КОЖА С ПРИЗНАКАМИ УВЯДАНИЯ
НЕЖНОЕ ШЕЛКА ПРИКОСНОВЕНИЕ ДЛЯ ВСЕХ ТИПОВ КОЖИ ШЕЛКОВЫЕ МАСКИ «EXTRA RICH» ПОКАЗАНИЯ К ПРИМЕНЕНИЮ ЭКСПРЕСС УХОД ДЛЯ ВСЕХ ТИПОВ КОЖИ ТОНКАЯ, ЧУВСТВИТЕЛЬНАЯ И ГИПЕРЧУВСТВИТЕЛЬНАЯ КОЖА КОЖА С ПРИЗНАКАМИ УВЯДАНИЯ
Иммобилизация животных клеток. Лекция 8
 Иммобилизация животных клеток Лекция 8 План лекции: 1. Типы культур животных клеток. Техника получения. 2. Преимущества культур животных клеток. Способы культивирования in vitro животных клеток. 3. Способы
Иммобилизация животных клеток Лекция 8 План лекции: 1. Типы культур животных клеток. Техника получения. 2. Преимущества культур животных клеток. Способы культивирования in vitro животных клеток. 3. Способы
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
 ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ *Имплантаты Имплантаты стерильная твердая лекарственная форма, имеющая подходящие для введения в ткани тела размеры и форму, предназначенная для имплантации и высвобождающая
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ *Имплантаты Имплантаты стерильная твердая лекарственная форма, имеющая подходящие для введения в ткани тела размеры и форму, предназначенная для имплантации и высвобождающая
РЕМПОЛ ТУ
 ТУ 20.30.12-003-52560990-2017 Описание материала Трехкомпонентная водно-уретановая шпатлевка для бетонных полов. Область применения Материал предназначен для ремонта и выравнивания бетонных полов как перед
ТУ 20.30.12-003-52560990-2017 Описание материала Трехкомпонентная водно-уретановая шпатлевка для бетонных полов. Область применения Материал предназначен для ремонта и выравнивания бетонных полов как перед
EUROTAFF/320 УПРОЧНИТЕЛЬ ГИДРОИЗОЛЯЦИЯ
 Техническая информация 2015 ОПИСАНИЕ МОНОКОМПОНЕНТ НА ОСНОВЕ ПОЛИЭСТОРОВ, АМИН И СМОЛ MDI (МЕТИЛЕНДИФЕНИЛДИИЗОЦИАНАТ). Применение: 1. Создание сухих строительных растворов 2. Капилярная гидроизоляция бетона
Техническая информация 2015 ОПИСАНИЕ МОНОКОМПОНЕНТ НА ОСНОВЕ ПОЛИЭСТОРОВ, АМИН И СМОЛ MDI (МЕТИЛЕНДИФЕНИЛДИИЗОЦИАНАТ). Применение: 1. Создание сухих строительных растворов 2. Капилярная гидроизоляция бетона
ШЕЛКОВЫЕ МАСКИ «EXTRA RICH»
 ШЕЛКОВЫЕ МАСКИ «EXTRA RICH» НЕЖНОЕ ШЕЛКА ПРИКОСНОВЕНИЕ ДЛЯ ВСЕХ ТИПОВ КОЖИ ШЕЛКОВЫЕ МАСКИ «EXTRA RICH» ПРИ КАКИХ ПРОБЛЕМАХ ПРИМЕНЯЮТСЯ ЭКСПРЕСС УХОД ДЛЯ ВСЕХ ТИПОВ КОЖИ ТОНКАЯ, ЧУВСТВИТЕЛЬНАЯ И ГИПЕРЧУВСТВИТЕЛЬНАЯ
ШЕЛКОВЫЕ МАСКИ «EXTRA RICH» НЕЖНОЕ ШЕЛКА ПРИКОСНОВЕНИЕ ДЛЯ ВСЕХ ТИПОВ КОЖИ ШЕЛКОВЫЕ МАСКИ «EXTRA RICH» ПРИ КАКИХ ПРОБЛЕМАХ ПРИМЕНЯЮТСЯ ЭКСПРЕСС УХОД ДЛЯ ВСЕХ ТИПОВ КОЖИ ТОНКАЯ, ЧУВСТВИТЕЛЬНАЯ И ГИПЕРЧУВСТВИТЕЛЬНАЯ
Омолаживающий крем против морщин
 Омолаживающий крем против морщин Ноябрь 2013 Признаки старения кожи Клиент замечает признаки старения кожи Появление линий и морщин (гусиные лапки, межбровные морщины) Потеря тонуса и эластичности Косметолог
Омолаживающий крем против морщин Ноябрь 2013 Признаки старения кожи Клиент замечает признаки старения кожи Появление линий и морщин (гусиные лапки, межбровные морщины) Потеря тонуса и эластичности Косметолог
Ватная продукция ТМ «Белоснежка»
 2010 Ватная продукция ТМ «Белоснежка» 1 ОГЛАВЛЕНИЕ I. ВАТНАЯ ГРУППА… 3 1.1. ВАТА МЕДИЦИНСКАЯ ГИГРОСКОПИЧЕСКАЯ ГИГИЕНИЧЕСКАЯ НЕСТЕРИЛЬНАЯ ТМ «БЕЛОСНЕЖКА», РОЛИК, РАСФАСОВКА 25 Г, 50 Г, 100 Г, 250 Г….
2010 Ватная продукция ТМ «Белоснежка» 1 ОГЛАВЛЕНИЕ I. ВАТНАЯ ГРУППА… 3 1.1. ВАТА МЕДИЦИНСКАЯ ГИГРОСКОПИЧЕСКАЯ ГИГИЕНИЧЕСКАЯ НЕСТЕРИЛЬНАЯ ТМ «БЕЛОСНЕЖКА», РОЛИК, РАСФАСОВКА 25 Г, 50 Г, 100 Г, 250 Г….
WELLNESS-косметика KOSMOTEROS PROFESSIONNEL
 WELLNESS-косметика KOSMOTEROS PROFESSIONNEL является одним из основных элементов WELLNESS-подхода и сохранению отличного внешнего вида, эмоционального настроя и самочувствия на многие десятилетия жизни
WELLNESS-косметика KOSMOTEROS PROFESSIONNEL является одним из основных элементов WELLNESS-подхода и сохранению отличного внешнего вида, эмоционального настроя и самочувствия на многие десятилетия жизни
Патент Российской Федерации
 БАКТЕРИЦИДНОЕ СРЕДСТВО «ЙОДОВИДОН» И СПОСОБ ЕГО ПОЛУЧЕНИЯ Патент Российской Федерации Суть изобретения: Изобретение относится к химико-фармацевтической промышленности и касается бактерицидного средства
БАКТЕРИЦИДНОЕ СРЕДСТВО «ЙОДОВИДОН» И СПОСОБ ЕГО ПОЛУЧЕНИЯ Патент Российской Федерации Суть изобретения: Изобретение относится к химико-фармацевтической промышленности и касается бактерицидного средства
УНИВЕРСАЛЬНЫЙ МЕСТНЫЙ ГЕМОСТАТИК
 УНИВЕРСАЛЬНЫЙ МЕСТНЫЙ ГЕМОСТАТИК Механический Физический Химический Биологический Основные требования к гемостатическим средствам: — Универсальность действия — Удобная форма применения для сложных раневых
УНИВЕРСАЛЬНЫЙ МЕСТНЫЙ ГЕМОСТАТИК Механический Физический Химический Биологический Основные требования к гемостатическим средствам: — Универсальность действия — Удобная форма применения для сложных раневых
Безопасность пациентов
 Безопасность пациентов 1. Преимущества использования медицинской бумаги в современных упаковочных материалах для стерилизации. 2. Сравнительный обзор материалов на Российском рынке. Директор. Направление
Безопасность пациентов 1. Преимущества использования медицинской бумаги в современных упаковочных материалах для стерилизации. 2. Сравнительный обзор материалов на Российском рынке. Директор. Направление
ПРИКОСНОВЕНИЕ ДЛЯ ВСЕХ ТИПОВ КОЖИ
 НЕЖНОЕ ШЕЛКА ПРИКОСНОВЕНИЕ ДЛЯ ВСЕХ ТИПОВ КОЖИ ХАРАКТЕРИСТИКИ 1 2 3 4 5 ПЛОТНОЕ ПРИЛЕГАНИЕ Маска прекрасно прилегает к поверхности кожи, повторяя контуры лица. Обеспечивает глубокое проникновение активных
НЕЖНОЕ ШЕЛКА ПРИКОСНОВЕНИЕ ДЛЯ ВСЕХ ТИПОВ КОЖИ ХАРАКТЕРИСТИКИ 1 2 3 4 5 ПЛОТНОЕ ПРИЛЕГАНИЕ Маска прекрасно прилегает к поверхности кожи, повторяя контуры лица. Обеспечивает глубокое проникновение активных
Новые методы биоармирования
 2 Les nouvelles esthetiques 1/2011 ЭСТЕТИЧЕСКАЯ МЕДИЦИНА Новые методы биоармирования Станислав Арканников ХИРУРГ, ДЕРМАТОКОСМЕТОЛОГ, СПЕЦИАЛИСТ ПО КОНТУРНОЙ И ОБЪЕМНОЙ ПЛАСТИКЕ ЛИЦА История армирования
2 Les nouvelles esthetiques 1/2011 ЭСТЕТИЧЕСКАЯ МЕДИЦИНА Новые методы биоармирования Станислав Арканников ХИРУРГ, ДЕРМАТОКОСМЕТОЛОГ, СПЕЦИАЛИСТ ПО КОНТУРНОЙ И ОБЪЕМНОЙ ПЛАСТИКЕ ЛИЦА История армирования
SCHALI — Комфортный сон
 Страница 1 из 5 ИНСТРУКЦИЯ по медицинскому применению изделия нормализации серотонинового баланса организма Стерильный Гидроколлоидный Минеральный Пластырь (HMP) SCHALI — Комфортный сон Страница 2 из 5
Страница 1 из 5 ИНСТРУКЦИЯ по медицинскому применению изделия нормализации серотонинового баланса организма Стерильный Гидроколлоидный Минеральный Пластырь (HMP) SCHALI — Комфортный сон Страница 2 из 5
Средства ухода за руками MP HandCareSystem
 Средства ухода за руками MP HandCareSystem Описание продуктов: Средства ухода за руками MP HandCareSystem представляет собой специально разработанный для окрасочной отрасли комплекс для очистки кожи, не
Средства ухода за руками MP HandCareSystem Описание продуктов: Средства ухода за руками MP HandCareSystem представляет собой специально разработанный для окрасочной отрасли комплекс для очистки кожи, не
Гидроколлоидные раневые покрытия — Мегаобучалка
(DuoDerm, Granuflex, Hydrocoll, Tegasorb) наиболее широко используют для лечения венозных трофических язв. Они состоят из полупроницаемого слоя (полиуретановая губка), покрытого гидрофильным коллоидным гелем (желатин, пектин, карбоксиме-тилцелюлоза), распределенным в гидрофобной клеевой массе или поперечно сшитом матриксе. Эти раневые покрытия абсорбируют раневой экссудат и переводят его в желеобразное состояние, надежно закрывая трофическую язву и препятствуя ее загрязнению. При абсорбции экссудата происходит изменение цвета повязки, что облегчает ее своевременную смену.
Гидроколлоидные раневые покрытия хорошо фиксируются на коже, моделируют форму конечности, не затрудняют ходьбу и значительно снижают болевой синдром. Некоторые варианты гидроколлоидных раневых покрытий сделаны в виде пасты, удобной для заполнения глубоких язв. При смене они не повреждают кожу и неоэпителий. Для этих раневых покрытий отмечено оптимальное соотношение стоимости/эффективности.
К недостаткам можно отнести их непрозрачность, а следовательно, необходимость постоянного мониторинга состояния трофической язвы (2-3 раза в неделю), высокую вероятность мацерации кожи, а также неприятный запах, создающий впечатление об активном гнойном процессе. Гидроколлоидные раневые покрытия целесообразно использовать для закрытия гранулирующих поверхностных трофических язв с умеренно выраженной экссудацией.
Губки (Alevin, Cavi-Care, CombiDerm, Cutinova) представлены гидрофильной полимерной пеной (полиуретан), покрытой полупроницаемым полиэстером или силиконом. Обеспечивают хороший барьер для воды и раневого экссудата, препятствуют бактериальному загрязнению. Эффективно поглощают избыточный экссудат, поддерживая раневую поверхность во влажном состоянии. Хорошо моделируют физиологические изгибы конечности. К недостаткам следует отнести невозможность визуального контроля за раной. При недостаточной экссудации могут высушивать язву и пролонгировать ее заживление. Кроме того, они не обладают адгезивной способностью и требуют дополнительной фиксации. Используют при лечении трофических язв со средним или большим объемом экссудата.
Гидрогели(Hydrosorb, Opragel, Tegagel, Duoderm, Intrasite) представлены в виде пластин или аморфной массы. Они состоят из 4-10% гидрофильного полимера (полиакриламид, полиэтилен оксид, агар и др.) и иммобилизованной воды, составляющей 90% от веса повязки. Некоторые гидрогели наносят на полупроницаемую адгезивную пленку.
Основными свойствами гидрогелей являются очищение раны путем ее гидратации и стимуляция аутолиза некротизированных тканей. За счет наличия свободных гидрофильных связей гидрогели, особенно в аморфной форме, способны поглощать значительные количества экссудата. Гидрогелевые повязки прозрачны и позволяют контролировать раневой процесс. Их удаление и смена происходят легко, безболезненно, без повреждения грануляций или неоэпителия. К недостаткам следует отнести относительно небольшую абсорбционную способ-
ность, а также необходимость применения дополнительного покрытия при использовании гидрогеля в аморфной форме.
Гидрогели целесообразно использовать для лечения сухих трофических язв с большим количеством некротических тканей и фибрина.
Алгинаты(Kaltostat, Sorbalgon, Tegagen) представляют собой биодеградирующие раневые покрытия, производимые из бурых морских водорослей. Их основу составляет кальциевая соль алгинатовой кислоты, а также полимерные цепи маннуроновой и гиалуроновой кислот.
При контакте с раневым экссудатом или жидкостью, содержащей ионизированный натрий, нерастворимый алгинат кальция переходит в растворимую, желеобразную форму, которая способна поглотить большое количество экссудата, в 15-20 раз превышающего вес сухого вещества.
Алгинаты хорошо моделируют физиологические изгибы конечности и заполняют глубокие трофические язвы. Они легко снимаются и оказывают ге-мостатическое действие. При снижении экссудации алгинатное покрытие может неравномерно подвергаться биодеградации, оставляя в ране сухие участки, способствующие травме и блокирующие дренаж. Рекомендуется тщательный мониторинг, обильное промывание раны после удаления повязки и осторожное использование повязок при инфицированных ранах.
Алгинаты следует применять при лечении трофических язв со средним или большим количеством экссудата. Использование данного вида раневых покрытий позволяет снизить длительность заживления язв, уменьшить количество перевязок и является экономически эффективным.
Гидрофибры(Aquacel) — гидроколлоидные волокна, которые при контакте с раневым отделяемым быстро переходят в форму геля и поглощают большое количество экссудата (примерно в 30 раз превосходящее сухой вес повязки). Интересно, что абсорбция отделяемого из раны происходит строго в вертикальном направлении, что препятствует его попаданию на окружающую кожу и предотвращает ее мацерацию.
Гидрофибры хорошо заполняют трофические язвы любой формы и локализации. Смена повязки требуется не чаще 1 раза в 7 дней.
Этот вид раневого покрытия следует применять при трофических язвах с выраженной экссудацией. Применение факторов роста
Принципиально новым и, вероятно, весьма перспективным направлением в лечение рефрактерных венозных трофических язв может стать применение различных факторов роста, избирательно воздействующих на тот или иной компонент соединительной ткани.
Тромбоцит-синтезируемый фактор роста (PDGF)— гликопротеин, стимулирующий митоз эн-дотелиоцитов и гладкомышечных клеток, синтезируется в виде трех изомеров (АА, ВВ и АВ), из которых наиболее активен ВВ. PDGF наиболее важный медиатор заживления ран, индуцирующий увеличение клеточных группировок макрофагов и фибробластов, а также ускоряющий формирование и ремоделирова-ние межклеточного матрикса. На основе PDGF уже начат выпуск препарата под коммерческим названием Regranex®.
сердечно-сосудистая хирургия
Фактор роста фибробластов (FGF)синтезируется более чем в 9 изоформах. Наилучшие характеристики имеет изоформа bFGF/FGF-2, которая избирательно стимулирует формирование соединительнотканного матрикса, ускоряет пролиферацию фибробластов и кератиноцитов, ускоряет васкуляризацию, грануляцию и эпителизацию.
Эпидермальный фактор роста (EGF)стимулирует рост кератиноцитов, фибробластов и продукцию основных компонентов соединительнотканного матрикса — коллагена и фибронектина.
Трансформирующий фактор роста р-типа (TGF-P)— гликопротеин, имеющий три изоформы, которые индуцируют синтез экстрацеллюлярного матрикса (коллагена и фибронектина), обладают хемо-таксическим действием в отношении макрофагов, стимулируют пролиферацию фибробластов, ингиби-руют пролиферацию кератиноцитов и протеолиз, модулируют активность коллагеназы и металлопротеаз. Благодаря указанным механизмам действия препятствуют образованию гипертрофических и келоидных рубцов.
Широкое применение факторов роста во флеболо-гической практике ограничивает их высокая стоимость, отсутствие четкой методологии применения, а также эффективных средств доставки в толщу трофической язвы.
Имплантация клеток соединительной ткани.В последние годы большой интерес вызывает трансплантация на трофическую язву свободных или иммобилизованных клеточных клонов соединительной ткани. Ряд фирм уже начал выпуск раневых покрытий, включающих в свой состав аутогенные или аллоген-ные кератиноциты и фибробласты (Dermagraf, Apligraf, Epigraf, Epicet). Следует отметить, что наилучшие результаты при использовании данного вида раневых покрытий были получены при лечении ожогов кожи. Для венозных трофических язв их эффективность во много раз ниже. Широкое использование клеточных клонов при венозных трофических язвах ограничивает их высокая стоимость, а также необходимость специальной подготовки — очищение трофической язвы от некротических тканей, фибрина, подавление воспаления и экссудации, а также эрадика-ция микрофлоры.
биодеградируемое раневое покрытие и способ получения биодеградируемого раневого покрытия — патент РФ 2519158
Изобретение относится к медицине. Описано покрытие, выполненное в виде пленки, которое содержит следующие компоненты, масс.%: низкомолекулярный пищевой хитозан 5,3-5,7, глицерин 2,2-2,8, церулоплазмин 0,06÷0,08, L-аспарагиновую кислоту 0,04-0,06, растворитель с уровнем pH 5-7 — остальное. Описан способ получения покрытия, заключающийся в том, что навеску хитозана разводят в растворителе из расчета 1000 мг навески на 15 мл растворителя, перемешивают и помещают ее в термостат при температуре 37-42°С на 1-2 часа. Затем в смесь добавляют разведенный в растворителе церулоплазмин из расчета 1:10 с обеспечением образования гомогенного гидрогеля. После растворяют L-аспарагиновую кислоту в предварительно нагретом до 37-40°С растворителе и добавляют в смесь до получения уровня рН смеси 5-7. Добавляют пластификатор в виде глицерина в объеме 2,2-2,8% от общего объема полученной при этом биомассы. Помещают полученную биомассу в емкости с обеспечением образования равномерного слоя покрытия с высотой 3-5 мм и формирования пленки путем высушивания биомассы в течение 18-24 часов в термостате при температуре 37-40°С. Раневое покрытие обеспечивает максимальный клинический эффект. 2 н. и 4 з.п. ф-лы, 6 ил., 2 пр.
Группа изобретений относится к медицине, биологии, ветеринарии, фармакологии. Данные технические решения могут быть использованы при изготовлении раневых покрытий для лечения ран кожных покровов различного генеза.
Известны раневые покрытия, выполненные в виде листов или пленок из смеси синтетических полимеров и полимеров биологического происхождения. Покрытия, выполненные только из синтетических полимеров монокомпонентные, например полиуретановые [патент СИТА № 2871218], или многокомпонентные, например из смеси полиуретана и полиаллилового эфира [патент ФРГ № 34098558], обладают хорошими физико-механическими свойствами, достаточно прочные, водо- и паропроницаемые, но выполняют только защитную функцию и не обладают способностью стимулировать регенерационные процессы.
Известны также раневые покрытия в виде коллагеновых губок или повязок, на которые нанесены активные вещества. Известны, в частности, пористые губки для лечения ран из коллагена [авторское свидетельство СССР № 561564]; смеси желатина, хитозана и формальдегида [патент КНР № 1097980]; желатина и формальдегида с добавлением антибиотиков [патент РФ № 2033149]; целлюлозы и хитозана [заявка Японии № 0376029]; коллагена и хитозана [патент РСТ № 8504413].
Основным недостатком данных губок является относительно невысокая ранозаживляющая активность, обусловленная залипанием губки на ране. Чисто коллагеновые губки обладают плохим подводом кислорода к зоне репарации.
Известно достаточно много образцов раневых покрытий, отличающихся по химическому составу. Из существующего в настоящее время широкого ассортимента полимерных раневых покрытий в наибольшей степени отвечают всем медико-биологическим требованиям биодеградируемые покрытия из полисахаридов, которые могут быть полезны как на ранних стадиях лечения ран, так и на более поздних. Общими свойствами биосовместимых материалов из полисахаридов, в том числе хитозана, являются их гидрофильность, обусловливающая высокую адсорбирующую способность (до 5000%), хорошая адгезия к ране, отсутствие токсичности и раздражающего действия, а также гемостатические свойства. Отмечено их стимулирующее действие на процессы заживления ран и ожогов, что способствует более быстрому развитию грануляционной ткани, ускорению эпителизации. Присутствие на ране полисахаридных материалов благоприятно сказывается на репарационных процессах на всех стадиях лечения раны. Основной проблемой получения покрытий из природных полисахаридов является достижение хорошей механической прочности покрытия и устойчивости на ране. Разработка биодеградируемых полимерных покрытий с высокой сорбирующей способностью и различными сроками рассасывания является в настоящее время наиболее актуальным направлением в области создания эффективных биологических повязок для лечения ран. Покрытия из хитозана воздухо- и паропроницаемы, препятствуют инвазии извне микроорганизмов, создают оптимальный микроклимат в ране, способствуют клеточному росту и пролиферации в ране. Хитозан, помимо стимулирования пролиферации на первых стадиях раневого процесса, очень полезен на завершающей фазе заживления — перестройке рубца. Его присутствие в ране помогает избежать образования грубых рубцов [патент РФ № 2468129].
Известна повязка, один из вариантов которой содержит хитозан и выполнен в форме эластичной перфорированной пленки [заявка РФ № 99100105].
Однако данная пленка многослойна и, как следствие, невозможны ее полная конгруэнтность с раневой поверхностью и удаление раневого отделяемого путем впитывания сорбирующим слоем повязки, что приводит к неизбежности частой смены повязок.
Известна также биологически активная полимерная сорбирующая пленка, созданная на основе хитозана [Кильдеева Н.Р., Вихорева Т.А., Ларионова А.С., Гальбрайх Л.С. // Современные подходы к разработке эффективных шовных материалов и полимерных имплантатов: Матер. III международ. конф. М., 1998, 130-131 с.], содержащая ферментативный препарат трипсин и модифицированная сшивающим реагентом — додецилсульфатом натрия, проявляющим, кроме того, антимикробные свойства.
Однако пленка плохо моделируема на ране. Низкая прочность повязки во влажном состоянии создает вероятность выброса раневого отделяемого из повязки в раневую зону. В составе пленки присутствует токсичный для организма человека реагент — додецилсульфат натрия.
Известна полимерная пленка на рану на основе хитозана, имеющая толщину 5-50 мкм, модифицированная сшивающим агентом эпихлоргидрином, которая также может содержать 0-20% поливинилового спирта или полиэтиленгликоля и антибактериальные или антисептические вещества [патент WO № 2001/0141820].
Однако данная пленка имеет относительно невысокую адсорбирующую способность, быструю биодеградацию пленки в раневой среде, что затрудняет очищение раны, т.к. адсорбируемое пленкой раневое отделяемое и продукты биодеградации остаются в ране, полное удаление пленки возможно лишь при использовании на относительно сухих ранах.
Известна повязка, представляющая собой перфорированную пленку и содержащая хитозан в виде соли органической кислоты (уксусной, янтарной или гликолевой), глутаровый альдегид, поливиниловый спирт и биологически активную добавку в виде CO2-экстрактов лекарственных растений [патент РФ № 2219954].
Недостатки повязки: недостаточная конгруэнтность с раневой поверхностью, невысокая адсорбирующая способность, ограниченная паропроницаемость. В случае использования в качестве биологически активной добавки СО2-экстрактов лекарственных растений, например тысячелистника, облепихи, подорожника, эвкалипта, полыни горькой, зверобоя, кориандра, повышается вероятность развития аллергических реакций. Недостатками являются также сложный состав повязки, включение в нее токсичного глутарового альдегида, низкие эластичные свойства из-за увеличения сшивок между глутаровым альдегидом, хитозаном и поливиниловым спиртом.
Известно также раневое покрытие на основе коллаген-хитозанового комплекса для восстановления дефектов кожи в виде губки, геля, коллоидного раствора, пленки. Хитозановая составляющая содержит хитозан со степенью деацетилирования 0,95-0,99 и молекулярной массой 100-1000 кДа в виде аскорбата хитозана при содержании аскорбиновой кислоты 1,8 г/л сухого хитозана, а также хондроитинсерную кислоту — 5-100 мг/г сухого хитозана, гиалуроновую кислоту — 10-100 мг/г сухого хитозана, гепарин — 2,5-5 мг/г сухого хитозана и сывороточный фактор роста крупного рогатого скота — 11-220 мкг/г сухого хитозана [патент РФ № 2254145].
Однако входящий в состав раневого покрытия сывороточный фактор роста крупного рогатого скота является белковым компонентом, оказывающим дополнительный аллергизирующий эффект.
Наиболее близким аналогом к заявляемому биодеградируемому раневому покрытию является биоразлагаемая пленка, которая содержит пектин, хитозан, воду, однонормальную соляную кислоту, пластификатор — глицерин и структурообразователь — трехпроцентный раствор метилцеллюлозы [патент РФ № 2458077].
Однако данное раневое покрытие имеет свои недостатки. Как известно, добавление структурообразователя (3% раствор метилцеллюлозы) ограничивает возможность формирования пленок различной толщины, периметра и, таким образом, создает определенные препятствия для плотного прилегания пленки к поверхности раны, тем самым, понижая ее адгезию к раневой поверхности. Кроме того, метиллцеллюлоза может вызывать слабовыраженные аллергические реакции, что может привести к метаболическим нарушениям, замедляющим регенерацию поврежденных тканей.
Вторым заявляемым в данной заявке изобретением является способ получения биодеградируемого раневого покрытия.
Известен способ получения раневого покрытия «ХИТОСКИН», описанный в патенте РФ на полезную модель № 8608. Навески хитозана и коллагена отдельно растворяют в уксусной кислоте, затем смешивают растворы, подвергают полученную смесь диализу против дистиллированной воды с периодической сменой воды до тех пор, пока pH диализуемой смеси не превысит 5.2, затем добавляют биологически активное вещество и структурообразователь. Полученный раствор замораживают в сублимационной камере до -35°С и далее подвергают сублимационной сушке.
Основной недостаток способа получения данного раневого покрытия — большой процент брака при промышленном производстве (до 70%). Он выражается в том, что в ходе лиофилизации часто наблюдается контракция губок, заключающаяся в сжатии губки (уменьшение площади губки в результате лиофилизации до 30% от исходной) с потерей пористой структуры, а также ее вспячивание и выгибание с потерей плоской формы. В результате этих явлений раневое покрытие получается жестким, плохо моделирует раневую поверхность. По-видимому на возникновение контракции губок сильное влияние оказывает скорость замораживания полимерного раствора (геля). На используемых в промышленности установках при скоростях замораживания больше 4°/час в материале возникают флуктуации температуры, что провоцирует формирование неравномерной структуры пор и неравновесное фазовое разделение, приводящее при дальнейшей сушке к деформации пластин материала и потере пористости.
Известен также способ получения пленки на основе хитозана, включающий приготовление формовочного раствора из воздушно-сухой навески хитозана и раствора органической кислоты, нанесение полученного раствора на подложку с последующим выдерживанием раствора на подложке до достижения пленочной структуры. Формовочный раствор включает хитозан в виде соли уксусной или янтарной кислоты. После выдерживания пленочную структуру обрабатывают парами воды или водного раствора 0,5 н. соляной кислоты до степени набухания пленки 70-190%, при этом обеспечивают величину относительного удлинения пленки при разрыве не менее 20%. Описан также способ, в котором пленку помещают в дистиллированную воду или физиологический раствор (0,9% NaCl) до степени набухания пленки не менее 90%, при этом обеспечивают величину относительного удлинения пленки при разрыве не менее 30% [патент РФ № 2429022].
Однако данный способ трудоемкий, имеет множество последовательных действий, включающих приготовление формовочного раствора в течение 1 суток с периодическим встряхиванием. Получение пленки осуществляют в течение 2-3 суток.
Наиболее близким к заявляемому способу получения биодеградируемого раневого покрытия является способ получения биоразлагаемой пленки, описанный в патенте РФ № 2458077. Пектин растворяют в дистиллированной воде. Затем для лучшего растворения компонентов раствор помещают в термостат на 1 минуту при температуре 37-38°С. Хитозан растворяют в 1 н. (однонормальной) соляной кислоте. Для лучшего растворения компонентов раствор также помещают в термостат на 1 минуту при температуре 37-38°С. Затем полученные растворы пектина и хитозана предпочтительно в равной пропорции сливают и перемешивают до полного растворения образующихся сгустков. Для того чтобы пленка была прочной и равномерно отделялась от подложки, после перемешивания сгустков в полученный раствор добавляют пластификатор и структурообразователь. Полученную массу осторожно выливают в чашку Петри. Пленку формируют на стеклянной подложке (в чашке Петри) в течение 20-24 часов при температуре от 0 до 25°С.
Однако растворение хитозана в однонормальной соляной кислоте не позволяет регулировать на этапе изготовления пленки уровень pH формовочного раствора. Как известно, именно физиологический уровень pH покрытия позволяет добиться оптимальных физиологических условий для процесса регенерации.
Задачей заявляемого изобретения по поводу раневого покрытия является повышение его антиоксидантных свойств с обеспечением физиологического уровня pH покрытия при простоте его использования и низкой себестоимости его компонентов.
Задачей заявляемого изобретения по поводу способа является упрощение процесса получения раневого покрытия, не требующего использования дорогостоящего оборудования, с обеспечением достижения максимального клинического эффекта при использовании покрытия.
Сущность заявляемого изобретения по поводу покрытия заключается в том, что биодеградируемое раневое покрытие, выполненное в виде пленки и содержащее хитозан, пластификатор в виде глицерина, растворитель, дополнительно содержит церулоплазмин и L-аспарагиновую кислоту при следующем соотношении компонентов, масс.%:
хитозан — 5,3÷5,7;
глицерин — 2,2÷2,8;
церулоплазмин — 0,06÷0,08;
L-аспарагиновая кислота — 0,04÷0,06;
растворитель — остальное,
при этом в качестве хитозана используют низкомолекулярный пищевой хитозан, а растворитель — с уровнем pH 5-7. Заявляется также биодеградируемое раневое покрытие с вышеописанными признаками, в котором в качестве растворителя используют физиологический раствор или дистиллированную воду. Кроме того, заявляется также биодеградируемое раневое покрытие с вышеописанными признаками, пленка которого имеет отверстия диаметром 0,2-0,5 мм и концентрацией их распределения в ней 10-15 шт. на 100 мм2.
Сущность заявляемого изобретения по поводу способа заключается в том, что в способе получения биодеградируемого раневого покрытия, включающем: приготовление навески хитозана; разведение последней в растворителе путем добавления навески хитозана в растворитель, перемешивания полученной смеси и помещения ее в термостат; добавление в полученную смесь пластификатора в виде глицерина и помещение полученной биомассы в емкости с обеспечением формирования пленки путем высушивания биомассы в течение 18-24 часов, растворитель используют с уровнем pH 5-7, навеску хитозана приготавливают из пищевого низкомолекулярного хитозана и разводят ее в растворителе из расчета 1000 мг навески на 15 мл растворителя, при этом полученную смесь помещают в термостат при температуре 37-42°С на 1-2 часа, затем в смесь добавляют разведенный в растворителе церулоплазмин из расчета 1:10 с обеспечением образования гомогенного гидрогеля, после растворяют L-аспарагиновую кислоту в предварительно нагретом до 37-40°С растворителе, обеспечивая пропорцию 100 мг L-аспарагиновой кислоты на 10 мл растворителя, и добавляют в смесь до получения уровня pH смеси 5-7; пластификатор вводят в смесь в объеме 2,2-2,8% от общего объема полученной при этом биомассы, последнюю перемешивают со скоростью 100-150 об/мин в течение 30-60 секунд; помещение биомассы в емкости выполняют путем обеспечения образования равномерного слоя покрытия с высотой 3-5 мм; высушивание покрытия производят в термостате при температуре 37-40°С.
Заявляется также способ получения биодеградируемого раневого покрытия с вышеописанными признаками, в котором полученную пленку перфорируют с обеспечением диаметра отверстий 0,2-0,5 мм и концентрацией их распределения 10-15 шт. на 100 мм2.
Технический результат заявляемого изобретения по поводу покрытия
Известно, что в ране, особенно инфицированной, отмечают существенные метаболические нарушения, в том числе активацию процессов свободнорадикального окисления, продукты которого дополнительно оказывают повреждающее действие на клеточные мембраны. Это ведет к замедлению регенераторных процессов. Данная проблема была исключена в заявляемом изобретении — раневом покрытии путем введения в его состав антиоксиданта, а именно церулоплазмина, который понижает уровень токсичных свободных кислородных радикалов, тем самым, способствуя ускорению регенеративных процессов.
Повреждения целостности кожного покрова приводят к развитию целого каскада патологических реакций, а это, в свою очередь, вызывает существенные изменения уровня pH биологических жидкостей. С целью восстановления физиологического уровня показателей pH и их стабилизации в состав раневого покрытия дополнительно включен забуферивающий агент в виде L-аспарагиновой кислоты, помимо того активно влияющий на синтез ДНК и РНК.
Использование заявляемой в данной заявке совокупности компонентов в разработанных авторами соотношениях позволяет получить биодеградируемое раневое покрытие, обладающее регенерирующими, антиоксидантными, достаточными антибактериальными свойствами, предупреждающими инфицирование ран, при этом раневое покрытие достаточно эластичное и обеспечивает необходимую адгезию к раневой поверхности.
Выполнение биодеградируемого эластичного покрытия в виде пленки, полностью и надежно закрывающей раневую поверхность, не требующей повторного нанесения, повторяющей пространственное расположение раневого повреждения, позволяет также использовать его в качестве носителя для дополнительных лечебных компонентов. Раневое покрытие с заявляемым составом и физическими характеристиками (в виде эластичной пленки) позволяет изолировать раневую поверхность от проникновения патогенной и условно патогенной микрофлоры, обеспечивает газообмен и водный баланс, что является важнейшими факторами для обеспечения протекания процесса регенерации. Использование в заявляемом биодеградируемом раневом покрытии в качестве основы хитозана исключает необходимость повторного нанесения покрытия, использования перевязочных материалов и каких-либо дополнительных воздействий на рану. Описанное в данной заявке покрытие может быть нанесено в бытовых условиях, поскольку хитозан и другие его компоненты при их местном применении не проявляют токсических и аллергических эффектов, вследствие чего покрытие может быть применимо во всех возрастных группах у пациентов с различными соматическими статусами как в стационарах, так и в домашних условиях. Одновременно хитозан проявляет антибактериальные и регенерирующие свойства на раневой поверхности, создавая оптимальные условия для действия других компонентов раневого покрытия, обеспечивая суммарный эффект, превышающий активность исходных компонентов.
В состав заявляемого покрытия входят дешевые компоненты, произведенные на территории РФ, имеющиеся в открытом, безрецептурном доступе.
Технический результат заявляемого изобретения по поводу способа
Изготовление раневого покрытия не требует использования дорогостоящего оборудования и создания специальных условий, а именно гомогенизация исходных компонентов осуществляется за счет воздействия температурного режима и равномерного перемешивания. Конечный результат достигается путем открытого высушивания при разработанных условиях, что позволяет получить готовое к применению раневое покрытие, обладающее максимальной адгезией к раневой поверхности, пластичностью и гидрофобностью. Получение пленок с заданной высотой и равномерным распределением активных компонентов за счет последовательности действий заявляемого способа, их температурных, временных характеристик, а также наличие физических факторов, таких как перемешивание, сливание компонентов в нормальных атмосферных условиях, позволяет добиться регенерирующих и профилактических антибактериальных свойств в отношении ран мягких тканей. Использование заявляемых покрытий не требует специальной квалификации и доступно широким слоям населения в быту.
Заявляемая группа изобретений поясняется с помощью Фиг.1-6, на которых изображены:
на Фиг.1 — общий вид биодеградируемого раневого покрытия со стороны ее шероховатой поверхности, контактирующей с раной;
на Фиг.2 — общий вид биодеградируемого раневого покрытия со стороны глянцевой поверхности;
на Фиг.3 — биодеградируемое раневое покрытие в согнутом виде с иллюстрированием его гибкости и пластичности;
на Фиг.4 — общий вид биодеградируемого раневого покрытия на биологическом объекте в 1-е сутки после его нанесения;
на Фиг.5 — общий вид биодеградируемого раневого покрытия на биологическом объекте в 6-е сутки после его нанесения;
на Фиг.6 — общий вид биодеградируемого раневого покрытия на биологическом объекте в 8-е сутки после его нанесения.
Биодеградируемое раневое покрытие выполнено в виде гибкой полупрозрачной пленки. В ее состав входят низкомолекулярный пищевой хитозан, пластификатор в виде глицерина, растворитель, церулоплазмин и L-аспарагиновая кислота. В качестве растворителя используют физиологический раствор или дистиллированную воду с уровнем pH 5-7. Соотношение компонентов в пленки распределено следующим образом, масс.%: хитозан — 5,3÷5,7; глицерин — 2,2÷2,8; церулоплазмин — 0,06÷0,08; L-аспарагиновая кислота — 0,04÷0,06; растворитель — остальное. В частных случаях пленка может иметь отверстия диаметром 0,2-0,5 мм с концентрацией их распределения в ней 10-15 шт. на 100 мм2.
Способ получения раневого покрытия осуществляют следующим образом.
Приготавливают навеску пищевого низкомолекулярного хитозана. Разводят последнюю в растворителе, в частности физиологическом растворе или дистиллированной воде, для чего добавляют приготовленную ранее навеску хитозана в растворитель, размещенный в емкости, например стакане, выполненном из полипропилена, из расчета 1000 мл навески на 15 мл растворителя. Перемешивают полученную смесь и помещают ее в термостат при температуре 37-42°С на 1-2 часа до обеспечения полного растворения хитозана в растворителе с образованием полупрозрачной однородной гомогенной массы желто-коричневого цвета. Затем в отдельной емкости разводят церулоплазмин в растворителе из расчета 10 мл церулоплазмина на 1 мл растворителя. Разведенный церулоплазмин добавляют в полученную смесь с обеспечением образования гомогенного гидрогеля. Затем подготавливают растворитель порядка 10 мл, подогревая его в термостате до температуры 37-40°С. Растворяют в отдельной емкости в подогретом растворителе L-аспарагиновую кислоту, обеспечивая пропорцию — 100 мг L-аспарагиновой кислоты на 10 мл растворителя. Добавляют приготовленный раствор L-аспарагиновой кислоты в смесь до получения уровня pH смеси 5-7. После добавляют в смесь пластификатор в виде глицерина в объеме 2,2-2,8% от общего объема полученной впоследствии биомассы. Перемешивают последнюю, например, с помощью магнитной мешалки, со скоростью 100-150 об/мин в течение 30-60 секунд. Затем распределяют биомассу по продольно ориентированным емкостям, покрывая всю поверхность последних с образованием равномерного слоя покрытия высотой 3-5 мм. В большинстве случаев для этого в качестве емкостей используют чашки Петри, выполненные из полипропилена. Помещают данные емкости с помещенной в них биомассой в термостат при температуре 37-40°С на 18-24 часа до полного их высушивания и формирования раневых покрытий в виде пленок, имеющих с одной стороны глянцевую поверхность, с другой стороны шероховатую.
В дальнейшем придают пленкам форму ран и накладывают их на зону патологического очага, обращая шероховатую поверхность покрытия внутрь раны и изолируя всю раневую поверхность от внешней среды.
После завершения процесса эпителизации при наличии остатков раневого покрытия на поверхности кожи его аккуратно смывают водой. В случае обширных ран с обильной экссудацией для улучшения процесса газообмена и поддержания оптимального водного баланса поврежденной поверхности, необходимых для осуществления заживления, пленки перфорируют с обеспечением диаметра отверстий 0,2-0,5 мм и концентрацией их распределения 10-15 шт. на 100 мм2.
Пример 1.
Заявляемый препарат был апробирован на 30 лабораторных белых крысах-самцах массой 160-220 г. Проведение исследований было осуществлено согласно Протоколу исследований, утвержденному Комитетом по этике ГОУ ВПО «Саратовский государственный медицинский университет Росздрава РФ» — протокол № 13 от 10 апреля 2007 г. и не противоречащему Женевской Конвенции 1985 г. о «Международных принципах биомедицинских исследований с использованием животных».
У всех животных моделировали полнослойную кожную рану размером 400 мм2. Для чего после предварительной обработки кожи, в асептических условиях, под наркозом, на выбритой от шерсти в межлопаточной области у крыс иссекали кожу с подкожной клетчаткой в виде квадрата 2×2 см — 400 мм2 по контуру предварительно нанесенным трафаретом. Затем лабораторных животных разделили на две группы -опытную и сравнения по 15 крыс в каждой.
В группе сравнения обработку раны проводили путем однократного воздействия на раневую поверхность изотоническим раствором натрия хлорида и удаления некротических тканей. В опытной группе после той же процедуры на раневую поверхность наложили раневое покрытие, полностью покрывая рану, обращая его шероховатой поверхностью к раневой поверхности и слегка прижимая к ней.
В динамике изучали изменения суточной площади ран животных опытной группы и группы сравнения.
Суточное уменьшение площади ран у экспериментальных животных в процессе лечения составило, %:
| Сутки исследования | Группа сравнения | Опытная группа |
| 3-и | 4,6±1,2 | 10,8±0,8 p<0,001 |
| 5-е | 12,4±2,1 | 33,1±0,5 p<0,001 |
| 7-е | 16,4±0,5 | 24,2±1,7 p<0,001 |
При этом p — уровень достоверности различия показателей по отношению к группе сравнения.
Полное заживление ран отмечали к 10-м суткам у 7 животных опытной группы, к 14-м суткам — у оставшихся 8 крыс опытной группы.
На всем протяжении эксперимента у всех животных производили бактериологические исследования раневой поверхности. У всех крыс опытной группы посевы раневой поверхности оставались стерильными во все сроки наблюдения.
Заживление раны у 11 животных группы сравнения отмечали лишь на 14-е сутки. У 4 крыс группы сравнения из-за контакта открытой раневой поверхности с условно-патогенной флорой окружающей среды или собственной флорой животного отмечали инфицирование раны на 5-е сутки Е.coli — 2×105 KOE. Из них у 2 животных наблюдали полное заживление раны на 21-е сутки. К 21-м суткам у 2 других животных группы сравнения сохранялась та же флора в количестве 2×102 КОЕ и рана была очищена от патогенов с завершением репарационного процесса только к 26-м суткам.
Для оценки состояния процессов свободнорадикального окисления определяли на 14-е сутки спектрофотометрически биохимические показатели крови экспериментальных животных: содержание малонового диальдегида и активность церулоплазмина. Содержание малонового диальдегида у животных опытной группы было статистически достоверно (p<0,05) ниже 2,83±0,1 мкмоль/л относительно полученных показателей животных группы сравнения 3,21±0,12 мкмоль/л.
В опытной группе животных активность церулоплазмина была статистически достоверно (p<0,001) выше 24,23±0,35 у.е. относительно группы сравнения 19,43±0,65 у.е.
Для оценки репаративных процессов у животных обеих групп с помощью цитологического исследования изучали динамическое изменение количества нейтрофильных лейкоцитов и клеток фибробластического ряда.
Полученные результаты по динамическому изменению среднего количества нейтрофильных лейкоцитов и клеток фибробластического ряда в мазках-отпечатках на изученных клетках с поверхностей экспериментальных ран животных обеих групп приведены ниже.
| Сутки исследования | Количество нейтрофильных лейкоцитов | |
| Группа сравнения | Опытная группа | |
| 3-и | 95,45±0,32 | 92,40±0,75 p<0,05 |
| 5-е | 90,55±1,08 | 86,15±0,32 p<0,001 |
| 7-е | 85,50±0,32 | 58,25±3,34 p<0,001 |
| 9-е | 76,05±0,64 p<0,01 | 34,20±1,4 p<0,001 |
| Сутки исследования | Количество клеток фибробластического ряда | |
| Группа сравнения | Опытная группа | |
| 3-и | 0,9±0,03 | 1,1±0,07 |
| 5-е | 1,75±0,28 | 2,5±0,75 p<0,001 |
| 7-е | 6,9±0,64 | 30,20±4,75 p<0,001 |
| 9-е | 20,5±1,08 p<0,01 | 63,35±2,05 p<0,001 |
При этом p — уровень достоверности различий показателей по отношению к группе сравнения.
Экспериментальным животным проводили также гистологические исследования.
К 10-м суткам в опытной группе отмечали уже увеличение толщины эпидермиса на 42,3% по отношению к группе сравнения. В опытной группе количество и структура кровеносных сосудов, расположенных в эпидермальном слое, имели характеристики, близкие к нормальным, а именно упорядоченное положение, характерное для организованной грануляционной ткани с формированием сосудистых петель. В участках активного кровообращения отмечали активную пролиферацию фибробластами. Дерматоэпидермальное соединение было ярко выражено. Кожа была подвижная, не спаяна с подлежащей тканью. Отмечали также восстановление структуры сальных желез, а также наличие волосяных фолликулов различной степени зрелости и рост волос. Ориентация коллагеновых волокон была горизонтальная.
У крыс группы сравнения к 10-м суткам кожа плотно была спаяна с подлежащей тканью, сохранялся струп. Число волосяных луковиц и сальных желез на единицу площади среза в этой группе наблюдалось значительно меньше, чем в опытной группе. Незрелая грануляционная ткань в области раны была богата фибробластами, обильно пронизана вертикально идущими сосудами. Отмечали, что расположение коллагеновых волокон, в основном, хаотично, реже — вертикально по ходу сосудов.
В процессе заживления в опытной группе отмечали, что произошла постепенная биодеградация раневого покрытия, которая завершилась практически одновременно с окончанием эпителизации ран. Проведенные экспериментальные исследования подтвердили эффективность использования заявляемого раневого покрытия.
Пример 2. Способ получения биодеградируемого раневого покрытия
В стакан, выполненный из полипропилена, объемом 50 мл налили 15 мл дистиллированной воды. Подготовили навеску пищевого низкомолекулярного хитозана в количестве 1 г, произведенного ЗАО «Биопрогресс», г.Москва в соответствии с ТУ 9289-067-00472124-03. Добавили навеску хитозана в стакан с дистиллированной водой. Полученную смесь перемешали и поместили в термостат при температуре 37°С на 2 часа. Через 2 часа хитозан полностью растворился в дистиллированной воде, представляя собой полупрозрачную однородную гомогенную массу желто-коричневого цвета. Развели 10 мг лиофилизированного церулоплазмина, произведенного ФГУП «Микроген» Россия, г.Москва, в 1 мл дистиллированной воды, получив прозрачный раствор бледно-голубого цвета. Добавили данный раствор в полученную смесь. Нагрели 10 мл дистиллированной воды в термостате до 37°С и добавили в нее 100 мг L-аспарагиновой кислоты, произведенной ОАО «Биосинтез», г.Пенза. Подготовленный раствор L-аспарагиновой кислоты постепенно добавляли в смесь, после каждого добавления измеряя уровень pH раствора. При достижении pH 5 процедуру добавления раствора L-аспарагиновой кислоты в количестве 1 мл прекратили. Затем в смесь добавили 0,5 мл пластификатора — глицерина, произведенного ЗАО «Казанская фармацевтическая фабрика», что составило 2,8% от общего объема полученной биомассы. Последнюю перемешали с помощью магнитной мешалки со скоростью 100 об/мин в течение 60 секунд. С помощью Viscometer SV-10 измерили динамическую вязкость биомассы, которая составила 26,5 mPas×c. Полученную биомассу залили в чашку Петри, выполненную из полипропилена, покрывая весь диаметр и формируя равномерный слой толщиной 5 мм, и поместили на 24 часа в термостат при 37°С для высушивания.
В результате получили полупрозрачное покрытие желто-коричневого цвета в виде пленки, с одной стороны — глянцевой, с другой — шероховатой. Покрытие эластичное, легко сгибалось и повторяло рельеф горизонтальной поверхности, на которую ее размещали.
Экспериментальные исследования, подтверждающие применение данного раневого покрытия приведены выше в примере 1.
ФОРМУЛА ИЗОБРЕТЕНИЯ
1. Биодеградируемое раневое покрытие, выполненное в виде пленки и содержащее хитозан, пластификатор в виде глицерина, растворитель, отличающееся тем, что оно дополнительно содержит церулоплазмин и L-аспарагиновую кислоту при следующем соотношении компонентов, масс.%:
хитозан 5,3 — 5,7
глицерин 2,2 — 2,8
церулоплазмин 0,06 — 0,08
L-аспарагиновая кислота 0,04 — 0,06
растворитель остальное,
при этом в качестве хитозана используют низкомолекулярный пищевой хитозан, а растворитель с уровнем pH 5-7.
2. Покрытие по п.1, отличающееся тем, что в качестве растворителя используют физиологический раствор.
3. Покрытие по п.1, отличающееся тем, что в качестве растворителя используют дистиллированную воду.
4. Покрытие по п.1, отличающееся тем, что пленка имеет отверстия диаметром 0,2-0,5 мм и концентрацией их распределения в ней 10-15 шт. на 100 мм2.
5. Способ получения биодеградируемого раневого покрытия, включающий приготовление навески хитозана, разведение последней в растворителе путем добавления навески хитозана в растворитель, перемешивание полученной смеси и помещение ее в термостат, добавление в полученную смесь пластификатора в виде глицерина и помещение полученной биомассы в емкости с обеспечением формирования пленки путем высушивания биомассы в течение 18-24 часов, отличающийся тем, что растворитель используют с уровнем pH 5-7, навеску хитозана приготавливают из пищевого низкомолекулярного хитозана и разводят ее в растворителе из расчета 1000 мг навески на 15 мл растворителя, при этом полученную смесь помещают в термостат при температуре 37-42°С на 1-2 часа, затем в смесь добавляют разведенный в растворителе церулоплазмин из расчета 1:10 с обеспечением образования гомогенного гидрогеля, после растворяют L-аспарагиновую кислоту в предварительно нагретом до 37-40°С растворителе, обеспечивая пропорцию 100 мг L-аспарагиновой кислоты на 10 мл растворителя, и добавляют в смесь до получения уровня pH смеси 5-7, пластификатор вводят в смесь в объеме 2,2-2,8% от общего объема полученной при этом биомассы, последнюю перемешивают со скоростью 100-150 оборотов в минуту в течение 30-60 секунд; помещение биомассы в емкости выполняют путем обеспечения образования равномерного слоя покрытия с высотой 3-5 мм, высушивание покрытия производят в термостате при температуре 37-40°С.
6. Способ по п.5, отличающийся тем, что полученную пленку перфорируют с обеспечением диаметра отверстий 0,2-0,5 мм и концентрацией их распределения 10-15 шт. на 100 мм2.
Покрытие раны — Большая Химическая Энциклопедия
Мазь Нанесите мазь прямо на рану, накройте соответствующей повязкой и закрепите на месте. Предпочтительны приложения ежедневно или два раза в день. Промойте рану … [Стр.2062]Раны, покрытые гидроколлоидом Комфил плюс, зажили значительно быстрее, чем БК или бактерицидная мазь (Таблица 3). [Стр.83]
В отличие от ран, обработанных BC и бактерицидной мазью, раны, покрытые гидроколлоидом Comfeel plus, были сильно загрязнены несколькими бактериями (таблицы 4 и 5).Растущие микроорганизмы были членами как патогенных, так и непатогенных групп. [Стр.83]
Осторожно промойте пациента с помощью ручного распылителя, начав с лица и дыхательных путей, затем откройте раны (прикрывайте рот пациента и зажимайте нос при умывании). [Pg.514]
| Рис. 3 ТЕМ-изображение 12-дневной раны, покрытой коллагеновой губкой. Коллагеновые губки, пропитанные водой. раневой экссудат, фибробласты Luuiaijiing (F) и сплигелиальные клетки (fi) (15tWx), … |  |
Командир призвал медиков: «Прикройте раненых, оденьте их, газ сожжет их». В любом случае газ попадал в обнаженные руки и открытую область шеи, оставляя мужчин с той же болью, что и при ожогах.59 … [Pg.266]
Потери на испарение из-за закрытой раны. Было обнаружено, что потеря испарения дорсальной раны, покрытой лечебной пастой, составила 52 мг · ч 30 / см / час через 6 часов, что было примерно на 50% меньше… [Стр.184]
Рана, покрытая лечебной пастой. Неинфицированные контрольные раны, покрытые лечебной пастой через 3 часа, зажили примерно с 10-15% сокращением по краям раны примерно за 10 … [Pg.184]
KU deeva, N.R. et al. [Подготовка биоразлагаемых пористых пленок для использования в качестве раневых покрытий] Прикл. Биохим. Mikrobiol. 2006, 42 (6), 716-720, [Статья на русском языке]. [Pg.40]
Полимеры, используемые в нетоксичных стерилизуемых предметах, таких как трубки, искусственные органы и покрытия ран, должны выдерживать стерилизацию этиленоксидом, паровым автоклавом или гамма-излучением.Для медицинских изделий, стерилизованных гамма-облучением, можно использовать только пластмассы, которые не разлагаются и не обесцвечиваются под воздействием радиации, например, полиэстер и поликарбонаты. [Pg.790]
Большое внимание уделяется разработке искусственных покрытий ран. Основными требованиями к таким покрытиям являются защита от микробных атак со стороны окружающей среды, оптимальная водопроницаемость, способность хорошо прилегать к ране и возможность легко сниматься без повреждения тканей. Другими важными факторами являются предотвращение чрезмерного образования грануляционной ткани и оптимальная эластичность для облегчения интимного прикрытия раны.[Pg.790]
В одном исследовании материалов, покрывающих рану, с контролируемыми физико-химическими свойствами, была разработана искусственная кожа с композитной мембраной из коллаген-полисахарида (хондроитин-6-сульфат), подвергнутой перекрестной линзе. Он был специально выбран для обеспечения контролируемой пористости (от 5 до 150 мкм в диаметре), гибкости (путем изменения плотности сшивки) и скорости потока влаги. [Pg.741]
Closure Covering Покрытие раны, местный гемостаз … [Pg.214]
Гидрогели PEG для инкапсуляции клеток, доставки дмг и покрытия раны… [Pg.406]
| Рис. 2.2 Применение электропряденых нановолокон, используемых для обнаружения биохимических агентов, доставки лекарств, тканевой инженерии, покрытия и заживления ран. По материалам литературы А. Сезая … |  |
РИСУНОК 22.3 Оценка зарастания раны (а) рана покрыта прозрачным скотчем во избежание инфицирования и увядания (б) поверхность костной мозоли занимает менее 5% раны (1 балл) (в) поверхность костной мозоли занимает 85,5-100% раны (9 баллов). [Стр.304]
.
Заживление влажных ран против заживления сухих ран | Обработка ран
Брюс Э. Рубен, доктор медицины
Вначале, задолго до того, как Джонсон встретил Джонсона и были изобретены пластыри, первобытные мужчины и женщины получали небольшие порезы и ссадины и, вероятно, оставляли их открытыми для заживления. В конце концов, кровотечение остановилось, в конце концов образовалась корка, и опыт показал им, что их кожа заживает через неделю или две. Так что не было особой спешки найти применение этим пухлым, пушистым, мягким, белым растениям, растущим на полях.
В те первые дни открытия корка и волдырь считались природным чудом, покрывающим раны. Струп стал нашим частичным и временным экзоскелетом, а волдырь был человеческим эквивалентом пузырчатой пленки, защищая раны и способствуя процессу заживления. Струп — это естественное покрытие раны на теле. Пока участок остается влажным, струп не препятствует процессу заживления. В то время сохранение струпьев и волдырей казалось ключом к заживлению ран.
Сильные раны Призывают к решительным мерам
Но по мере того, как время шло и люди получали более крупные раны (например, те, которые могли быть получены при попытке убить кабана без приличного оружия), возникла необходимость остановить чрезмерное кровотечение и дальнейшие травмы с помощью какого-либо покрытия для ран. Метод проб и ошибок, скорее всего, доказал, что пальмовые листья работают, а ядовитый плющ — нет.
Только примерно в 1500 г. до н.э. древние египтяне и греки начали использовать пух, животный жир и мед в качестве местного лечения ран.Они обнаружили, что пух обеспечивает волокнистую основу, которая способствует закрытию участка раны, животный жир создает барьер для патогенов окружающей среды, а мед служит антибиотиком.
Чего они, возможно, не осознавали в то время, так это того, что их метод лечения ускорял процесс заживления ран, способствуя увлажнению раневого ложа.
Что такое влажное заживление ран?
Есть два основных компонента влажного заживления ран: 1) Не наносите дезинфицирующие средства на рану и 2) Сохраняйте рану влажной.Первый компонент, без использования дезинфицирующих средств, имеет смысл, потому что дезинфицирующие средства, такие как йод, гипохлорит натрия и перекись водорода, токсичны для клеток и никогда не должны наноситься на поверхность раны. Мы не хотим убивать клетки; мы хотим побудить их жить и размножаться.
Второй компонент относится к тому факту, что порезы, ссадины, раздавливания и ожоги заживают быстрее и с меньшим количеством рубцов, когда лечение включает в себя увлажнение ложа раны.
Доказательство того, что влажные раны заживают быстрее, чем сухие, появилось в 1962 году благодаря доктору.Джордж Д. Винтер и его знаменательная статья «Формирование струпа и скорость эпителизации поверхностных ран на коже молодой домашней свиньи» 1 . Его исследование показало, что вопреки распространенному в то время мнению, что ранам нужно дать высохнуть и образовать струпья для ускорения заживления, раны заживают быстрее, если они остаются влажными. Работа Винтера положила начало развитию современных перевязочных материалов, способствующих заживлению влажных ран.
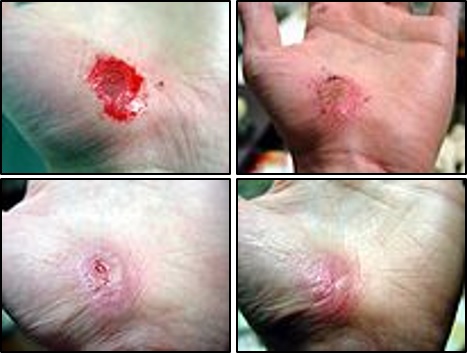
Когда рана заживает с влажным ложе раны, она заживает быстрее и с меньшей болью и рубцеванием.
В частности, для роста клеток необходима влага, и основная цель терапии влажных ран — создать и поддерживать эти оптимальные влажные условия. Клетки могут расти, делиться и мигрировать с повышенной скоростью, способствуя образованию новой ткани. Во время этой фазы заживления раны водная среда с несколькими питательными веществами и витаминами необходима для метаболизма и роста клеток.
Роль экссудата в заживлении ран
В этой среде раневой экссудат, влага, которая естественным образом просачивается из места раны, служит транспортным средством для множества биоактивных молекул, таких как ферменты, факторы роста и гормоны.Различные клетки в области раны взаимодействуют друг с другом через эти медиаторы, обеспечивая скоординированный процесс заживления.
Экссудат из раны также обеспечивает различные клетки иммунной системы идеальной средой для уничтожения вторгающихся патогенов, таких как бактерии, инородные тела и некротические ткани, что снижает скорость инфицирования.
Влажное заживление ран препятствует образованию твердой, непроницаемой корки, которая имеет тенденцию блокировать распространение эпителиальных клеток горизонтально через тонкий слой раневого экссудата и через ложе раны.После этого рана быстро закрывается. Кроме того, боль значительно снижается, если на раны наложена окклюзионная повязка. Сначала высказывались опасения, что наличие влаги в ранах увеличит риск клинической инфекции, но оказалось, что это не так.
Подводя итог, можно сказать, что лечение местных ран подразделяется на следующие компоненты:
- Очистка раны для удаления мертвых тканей и мусора
- Перевязка раны для увлажнения ложа раны и предотвращения повторного повреждения раны
- Определение периодичности смены повязок
- Повторная оценка для измерения скорости выздоровления
Следуя этому протоколу обеспечивает:
- Заживление ран до 50% быстрее, чем заживление сухих ран
- Более низкий уровень заражения
- Нет необходимости в системных антибиотиках
- Безболезненное снятие повязки без повреждения новообразованной ткани
- Меньше рубцов и лучшие косметические результаты
Источники
1.Зима, Г.Д. Формирование струпа и скорость эпителизации поверхностных ран на коже молодой домашней свиньи. Природа . 1962; 193: 293-294.
Об авторе
Доктор Брюс Рубен — основатель и медицинский директор компании Encompass HealthCare, расположенной в Вест-Блумфилде, штат Мичиган. Encompass Healthcare — это амбулаторное учреждение, предлагающее передовые методы лечения ран, внутривенное введение антибиотиков, лечение гипербарическим кислородом, оценку питания и другие методы лечения.Доктор Рубен имеет сертификат по внутренним болезням, инфекционным болезням, подводной медицине и гипербарической медицине. Он является членом Медицинского и научного консультативного комитета и правления Национальной ассоциации травм спинного мозга (NSCIA).
Взгляды и мнения, выраженные в этом блоге, принадлежат исключительно автору и не отражают точку зрения WoundSource, Kestrel Health Information, Inc., ее дочерних компаний или дочерних компаний.
,wound cover — перевод на французский — примеры английский
Эти примеры могут содержать грубые слова на основании вашего поиска.
Эти примеры могут содержать разговорные слова, основанные на вашем поиске.
Одна из форм активного тепла — это передача нагретой жидкости к ране , покрывающей .
Une form de génération de chaleur active состоит из transférer un fluide chauffé vers le pansement .Покрытие раны включает в себя программируемое управление активным нагревателем, а уплотнительное кольцо может подавать воду для регулирования влажности обрабатываемого объема.
Ce pansement contient une commande d’élément chauffant active programmeable et l’anneau d’étanchéité peut libérer de l’eau pour permettre de réguler le niveau d’élément du volume de traitement.Необязательно, втулка (11) абсорбирующего тела соединена на своей периферии с участком (1) пленки и элементом , покрывающим рану , (4).
La gaine (11) du corps d’absorption est éventuellement connectée à la section de pellicule (1) и à l’élément de couverture de plaie (4) sur sa périphérie.для лечения ран, содержащий закрывающий рану элемент
новый материал , покрывающий раны, , биосовместимый
характеристики, необходимые для материала , покрывающего рану,
гибкое конструктивное устройство, пружина, покрытие раны и способы
бесконтактное покрытие раны для закрытия раны
pansement sans contact permettant de couvrir une plaieУчасток (1) пленки соединен своим краем (3) с намоткой , покрывающей элемент (4) по всей своей периферии.
La section de pellicule (1) est connectée de façon périphérique à l’élément de couverture de plaie (4) sur son bord (3).Втулка (11) подвижно расположена внутри мешка (26), образованного элементом , покрывающим намотку , и участком пленки (1).
La gaine (11) est Disposée de façon mobile dans une poche (26) formée par l’élément de couverture de plaie (4) et la section de pellicule (1).Первый слой состоит из пористого листа, который имеет множество пор (113), сформированных в нем, и пористый лист включает рану , покрывающую поверхность , которая покрывает рану, и поверхность, которая обращена ко второму слою.
La première couche est composée d’une feuille poreuse qui a de multiples pore (113) formée à l’intérieur de celle-ci et la feuille poreuse comprend une surface de couverture de plaie recouvrant une plaie et une surface qui fait face à la secondde couche.Коэффициент статического трения вторичного перевязочного материала к поверхности, которая обращена к вторичному перевязочному материалу, устанавливается ниже, чем коэффициент статического трения раны к ране , покрывающей поверхность (111).
Статический коэффициент замораживания мате- риала второго элемента à la surface qui fait face au matériau de pansement secondaire est défini pour être inférieur au factor de frottement statique de la plaie à la surface de couverture de plaie (111).покрывающий рану материал, содержащий фиброин шелка и серицин шелка в качестве основных компонентов и способ их получения
matière de recouvrement de plaie contenant de la fibroïne de soie et de la séricine de soie Com composants Principaux et son procédé de productionмембрана для регенерации тканей тела и использование указанной мембраны в качестве раны , покрывающей и заменяющей кожу
мембрана, предназначенная для регенерации тканей корпуса и сына, в форме couverture de plaie et de peau de remplacementПоскольку этот материал , покрывающий рану, может храниться в состоянии раствора на поверхности раны, он может быстро прилипать к поверхности раны сложной формы.
Этант не нужно, чтобы он поддерживал раствор на поверхности единого полотна, этот материал для пансимента осталась твердой аппликацией на поверхности единого полотна, образующей сложную форму.материал , покрывающий рану, , содержащий некристаллические фиброиновые пленки и способный плавно ускорять регенерацию поврежденной кожи и отслаиваться от кожи, не вызывая отслаивания также регенерированной кожи.
un matériau de pansement , qui comprend des film de fibroïne non cristallins, способный к тому, чтобы обучить манеру douce la régénération d’un épiderme ayant subi une lésion et pouvant être détaché de la peaué la seaurés que réa.материал , покрывающий рану, материал, содержащий пленку из полиуретановой смолы или ламинат, состоящий из указанной пленки и водопоглощающей ткани, при этом пленка или ткань содержат антибактериальное средство и, по крайней мере, пленка имеет отверстия
une matière pour pansement , qui comprend un film de résine de polyuréthane or stratifié constitué par ce film et par une toile Absorant l’eau et dans lequel le film ou la toile contient un agent antibactérien et le film et / ou la toile comporte des ouvertureНабухающий в воде полимерный гель используется как составная часть материала , покрывающего рану, , применяемого к пациентам с ранами, ожогами, пролежнями и т.п. для ускорения заживления.
Этот гель-полимер, покрытый жидкостью, содержит композицию pansement для различных типов, в том числе брюк и т. Д., Не является легким для использования.гибкое конструктивное устройство, которое может использоваться в качестве покрытия раны , которое выступает над раной так, что покрытие раны не контактирует с раной, а также защищает рану от контакта
un appareil structurel гибкая сумка être utilisé Com recouvrement de plaie qui s’étend sur la plaie de sorte que le recouvrement de plaie ne soit pas en contact avec la plaie et protégeant également la plaie contre tout contactраневое покрытие материал на основе коллагеновых волокон
,wound cover — Перевод на немецкий — примеры английский
Эти примеры могут содержать грубые слова на основании вашего поиска.
Эти примеры могут содержать разговорные слова, основанные на вашем поиске.
Гибкое покрытие для ран по п.1, отличающееся тем, что фибриновое полотно прочно соединено с биоразлагаемым поддерживающим материалом.
Гибкий Wundauflage nach Anspruch 1, dadurch gekennzeichnet, dass das Fibrinvlies mit einem biologisch abbaubaren Trägermaterial fest verbunden ist.Гибкое покрытие для ран на основе фибрина, отличающееся тем, что оно может быть получено по пп. 4-18.
Flexible Wundauflage auf Fibrinbasis, dadurch gekennzeichnet, dass sie nach den Ansprüchen 4 bis 18 erhältlich ist.9. Рана , покрывающая по п.1 или 2, в которой статистический сополимер содержит от 30 до 70 мас.% Звена этиленоксида в его молекулярной цепи.
Wundverband gemäß Anspruch 1 или 2, dadurch gekennzeichnet, das das statistische Сополимер в сейне Molekülkette 30 до 70 Gew .-% Ethylenoxideinheiten hat.9. Покрытие для ран по п.1, в котором пленка из полиуретановой смолы или лист из биополимерного материала содержит антибактериальный агент.
Wundverband gemäß Anspruch 1, dadurch gekennzeichnet, daß der Polyurethanharzfilm or die Lage aus biopolymerem Material ein antibakterielles Mittel enthält.Покрытие для намотки по п.1, в котором контроллер включает в себя выбираемые предварительно установленные настройки средней температуры.
Wundabdeckung nach Anspruch 1, bei der die Regel- bzw. Steuereinrichtung auswählbare, vorher eingestellte Einstellungen für die Durchschnittstemperatur enthält.Обмотка по п.1, в которой нагреватель включает в себя электрически резистивную нить накала (314).
Wundabdeckung nach Anspruch 1, bei der die Heizeinrichtung einen elektrischen Widerstandsfaden (314), а также einen Faden mit elektrischem Widerstand enthält.Применение раны , покрывающей рану , по пп.1-3 и 19, в качестве материала подложки для производства активных соединений, способствующих заживлению ран.
Verwendung einer Wundauflage nach den Ansprüchen 1 bis 3 und 19 zur Herstellung eines Trägermaterials für die Wundheilung fördernde Wirkstoffe.Поддерживающий материал для активных соединений, способствующих заживлению ран, приготовленный из раны , покрывающей , по пп.1-3 и 19.
Trägermaterial für die Wundheilung fördernde Wirkstoffe, herstellbar aus einer Wundauflage nach den Ansprüchen 1 bis 3 und 19.Покрытие для ран по п.1, в котором нагреватель предназначен для неравномерного нагрева обрабатываемой области.
Wundabdeckung nach Anspruch 1, bei der die Heizeinrichtung zur ungleichmäßigen Erwärmung des Behandlungs-Bereiches dient.Клейкая повязка по одному из пп.1-11, отличающаяся тем, что рана , покрывающая и / или самоклеящийся слой, содержит противовоспалительное вещество.
Haftverband gemäß einem der Ansprüche 1 bis 11, dadurch gekennzeichnet, daß die Wundauflage und / oder die Selbstklebeschicht eine entzündungshemmende Substanz enthält.Покрытие раны по п. 14, в котором кольцо конформной полимерной пены включает в себя ячеистую структуру, образующую резервуар для хранения и высвобождения лекарственных средств.
Wundabdeckung nach Anspruch 26, wobei der sich anpassende, polymere Schaumstoffring eine Zell- bzw. Gewebestruktur beinhaltet, die ein Reservoir für die Speicherung und die Abgabe von Medikamenten bildet.Покрытие раны по п. 18, в котором упомянутый карман (94) выполнен с возможностью установки пассивного отражателя тепла.
Wundabdeckung nach Anspruch 18, wobei die Tasche (94) anpaßbar ist, um einen passiven Wärmereflektor aufzunehmen.Обмотка , покрывающая обмотку по любому из пп. 2-5, в которой нагреватель включает в себя электрически резистивную нить (314).
Wundabdeckung nach einem der Ansprüche 2 bis 5, bei der die Heizeinrichtung einen elektrischen Widerstandsdraht (314) aufweist.Покрытие для намотки по п. 10, в котором конформное полимерное кольцо содержит полимерную пену.
Wundabdeckung nach Anspruch 10, bei der der sich anpassende polymeische Ring einen полимеришен Schaum beinhaltet.Покрытие для намотки по п. 13, в котором гибкий листовой материал содержит полимерную пленку.
Wundabdeckung nach Anspruch 13, bei der das flexible Bahnmaterial ein policeischer Film ist.Гибкая рана , покрывающая по пп.1 и 2, отличающаяся тем, что фибриновое полотно содержит от 10 до 80 мас.% Глицерина на единицу фибрина.
Гибкий Wundauflage nach den Ansprüchen 1 und 2, dadurch gekennzeichnet, dass das Fibrinvlies 10 bis 80 Gew .-% Glyzerin pro Fibrinmenge enthält.Применение раны , покрывающей рану по пп.1-3 и 19, для изготовления лекарственного средства для гемостаза внутренних и внешних ран.
Verwendung einer Wundauflage nach den Ansprüchen 1 bis 3 und 19 zur Herstellung eines Arzneimittels zur Hämostase innerer und äußerer Wunden.Покрытие для ран по п. 1, в котором уплотнительное кольцо определяет объем обработки, а клеевой слой герметизирует область обработки.
Wundabdeckung nach Anspruch 1, bei der der Abdichtungsring das Behandlungs-Volumen Definiert und die Klebstoffschicht rund um den Behandlungs-Bereich abdichtet.Покрытие для намотки по п. 5, в котором уплотнительное кольцо содержит конформное полимерное кольцо.
Wundabdeckung nach Anspruch 5, bei der der Abdichtungsring einen winkeltreuen bzw. konformen Polymer-Ring aufweist.Покрытие раны по п. 6, в котором конформное полимерное кольцо включает в себя полимерную пену.
Wundabdeckung nach Anspruch 6, bei der der formangepasste Polymerring einen Polymerschaum umfasst.,