Тотальная внутривенная анестезия: принципы проведения, виды
Страх боли — один из самых древних и пугающих. Боль может лишить сознания, рассудка и привести к летальному исходу от болевого шока. Вопрос обезболивания перед человечеством встал в тот самый момент, когда начали проводиться различные манипуляции с телом, кожей, органами. И если много лет назад анестезия была «дворовая» (отвлекали, позволяли кричать, давали убойную дозу алкоголя), то в наше время медицина шагнула вперед настолько, что методов обезболивания великое множество и с каждым новым открытием переносить новый метод анестезии все легче, а побочных эффектов у него все меньше.
Виды анестезии
Для лучшего понимания рассмотрим основные методы анестезии.
1) Местная анестезия.
Из названия понятно, что зона ее действия определяется локально. Человек остается в сознании, и побочных эффектов и нежелательных последствий у такого вида обезболивания немного. Чаще всего используется:
- Поверхностная (аппликационная) — используется в медицине (стоматология, оториноларингология, косметология, гинекология), когда нужно обезболить небольшой участок кожного покрова. Теряется чувствительность участка, пациент ощущает онемение. Анестетик может быть в виде геля, аэрозоля, спрея или раствора.
- Инфильтрационная — введение препарата, блокирующего нервные импульсы, производится подкожно, инъекционно.
- Проводниковая — препарат вводится в параневральное пространство, что вызывает блокаду импульсов по крупному нервному стволу. Это уже более серьезный вид местной анестезии, он используется при операциях на конечностях, щитовидной железе и проч.
- Спинальная — введение анестетика происходит в спинномозговую жидкость при помощи тонкой иглы. Теряется чувствительность нижнего сегмента живота и конечностей. Используется при проведении операций в поясничном отделе позвоночника, на ногах и др.
- Эпидуральная — анестезия, широко используемая при родах и кесаревом сечении. Отличие от спинальной — введение происходит при помощи катетера в эпидуральное пространство, и блокировка импульсов идет не на уровне корешков спинномозговых нервов, а блокируются полностью нервные окончания спинного мозга.
2) Общая анестезия.
При проведении общей анестезии полностью угнетается работа центральной нервной системы, человек находится без сознания, скелетные мышцы расслаблены, болевая чувствительность отсутствует. Общая анестезия требует тщательного подбора препаратов врачом-анестезиологом, восстановление после нее труднее, зачастую требуется аппарат искусственной вентиляции легких для восстановления дыхания после общего наркоза. Виды общей анестезии:
- ингаляционная — анестетики вводятся через дыхательные пути, используются масочные, эндотрахеальные, эндобронхиальные аппараты;
- неингаляционная — введение происходит внутривенно, внутримышечно (зависит от количества вводимых препаратов и их комбинаций — мононаркоз, смешанный наркоз, комбинированный наркоз).
Для безопасности пациента и глобального обезболивания иногда применяют сочетание ингаляционного обезболивания и неингаляционного.
Рассмотрим подробнее один из наиболее распространенных видов неингаляционной анестезии — тотальная внутривенная анестезия, что это, как проводится и т. д.
Альтернатива ингаляционной анестезии
Сокращенно ТВВА — это вид общей анестезии, который используется для проведения операций, во время которых не требуется мышечное расслабление. Особенностью данного метода является сочетание нескольких препаратов в меньших дозах, чем если бы каждый из них нужен был по отдельности. Таким образом, уменьшается негативное побочное воздействие на организм от каждого препарата. Анестетики при ТВВА дополняются транквилизаторами, нейролептиками, гипнотиками, анальгетиками, в результате комбинация нескольких препаратов усиливает действие анестезии.
Почему ТВВА?
Остановить свое внимание именно на тотальной внутривенной анестезии приходится, потому что именно в России пока не может получить широкого распространения ингаляционный вид обезболивания. Причина — недостаток современных анестетиков и низкопоточных наркозных препаратов. Внутривенное введение анестезирующих препаратов помогает облегчить вывод из состояния наркоза, регулировать дозировку.
Преимущества метода
- Осуществить такой анестезию просто технически.
- Надежность, вводить анестетик внутривенно можно дозами дробно.
- Введение в состояние сна происходит быстро, почти мгновенно.
- Физиологичный сон.
- Благодаря совместному действию с транквилизаторами у пациента отсутствует фаза возбуждения (нет страхов и тревожности).
- Индивидуальный подход к каждому пациенту — можно рассчитать эффективную химическую структуру анестетика в каждом отдельном случае.
Книги о ТВВА
Книга «Тотальная внутривенная анестезия» Смита является хорошим качественным настольным пособием для анестезиологов. До момента появления русскоязычного издания подобных этой книг в российской медицине не было.
В своей книге Смит в соавторстве с Уайтом подробно и грамотно разобрал следующие темы:
- тотальная внутривенная анестезия — понятие, техника проведения, ее научные основы;
- история происхождения внутривенной анестезии;
- методики ТВВА;
- фармацевтический разбор препаратов, используемых при этом виде анестезии;
- преимущества и недостатки ТВВА;
- проведение и влияние ТВВА для отдельных групп больных;
- мониторирование действия анестетиков во время проведения анестезии;
- какое будущее ожидает внутривенную анестезию.
Подготовка к ТВВА
Тотальная внутривенная анестезия является одним из несложных видов наркоза, и подготовка к ней тоже достаточно примитивная. Требуется осмотр анестезиолога, опорожнение кишечника (или клизма). Лучше перед наркозом (или накануне) не принимать пищу, чтобы не возник рвотный рефлекс. Если требуется — проводится медикаментозная подготовка, пациенту даются или вводятся препараты, стабилизирующие психоэмоциональное состояние.
Подбор анестезирующего вещества, вспомогательных препаратов и их дозировки подбираются персонально и индивидуально анестезиологом. Расчет проводится всегда для каждого конкретного случая.
Техника проведения
При тотальной внутривенной анестезии используются два основных типа препаратов: гипнотик и анальгетик, поэтому существует несколько стратегий инфузии. Для большинства операций техника такова: скорость инфузии гипнотика не меняется на протяжении операции, а анальгетика изменяют в зависимости от интенсивности хирургического вмешательства (также учитывается реакция больного). Бывает, что действуют и наоборот: скорость инфузии анальгетика поддерживают на постоянном уровне, введение гипнотика изменяют.
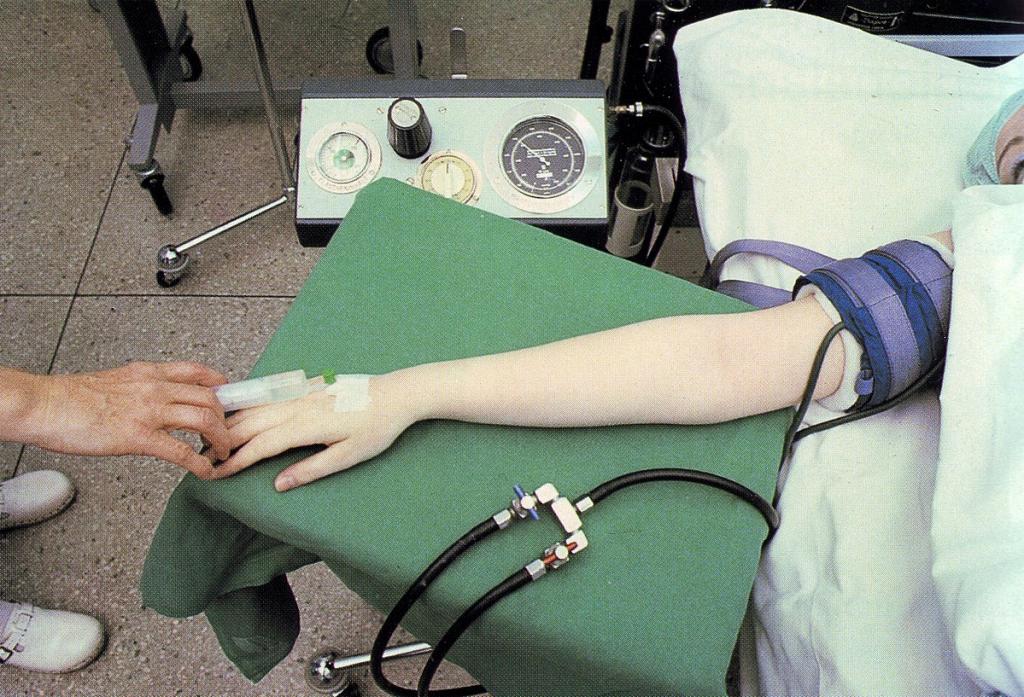
У первого способа есть преимущество в виде быстрого пробуждения больного по окончании операции. Поэтому такая техника используется чаще, однако следует учитывать фармакокинетику препаратов и исходить из особенностей операции и состояния пациента.
Меры предосторожности
Как бы просто ни казалось применение внутривенной анестезии, относиться к выбору анестезиолога, подбору препаратов нужно максимально внимательно. К сожалению, не всегда все бывает просто. Квалификация персонала, постоянное наблюдение за больным после окончания операции, правильно высчитанные дозировки, контроль систем гомеостаза помогут выйти из наркоза легко и без негативных последствий и воспоминаний.
Основные принципы тотальной внутривенной анестезии
Корнюшенков Е. А.
Клиника экспериментальной терапии НИИ клинической онкологии РОНЦ имени Н. Н. Блохина РАМН,
Ветеринарная клиника «Биоконтроль»
«Институт развития ветеринарной интенсивной терапии, анестезиологии и реаниматологии – ВИТАР»
Тотальная внутривенная анестезия (ТВВА) подразумевает использование для индукции и поддержания анестезии только внутривенные препараты. Каждый компонент анестезии (выключение сознания, анальгезия, амнезия, стабильность вегетативной нервной системы, миорелаксация) обеспечивается и управляется селективно действующими внутривенными анестетиками.
Адекватная анестезия недостижима без правильного режима доставки анестетиков в кровоток. Если анестетик вводят дробными дозами внутривенно струйно через определенные промежутки времени, то кривая концентрации препарата в плазме выглядит как чередование пиков и провалов. Пики проявляются чрезмерной глубиной анестезии и побочными эффектами анестетика, провалы — слишком поверхностной анестезией, сопряженной с риском восстановления сознания. Если анестетик вводят слишком часто, то он может кумулировать, что замедляет пробуждение. Более точного управления глубиной анестезии можно достичь постоянной инфузией короткодействующего препарата. Как правило, при постоянной инфузии анестетика, вначале вводят нагрузочную дозу (струйно или в виде инфузии), чтобы быстро достичь адекватной концентрации препарата в крови. После введения нагрузочной дозы переходят на поддерживающую инфузию, скорость которой постепенно уменьшают до достижения определенного уровня. Такой режим введения, компенсируя перераспределение, позволяет обеспечить эффективную концентрацию препарата в месте его действия. Помимо особенностей режима введения, обусловленных фармакокинетическими свойствами препарата, необходимо регулировать скорость инфузии в зависимости от интенсивности хирургической стимуляции.
При ТВВА необходимо вводить два препарата – гипнотик и анальгетик, поэтому существует много стратегий инфузии. Для большинства операций целесообразно скорость инфузии гипнотика поддерживать на постоянном уровне, а анальгетика – изменять в зависимости от интенсивности хирургической стимуляции и реакции больного. Альтернативная методика предполагает постоянную скорость инфузии анальгетика и меняющуюся – гипнотика. Также возможно изменение скорости инфузии обоих препаратов независимо друг от друга.
Некоторые специалисты предпочитают установить постоянную инфузию опиоидов на уровне, обеспечивающем адекватную анальгетическую концентрацию в месте действия, в то время как скорость инфузии гипнотика изменять по необходимости. Но интенсивность ноцицептивной стимуляции изменяется во времени, поэтому инфузия анальгетика в дозе, эффективно подавляющей наиболее интенсивное болевое раздражение, может привести к относительной передозировки опиоида и замедлить восстановление самостоятельного дыхания в конце операции. В отличие от анальгезии, необходимый уровень угнетение сознания в ходе операции не изменяется, поэтому периоды «неадекватной анестезии» лучше всего устранять увеличением концентрации анальгетика в плазме. Режим введения, когда скорость инфузии гипнотика постоянна, а анальгетика – изменяется, обеспечивает наиболее быстрое пробуждение больного по окончании операции (Monk TG, Ding Y 1992). При решение вопроса о стратегии инфузии следует принимать во внимание фармакокинетику препаратов.
Тотальная внутривенная анестезия
Анализ крови на гликированный гемоглобин —
поможет выявить диабет на ранних стадиях!
БЕСПЛАТНО ПРОВЕДЁМ ЭКСПРЕСС ТЕСТ НА ГЛИКИРОВАННЫЙ ГЕМОГЛОБИН!
* в рамках консультации врача эндокринолога.

Гликированный гемоглобин
Биохимический показатель крови, который отражает среднее содержание глюкозы в крови за период до трёх месяцев. Этот анализ считается основным скрининговым исследованием на наличие или отсутствие сахарного диабета и преддиабета (обратимого состояния, при котором очень высок риск развития сахарного диабета 2‑го типа). Также данный показатель важен при диагностике гипоксии, чем выше показатель гликированного гемоглобина, тем больше кислородное голодание организма.Сахарный диабет
Понятие «сахарный диабет» охватывает несколько болезней эндокринной системы, вызванных проблемами в работе поджелудочной железы. Основное проявление болезни – недостаточная выработка инсулина. Его дефицит может быть абсолютным или относительным, однако и в том, и в другом случае растет уровень глюкозы в крови. Эта болезнь хроническая, в связи с чем больным сахарным диабетом следует с особым вниманием относиться к своему здоровью и регулярно приходить на прием к эндокринологуАнализ крови на гликированный гемоглобин поможет выявить диабет на ранних стадиях!
НАША КЛИНИКА РАДА ПРЕДЛОЖИТЬ ВАМ:

|
✔ Индивидуальный подход ✔ Врачи высшей категории ✔ Быстрая реабилитация ✔ Современные технологии лечения ✔ Амбулаторно и в условиях стационара |
* Подробности акции уточняйте в регистратуре клиники и у операторов контакт-центра по тел.: 8 (495) 120 08 10.
Тотальная внутривенная и комбинированная общая анестезия
В обзоре тотальная внутривенная и комбинированная общая анестезии не противопоставляются друг другу, а рассматриваются с позиции физиологических, клинических, фармакологических, технологических и методологических параллелей. Такой подход позволяет более широко заимствовать полезные свойства каждого метода анестезии.
С момента практического применения концепции тотальной внутривенной анестезии (ТВВА) ее стали сравнивать со сбалансированной общей анестезией. К сожалению, большинство исследователей независимо от симпатий и предпочтений вольно или невольно противопоставляли два метода. Принимая во внимание существование ряда различий между ТВВА и комбинированной общей анестезией (КОА), в том числе принципиальных, было бы интересно определить, что их объединяет. В работе рассмотрены физиологические, клинические, фармакологические, технологические и методологические аспекты двух методов анестезии.
С физиологической точки зрения ингаляционные и неингаляционные анестетики воздействуют на одни и те же рецепторы ЦНС, обусловливая собственно эффект анестезии. Их нейрофармакологические свойства одинаково зависят от химических характеристик (липофильности/ гидрофильности), степени связывания с белками, ионных взаимодействий и т. д.
Однако точный механизм развития анестезии неясен ни для одних, ни для других. Для некоторых внутривенных гипнотиков (этомидат, пропофол) установлен путь реализации эффектов через ГАМК-рецепторный комплекс (субъединицы Р2 и Р3) как наиболее вероятный. Для галогенсодержащих ингаляционных анестетиков ключевая роль рецепторов специфического типа (ГАМК-а, глициновых, калиево-натриевых ионных каналов) отчетливо не определена, подтверждается их действие не только на супраспинальном уровне, но и на уровне спинного мозга.
В связи с тем, что любая анестезия, включая регионарную, в настоящее время рассматривается как сбалансированная, мы будем использовать термин “комбинированная общая анестезия (КОА)”, подразумевая использование комбинации общего анестетика (галогенсодержащего, закиси азота или ксенона) с опиоидами и миорелаксантами.
Для обоих типов анестетиков характерна проблема лекарственных взаимодействий. Если летучие анестетики и закись азота взаимодействуют между собой аддитивно, то взаимодействие между собой внутривенных анестетиков или с ингаляционными чаще синергично, хотя R. S. Harris и соавт. установили простое аддитивное взаимодействие между пропофолом и севофлураном и связали место взаимодействия обоих препаратов с ГАМК-рецепторами типа А.
Известно, что для обоих типов анестетиков существуют достаточно тесные связи между концентрацией анестетика в крови, эффекторной зоне (головном мозге) и эффектом, хотя эти зависимости не всегда линейны. Для обоих видов анестетиков даже с самым коротким началом действия существует задержка эквилибрации между плазменной и эффективной концентрациями (эффект гистерезиса). Ни для пропофола, ни для севофлурана пол пациента не оказывает влияния на утрату сознания.
К каждому анестетику справедливо применение концепции многокомпартментной фармакокинетической модели, хотя имеются определенные различия в степени органного метаболизма ингаляционных и неингаляционных анестетиков. На скорость снижения концентрации и внутривенных, и ингаляционных анестетиков после прекращения введения влияет продолжительность их применения. Наряду с внутривенными препаратами (гипнотиками, опиоидами) концепция контекст-чувствительного периода полувыведения применима также к ингаляционным анестетикам.
Для расчета параметров кинетики внутривенных лекарственных средств (ЛС) для анестезии у конкретного пациента на основе оригинальных моделей успешно используются компьютерные программы STANPUMP (Stanford University, США), NONMEM (University of California, США), RUGLOOP II (University of Gent, Бельгия), TIVAtrainer (University of Leiden, Нидерланды) и др..
Для представления о компартментной кинетике ингаляционных анестетиков наибольшее распространение у клиницистов получила программа Gas Man® Anesthesia Simulator (Harvard Medical School, США). Подобно программам фармакокинетическо-фармакодинамического прогнозирования для внутривенных ЛС симуляционная программа Gas Man® дает возможность моделировать индивидуальное применение ингаляционных анестетиков. В обеих группах ЛС есть лидеры (ремифентанил и пропофол, севофлуран и десфлуран), контекст-чувствительный период полувыведения которых либо относительно краток, либо практически не зависит от времени экспозиции.
Клинические эффекты ингаляционных и неингаляционных анестетиков имеют больше сходств, чем отличий. Это касается эффекта выключения сознания, гораздо слабее выраженного анальгетического эффекта, аналогичного влияния возраста на фармакодинамику анестетиков, индивидуальной вариабельности. За известными исключениями (кетамин, ксенон) влияние на гемодинамику в целом депрессивное. Побочные эффекты также во многом сопоставимы: субъективная переносимость (дискомфорт и раздражение дыхательных путей при вдыхании паров или болезненность при внутривенном введении) и послеоперационные тошнота и рвота, дрожь, сонливость и некоторая иммуносупрессия и др.
В отношении интраоперационного пробуждения большинство изучающих проблему авторов сходятся во мнении, что существующих объемов исследований недостаточно для выявления разницы в частоте данного осложнения при проведении ТВВА и КОА.
Технические аспекты дозирования ингаляционных и неингаляционных анестетиков также похожи. В обоих случаях используется принцип титрования, только в одном применяется градуированный испаритель, с помощью которого создается объемная альвеолярная концентрация препарата, в другом — градуированный шприц, с помощью которого создается весовая концентрация препарата в крови. Как упоминалось, в последние годы с помощью ингаляционных анестетиков (севофлурана, изофлурана) стало возможным проведение седации посредством системы AnaConDa® (Anaesthetic Conserving Device, “Sedana Medical”, Швеция).
В контексте предупреждения непреднамеренного пробуждения во время анестезии очень важен вопрос о фактическом количестве анестетика в контуре доставки. С внутривенными анестетиками задача представляется простой. Для ингаляционных анестетиков типа закиси азота существовали очень приблизительные способы расчета оставшегося количества газа в баллоне. С внедрением системы централизованной подачи анестезиолог этого расчета сделать уже не может и должен следить за показателями давления газа.
Количество внутривенного анестетика в шприце всегда отчетливо видно. К тому же современные перфузоры предупреждают о скором окончании ЛС в шприце и автоматически рассчитывают период времени, на который препарата хватит при существующей скорости инфузии.
Традиционные испарители летучих анестетиков имеют в качестве индикатора столбик с уровнем жидкости, но не оснащены системой тревожной сигнализации. И только в системах последнего поколения (типа дозирующего модуля DIVA комплекса Zeus® фирмы “Drager Medical”) на дисплее монитора можно увидеть оставшееся количество анестетика в миллилитрах, получить звуковую, световую и текстовую сигнализацию о снижении количества анестетика в испарителе. Однако даже в этом случае нет указания времени, на которое хватит количества ЛС.
Главным недостатком систем для инфузии с управлением целевой концентрацией (ИЦК) препарата оппоненты считают виртуальность 3-секторной модели и принцип расчета (а не измерения) концентрации ЛС в плазме. Конечно, дозирование ингаляционных анестетиков по уровню МАК имеет определенные удобства, но МАК — величина расчетная, зависящая от ряда факторов (возраста, эффекта второго газа и др.), и во многом условная. Концентрация анестетика в выдыхаемой смеси больше соответствует его концентрации в контуре аппарата, чем в альвеолах и, тем более в мозге, к тому же зависит от точности торрирования испарителя, точности газоанализа. Точность производительности испарителей и перфузоров оценивается аналогичным образом — по уровням средней систематической ошибки (bias), медиане абсолютной ошибки предсказания (MDAPE), отклонения (divergence), колебания (wobble) и т. д.
МАК характеризуется низкой биологической вариабельностью. Ведущие производители современных испарителей летучих анестетиков разработали конструктивные механизмы, предупреждающие неточности дозирования под влиянием окружающей температуры, несущего газа, перемежающегося противодавления, утечки так называемого эффекта подкачивания и др.. Однако, по данным целого ряда исследований, все же выявляются определенные неточности в дозировании различных испарителей, а также погрешности в работе газоанализаторов.
Согласно данным литературы, причиной интраоперационного пробуждения может быть незамеченное вовремя прекращение доставки анестетика: опорожнение шприца, остановка перфузора или перегиб инфузионной линии при проведении ТВВА и опорожнение испарителя в результате утечки. Существенную роль играют качественные характеристики аппарата и соответствующих узлов. С целью уменьшения этих дефектов рекомендуется проводить калибровку оборудования с определенной периодичностью. В целом погрешность дозирования с помощью современных перфузоров сопоставима с таковой для испарителей (колебания на уровне 10—20%). При применении обоих классов анестетиков точность дозирования снижается при увеличении скорости подачи ЛС.
Следует признать, что управление целевой концентрацией внутривенного препарата пока не столь мобильно и предсказуемо, как управление МАК ингаляционного анестетика. В то же время удачный опыт управления целевой концентрацией относительно нерастворимых циклопропана и закиси азота послужил поводом для разработки 3-секторной модели для современных ингаляционных анестетиков.
Возможность контролируемого компьютером непосредственного введения жидкого анестетика в дыхательный контур была реализована компанией “Drager Medical” сначала в наркознодыхательном комплексе physioflex, затем в аппарате последнего поколения Zeus Infinity Empowered как TCA™ — Target-Controlled Anesthesia. Как и при проведении ТВВА ИЦК, анестезиолог устанавливает целевую концентрацию летучего анестетика в конце выдоха (см. рисунок), а встроенный системный процессор управляет дозирующим модулем DIVA. Таким образом, концепция управления целевой концентрацией в эффекторной зоне (Се или Cendtidal) оказалась перспективной и для ингаляционных анестетиков. В примитивном варианте применяется методика целевого дозирования ингаляционного анестетика путем управления его концентрацией на выдохе вручную (target ETAG — endtidal anesthetic gas).
Разработанный принцип дозирования внутривенных ЛС (гипнотиков, опиоидов) с управлением их концентрацией в плазме и эффекторной зоне по сути близок к неингаляционному испарителю. ЕС50 (минимальная концентрация анестетика) в крови, предотвращающая двигательную реакцию на разрез кожи у 50% пациентов, не что иное как аналогия МАК для ингаляционных анестетиков. J. A. Davidson и соавт. определили ЕС50 и ЕС95 для пропофола, его сочетания с N2O; J. Vuyk и соавт. — для сочетания пропофола и опиоидов. Аналогично тому, как МАК ингаляционных анестетиков снижается при добавлении опиоидов, так EC50 неингаляционных анестетиков при сочетанном введении с опиоидами существенно ниже. В частности, при сочетании с алфентанилом в дозе 250 нг\мл потребность в пропофоле снижается примерно вдвое.
Итак, МАК определяется как концентрация газа, предотвращающая двигательную реакцию на разрез кожи у 50% пациентов, но МАК, обеспечивающая выключение сознания, ниже этой концентрации. Поэтому стремление поддерживать концентрацию газа на уровне известного МАК во время анестезии с использованием опиоидов будет приводить к некоторой передозировке ингаляционного анестетика. Концентрация пропофола, обеспечивающая выключение сознания, составляет около 40% той, которая необходима для предупреждения реакции на разрез кожи. При дозировании неингаляционных анестетиков следует помнить, что в отличие от МАК концентрация ЛС рассчитывается и может существенно отличаться от измеренной. Возможно для большей безопасности целесообразно ориентироваться не на на ЕС95, а на ЕС95.
Эффекты обоих типов анестетиков оцениваются с помощью ЭЭГ-производных. Причем, за исключением ЛС, реализующих свое воздействие через NMDA- и Н-холинергические рецепторы (кетамин, закись азота, ксенон), эта оценка достаточно информативна. При использовании ЛС, воздействующих в основном на ГАМК-рецепторы (бензодиазепины, пропофол, летучие анестетики) ЭЭГ и ее производные (SEF, BIS- и AAI-индексы, энтропия) не всегда позволяют предугадать реакцию на болезненные стимулы, особенно в присутствии опиоидов.
Отрицательные стороны применения ингаляционных анестетиков с точки зрения загрязнения атмосферы и повреждения озонового слоя нашли отражение в Киотском протоколе ООН 1998 г. Однако никто не оценивает различия в степени загрязнении окружающей среды на этапе производства ингаляционных и неингаляционных анестетиков и утилизации их отходов (остатки вещества, флаконы, ампулы, упаковка и т. п.).
Наконец, одним из “снисходительных” упреков в адрес ТВВА был тезис о ее распространенности лишь в небогатых странах. Отчасти с сожалением приходится констатировать, что стоимость современной ТВВА значительно выросла. В эту величину входят цена перфузоров-микрокомпьютеров или инфузионных станций, требующих программного обеспечения и технического обслуживания, недешевых препаратов (например, пропофола, ремифентанила, рокурония), расходного инструментария, нейромониторов. В связи с этим не каждая клиника в развитой стране может себе позволить массовое применение современной ТВВА.
Многочисленные сравнительные исследования последних лет демонстрируют некоторое преимущество КОА (речь только о десфлуране и севофлуране) перед ТВВА (речь только о пропофоле, чаще с ремифентанилом) в сроках пробуждения и восстановления после операции. Дальнейшие различия (сроки пребывания в палатах пробуждения, безопасной выписки амбулаторных пациентов и влияние на исход операций у амбулаторных и стационарных больных) либо отсутствуют, либо незначительны. Правда, упоминается о несколько большей дороговизне ТВВА.
В исследованиях K. D. Rohm и соавт. анестезия на основе пропофол + ремифентанил чаще заканчивалась ознобом у пациента по сравнению с десфлуран-фентаниловой анестезией. Авторы использовали разные опиоиды, а, по нашему опыту и данным ряда авторов, вероятность озноба выше при применении ремифентанила. Кроме того, для ускорения пробуждения в группе десфлурана с успехом применялся физостигмин, у которого те же авторы в более ранних работах обнаружили свойство предупреждать возникновение послеоперационного озноба.
Таким образом, применение ингаляционных и неингаляционных анестетиков в рамках общей анестезии имеет много общих физиологических, клинических, фармакологических, технологических и практических основ. Продолжается сложный процесс создания новых более безопасных и управляемых анестетиков и улучшения свойств уже имеющихся, совершенствование технических средств. Рациональным является не их взаимное противопоставление, а устранение присущих каждому методу анестезии недостатков и совершенствование с использованием заимствования технологических нюансов.
В. И. Стамов, А. А. Бунятян
2012 г.
Тотальная внутривенная анестезия пропофолом по целевой концентрации
Тотальная внутривенная анестезия пропофолом по целевой концентрации
(Обзор литературы; первый опыт клинического применения)
А.А.БУНЯТЯН, Е.В.ФЛЕРОВ, В.И.СТАМОВ, К.М.ТОЛМАЧЕВ
На всем пути развития анестезии два основных метода — ингаляционная и внутривенная анестезии постоянно совершенствуясь и конкурируя, находили своих сторонников и противников. Исторически сложилось так, что ингаляционная анестезия, появившаяся раньше внутривенной, развилась от маски Schimmelbusch до современных испарителей обеспечивающих стабильную глубину анестезию. Современные испарители обеспечивают точную подачу ингаляционных анестетиков, автоматически компенсируя изменения температуры, давления и потока газов. Важной ступенью развития ингаляционной анестезии стало появление в операционных газоанализаторов, измеряющих концентрацию анестетика в конце выдоха. Именно современные испарители и газоанализаторы до настоящего времени позволяли ингаляционной анестезии одерживать несомненную победу над внутривенной. Главным достоинством ингаляционной анестезии является то, что анестезиолог, имея информацию о концентрации анестетика в конце выдоха и с какой-то долей приближения в крови, сопоставляя её с клиническими симптомами, осуществляет оптимальный контроль глубины анестезии. Постоянный неинвазивный мониторинг концентрации ингаляционных анестетиков позволяет анестезиологу в условиях индивидуальных фармакокинетических и фармакодинамических вариаций вести анестезию по отношению концентрация- эффект.
Что касается внутривенной анестезии, то мы до сих пор, применяя внутривенные анестетики, основываемся на дозах (мг на кг веса), что при переносе на ингаляционную анестезию сопоставимо с рекомендацией применения фторотана в дозе 0.5 мл на кг веса больного. Широко распространённой практикой является многократное болюсное введение препаратов. Автоматические шприцы позволяющие вводить препараты в широком диапазоне инфузионных скоростей, несомненно, являются более прогрессивной методикой. Однако поддержание оптимальных условий анестезии в условиях постоянно меняющейся степени хирургической агрессии даже с применением управляемых вручную автоматических шприцов затруднено.
Разработанные болюсно-инфузионные схемы (известная схема «десять- восемь- шесть» для пропофола (1) ) хороши только для стандартных условий и часто недостаточны для поддержания адекватной анестезии. И, тем не менее, во многих клинических ситуациях желательно проведение внутривенной анестезии. Последняя предпочтительна при проведении некоторых диагностических процедур, таких как ларингоскопия и бронхоскопия, в лёгочной хирургии, когда трудно или невозможно применить ингаляционную анестезию(2).
Ингаляционные анестетики необходимо избегать у пациентов с риском развития злокачественной гипертермии (3). Необходимо также помнить о загрязнении окружающей среды (разрушение озонового слоя атмосферы (4) ) и неблагоприятном воздействии ингаляционных анестетиков на медицинский персонал (5). Несмотря на безопасность у большинства пациентов такой ингаляционный анестетик как фторотан, может быть причиной гепатитов (6). Многие ингаляционные анестетики метаболизируются с образованием ионов фтора и трифторуксусной кислоты, что необходимо учитывать у пациентов с почечной недостаточностью. Увеличение продукции флюоридных ионов было отмечено при применении севофлюрана (7) и длительной анестезии изофлюраном (8). Послеоперационные рвота и тошнота более часты после ингаляционной анестезии, чем после тотальной внутривенной анестезии, особенно при использовании пропофола (9).
Фармакокинетический и фармакодинамический профили современных короткодействующих внутривенных анестетиков, аналгетиков и релаксантов, таких как пропофол, алфентанил, суфентанил, ремифентанил и мивакрон легко позволяют титровать дозу препарата для достижения желаемого эффекта у данного пациента. Результатом этого является достижение стабильной анестезии и быстрого выхода из неё. Всё более растёт интерес к тотальной внутривенной анестезии. В рамках Европейской ассоциации обществ анестезиологов создано общество тотальной внутривенной анестезии (EUROSIVA. Основные достоинства тотальной внутривенной анестезии (TIVA) сформулированы Sear J.W. (10) следующим образом. Современная TIVA позволяет:
— обеспечить высококачественные условия анестезии
— избежать продукции флюоридных ионов, связанной с применением некоторых ингаляционных анестетиков
— избежать перерастяжения наполненных воздухом пространств тела пациента и создать оптимальные условия для оперирующего хирурга
— избежать послеоперационной диффузионной гипоксии
— уменьшить частоту послеоперационной рвоты и тошноты
— минимизировать риск злокачественной гипертермии
— избежать токсических эффектов низких концентраций ингаляционных анестетиков на персонал операционной.
За последние 20 лет этомидат, мидазолам и пропофол были внедрены в клиническую практику для индукции и поддержания анестезии. Из них последний — Диприван (пропофол)- появившийся в1986 году, благодаря своим уникальным фармакокинетическим свойствам все более привлекает внимание анестезиологов. Фармакокинетика пропофола была тщательно изучена на добровольцах и больных с различной патологией при применении его в различных дозировках и по различным инфузионным схемам(11). Большинство исследователей сходится во мнении, что снижение концентрации пропофола в крови после достижения её пика описывается трёхэкспоненциальным уравнением независимым от размера болюса. Трёхкомпартментная модель необходима для адекватного описания первичного распределения, перераспределения и элиминации пропофола (Рис 1).
Рис. 1. Трёхкомпартментная модель с введением препарата в центральный компартмент (Vc), распределением в поверхностный (V2) и удаленный (V3) компартменты. К12, К21, К13 и К31 межкомпартментные постоянные времени управляющие рапределением препарта, а К10 постоянная времени элиминации препарата.
Выведение из центрального компартмента описывается трёхэкспоненциальным уравнением, где А, В, С сдвиги от оси Y, а a, b, g наклоны составляющих кривых.
Время полувыведения в фазу первичного распределения коротко и находится в пределах 2-3 мин., в промежуточную фазу распределения оно равно 30-60 мин. Терминальная фаза выведения пропофола более длительна и время полувыведения составляет 3-8 часов. Центральный объём первичного распределения (V1) непосредственно после инъекции составляет около 228 мл/кг. Клиренс пропофола сходен или превышает печеночный кровоток, что подтверждает внепеченочный путь биотрансформации. Чрезвычайно важно, что в клинических дозах форма нисходящего колена фармакокинетической кривой не зависят от применяемой дозы, а производные фармакокинетические параметры сходны в больших пределах дозировок.
При инфузии препарата нагрузочная доза (Д нагр.) вычисляется довольно просто, исходя из желаемой концентрации (К цель) пропофола в крови и объёма первичного распределения.
Д нагр = К цель · Vс
Поддерживающая инфузионная скорость вычисляется более сложно и включает дозу препарата компенсирующую клиренс его и временные межкампартментные потери управляемые постоянными времени т.е. коэффициентами К12, К21, К13 и К31.
Поддерживающая инфузионная скорость (t)
= К цель · Vс (К10+[К12е-К21.t] + [К 13е-К31.t])
Ясно, что вычисление подобных уравнений и управление инфузионным шприцем постоянно на протяжении всей инфузии препарата невозможно без применения вычислительной техники. Разработки программного обеспечения, позволяющего управлять двигателем инфузионного шприца для достижения желаемой концентрации препарата в крови начались еще в восьмидесятые годы. В 1983 году Schuttler et al. разработали программу компьютерного моделирования динамики концентрации препаратов для внутривенной анестезии (IVA-SIM) и систему управления инфузионным шприцем для тотальной внутривенной анестезии (CATIA), основанную на ней(12). Дальнейшие работы академических центров и, особенно, университета Глазго поддержанные фирмой Zeneca Pharmaceuticals, позволили в 1996 году создать систему «Diprifusor» TCI, представляющую собой микропроцессорную плату с программой фармакокинетической модели для управления серийным автоматическим шприцом.
Фармакокинетические параметры, используемые в программном обеспечении «Diprifusor», представлены в таблице 1.
Табл. 1. Фармакокинетические параметры пропофола, используемые в программном обеспечении системы «Diprifusor» TCI (© Университет Глазго).
Термин внутривенная анестезия по целевой концентрации (Target Controlled Infusion, TCI) используется для обозначения нового способа применения препарата, который упрощает технику его в/в введения и улучшает контроль за действием препарата. Анестезиолог, используя технику анестезии с инфузией пропофола по целевой концентрации, просто меняет целевую концентрацию, а система «Diprifusor» TCI автоматически управляет скоростью инфузии пропофола для достижения желаемой концентрации пропофола в крови, т. е. глубины анестезии.
Система анестезии с инфузией пропофола по целевой концентрации (ИЦК) не является системой полного компьютерного контроля анестезии, т.е. системой с обратной связью. Обратная связь осуществляется анестезиологом проводящим анестезию. При использовании ИЦК анестезиолог управляет целевой концентрацией препарата, ориентируясь на клинические симптомы глубины анестезии или более сложные методы мониторинга. Вместо расчёта и установки инфузионной скорости в размерности мг/кг/час анестезиолог вводит следующее:
— вес пациента
— возраст пациента
— требуемую концентрацию препарата (целевую концентрацию пропофола в крови — мкг/мл).
Таким образом, управление анестезией с инфузией пропофола по целевой концентрации просто для практического анестезиолога. Однако, эта простота обеспечена компьютерной поддержкой, практически реализующей комплексные фармакокинетические и программные разработки исследователей ряда академических групп. Систему «Diprifusor» TCI можно рассматривать как интеллектуальную инфузионную систему, которая во время вводной анестезии, используя фармакокинетическую модель, вычисляет нагрузочную дозу, включает высокую (до 1500 мл в час) скорость до достижения целевой концентрации препарата в крови. Далее автоматически поддерживает выбранную целевую концентрацию, постоянно уменьшая скорость инфузии для компенсации неизбежной кумуляции препарата. Целевая концентрация может быть изменена анестезиологом в любой момент времени. Выбор более высокой концентрации ведёт к назначению болюса и увеличению скорости инфузии. Выбор анестезиологом более низкой концентрации сопровождается выключением мотора шприца и, после модельно вычисленного достижения новой целевой концентрации, назначением более низкой инфузионной скорости.
Целевая, вычисляемая и эффективные концентрации пропофола отображаются на дисплее автоматического шприца. Наиболее интересна последняя, которая позволяет оценить изменение концентрации в эффекторной зоне, т.е. в мозгу. Понятно, что наступление анестезии предполагает достижение необходимой концентрации анестетика в мозгу. Имеется определённая задержка между достижением некоторой концентрации препарата в крови и наблюдаемыми клиническими эффектами влияния на центральную нервную систему. Задержка связана с переходом препарата гемато- энцефалического барьера и различной концентрацией препарата в крови и мозгу. Теоретически, медленная индукция с соответствующими низкими инфузионными скоростями препарата приводит к минимизации градиента концентраций в крови и мозгу из-за более длительного времени уравновешивания(13). С высокой концентрацией пропофола в крови связывается развитие неблагоприятных гемодинамических эффектов пропофола. В системе «Diprifusor» TCI реализована возможность программированного удлинения периода индукции, что позволяет при одинаковых или даже более низких целевых концентрациях в крови получать более высокие эффективные концентрации (Рис.2)(14).
Рис. 2. Динамика концентрации пропофола в крови и эффективной концентрации при установке времени индукции 0 мин (болюс), 5 мин и 10 мин.
Рис. 3. Основные компоненты системы «Diprifusor» TCI инфузии пропофола по целевой концентрации.
Основными элементами системы инфузии пропофола по целевой концентрации является (Рис. 3):
— электронная плата «Diprifusor» TCI, включающая:
+ компьютерную программу, реализующую фармакокинетическую модель со специфическими параметрами препарата
+ алгоритм контроля инфузионной скорости
+ систему коммуникации плата — двигатель шприца
+ систему автоматического распознавания соответствующего шприца-ампулы с диприваном
-автоматический шприц
-пользовательский интерфейс для ввода данных пациента и целевой концентрации препарата.
При проведении ИЦК должен быть гарантирован венозный доступ (канюля диаметром не менее 18G), проходимость дыхательных путей (воздуховод, лярингеальная маска, интубационная трубка), а также достаточная подача газа для обеспечения адекватной концентрации кислорода на вдохе.
В настоящее время три фирмы Greseby Medical (Англия), Vial Medical (Франция) и ALARIS Medical Systems (Англия) производят автоматические шприцы со встроенной системой «Diprifusor» TCI. Для проведения ИЦК необходимо использовать одноразовые ампулы- шприцы («Diprivan» Pre-Filled Syringe) со специальным электронным ярлыком, разрушаемым при окончании инфузии, что даже в Российских условиях предотвращает его повторное использование.
Системы инфузии пропофола по целевой концентрации оценивались в исследовательских работах поддержанных фирмой Zeneca Pharmaceuticals с двух точек зрения: сравнение предсказанной (вычисленной) концентрации препарата с измеренной и клинической оценки системы. В различных исследованиях было показано, что при проведении анестезии с инфузией пропофола по целевой концентрации, предсказанная концентрация препарата коррелирует с измеренной с коэффициентом 0.95, а средняя ошибка предсказания (Bias) и средняя абсолютная ошибка предсказания (Precision) меньше, чем при ингаляционной анестезии изофлюраном (см. Табл. 2) (14).
Табл. 2. Значения средней систематической ошибки определения и средней абсолютной ошибки разброса данных предсказания по концентрации изофлюрана на вдохе и выдохе концентрации изофлюрана в крови и те же параметры предсказания концентрации пропофола в крови по целевой концентрации при ИЦК.
Более высокая точность предсказания концентрации пропофола при нуле инфузионной скорости объясняется меньшей ошибкой определения пропофола в крови связанной с неадекватным смешиванием препарата при быстрых скоростях инфузии.
Клиническая оценка метода ИЦК проведенная рядом авторов(15 — 21) показала, что ИЦК обладает рядом преимуществ перед анестезией пропофолом с ручным управлением инфузионным шприцом. Удобство использования характеризуется:
— простотой управления
— лёгкостью титрования уровня анестезии
— отображением текущей, вычисленной концентрации пропофола в крови
— предсказанием времени пробуждения пациента при прекращении инфузии
— компенсацией прерывания инфузии (смена шприца)
— отсутствием необходимости проведения сложных вычислений инфузионных скоростей и введенных доз во время анестезии.
Всё это обеспечивает хороший контроль глубины в сочетании со стабильностью анестезии и адекватным управлением параметрами гемодинамики и дыхания.
В результате клинических исследований выработаны рекомендации по целевым концентрациям в различных клинических ситуациях. У взрослых пациентов (до 55 лет) без премедикации используемая целевая концентрация для индукции колеблется от 4 до 8 мкг/мл. У пациентов с премедикацией начальная концентрация не превышает 4мкг/мл, у пациентов без премедикации можно начинать с 6мкг/мл. Более низкие начальные целевые концентрации нужно использовать у больных старше 55 лет и у пациентов с высокой степенью анестезиологического риска. Поддерживающие концентрации находятся в пределах от 3 до 6 мкг/мл.
Аналогично понятию минимальная альвеолярная концентрация (МАС) для анестезии по целевой концентрации вводится параметр EC50 — концентрация анестетика в крови, предотвращающая двигательную реакцию на разрез кожи у 50 % пациентов. Как показал Davidson et al. (15), ЕС50 для пропофола у пациентов получающих только кислород составляла 6.0 мкг/мл, ЕС95 — 6.2 мкг/мл, при дыхании 67 % закиси азота эти концентрации снижались до 4.5 и 4.7 соответственно.
Работы Vuyk (22) свидетельствуют о значительной интерференции пропофола и применяемых аналгетиков. Пропофол изменяет метаболизм опиоидов с увеличением концентрации их в плазме. В свою очередь, такие опиоиды как алфентанил увеличивают концентрацию пропофола, уменьшая объём распределения и клиренс пропофола. Применение опиоидов в клинических концентрациях уменьшает ЕС50 и ЕС95 пропофола. При инфузии фентанила эти параметры составляют 3.4-5.4 соответственно; алфентанила 3.2-4.4; суфентанила 3.3-4.5; снижаясь при инфузии нового опиоида короткого действия ремифентанила до 2.2-2.8 мкг/мл.
Исследование ИЦК в сравнении с ручным управлением инфузией пропофола в мультицентрическом исследовании, включившем 19 госпиталей Голландии показало, что 68% анестезиологов считают более высоким качество анестезии с применением ИЦК. В этом же исследовании 68.4% анестезиологов, сравнивая свой опыт ингаляционной анестезии с ИЦК, отдают предпочтение последней. 26.3% предпочитают ингаляционную анестезию, а 5.3% не видят особых различий (16).
В заключении необходимо подчеркнуть, что анестезия с ИЦК никак не уменьшает необходимый уровень мониторинга состояния пациента. Более того, дальнейшее совершенствование ИЦК авторами метода видится в разработке систем с обратной связью на основе применения более сложных методов оценки глубины анестезии, таких как слуховые вызванные потенциалы, спектральный и биспектральный анализ(23).
Осенью 1998 мы получили от фирмы Zeneca Pharmaceuticals автоматический шприц Vial Master TCI. Перед нами была поставлена задача оценить методику ИЦК в общей хирургии и сопоставить вычисленные и эффективные концентрации пропофола с параметрами спектрального анализа ЭЭГ.
Методика была применена у 21 пациента (13 женщин и 8 мужчин; средняя масса тела 73.4 кг) в физическом состоянии ASA 1-11 для анестезии при проведении общехирургических операций (грыжесечение; эндоскопическая холецистэктомия). Первая тотальная внутривенная анестезия пропофолом с ИЦК была проведена 22-09-98 г.
Методика анестезии
Премедикация: седативные на ночь, утром (за 40 минут) промедол, атропин внутримышечно в стандартных дозировках. Индукция: одновременно — инфузия фентанила в дозе 5-7 мкг/кг/час с помощью автоматического шприца Gresby 3100 и пропофола с целевой концентрацией от 2 до 4 мкг/мл c помощью шприца Vial Master TCI. После засыпания больного — миорелаксант: атракуриум (0.6 мг/кг) или мивакрон (0.2 мг/кг). Интубация или установка лярингеальной маски, ИВЛ газовой смесью воздух — кислород (FiO2 0.4) с поддержанием ЕТСО2 в пределах 35-37 мм рт. ст.. Поддержание: продолжение инфузии фентанила со скоростью 5 мкг/кг/час, прекращение её приблизительно за 20 мин до окончания операции; управление целевой концентрацией пропофола по фармакодинамической реакции пациента; по достижении 10% нервно-мышечной проводимости — инфузия релаксанта с помощью автоматического шприца Perfusor E (Braun, Германия) со скоростью необходимой для поддержания нервно-мышечной проводимости в пределах 5 ± 4 %, за 10-15 мин до окончания операции выключение инфузии; удаление лярингеальной маски или экстубация при ТОF не менее 75%.
Мониторно-компьютерное оборудование
Для поминутного неинвазивного контроля артериального давления и сатурации гемоглобина артериальной крови использовали прибор CritiCare 507 O. Биоэлектрическую активность мозга (правое лобно-затылочное отведение) регистрировали с помощью монитора МХ-03. Газоанализатор Capnomac (Datex-Ohmeda) использовали для управления объёмом вентиляции и контроля состава газовой смеси. Акселлерометрический контроль нервно-мышечной проводимости осуществляли с помощью монитора Tof-Gard (Organon Teknica). С помощью персонального компьютера в реальном масштабе времени проводился спектральный анализ ЭЭГ в полосе частот от 1 до 24 Гц с вычислением средних мощностей в полосах 1-4, 4-8, 8-12, 12-18 и 18-25 Гц, а также средней частоты и частоты правого края. Через последовательный интерфейс компьютер каждую минуту собирал одновременно данные об артериальном давлении и сатурации гемоглобина артериальной крови. Вместе с комментариями анестезиолога, выбираемыми из меню, эти данные составляли автоматическую компьютерную анестезиологическую карту. После операции к цифровому файлу динамики параметров кровообращения, сатурации и спектрального анализа ЭЭГ припаивался синхронизированный по времени файл поминутной динамики скоростей инфузии, вычисленных концентраций в центральном компартменте и эффективной концентрации пропофола, который получали скидывая информацию из памяти автоматического шприца Vial Master TCI с использованием программы Terminal WINDOWS. Полученный файл в формате Excel использовали для статистического анализа.
Результаты
Первая проведенная на своём коллеге анестезия показала, что рекомендуемая целевая концентрация пропофола у пациентов после премедикации в 4 мкг/мл с длительностью индукции 90 секунд приводит к кратковременному резкому снижению артериального давления на 70 мм рт. ст. по сравнению с исходным уровнем. Это снижение было быстрообратимым после назначения более низкой целевой концентрации пропофола и струйной инфузии 5% глюкозы. В дальнейшем мы стали подходить более осторожно к выбору целевой концентрации, учитывая эффект премедикации, состояние пациента, растянули время индукции до 5 минут и предваряли индукцию быстрой инфузией 300- 400 мл 5% глюкозы.
Целевые концентрации на индукцию в среднем составили 3.0 мкг/мл (от 2 до 3.9). Доза пропофола до интубации составила 140.5 мг. Больные спокойно засыпали через 3-4 мин после начала инфузии пропофола при достижении вычисляемой концентрации в центральном компартменте (СV1) 2.9 мкг/мл (от 1.2 до 3.9). В это время эффективная концентрация (СVЭ) составляла 1.4 мкг/мл (от 0.9 до 3.0). Целевая концентрация пропофола во время поддержания анестезии в среднем составила 2.6 мкг/мл (от 1.3 до 3.3), уменьшаясь до 1.5 мкг/мл (от 0.8 до 2.2) после интубации до разреза кожи, к концу операции и увеличиваясь до 4 мкг/мл (от 1.7 до 6) на основном этапе операции. Длительность инфузии пропофола составила в среднем 91 мин., доза 703 мг.
Таким образом, расход препарата составил в среднем 475 мг/час или 6.5 мг/кг/час.
СV1 пробуждения больного составила в среднем 0.9 мкг/мл, СVЭ — 1.0 мкг/мл.
Контроль релаксации с помощью монитора Tof-Gard и контроль времени пробуждения системой «Diprifusor» TCI делали пробуждение больных комфортным. Если диагностировалась остаточная релаксация, мы назначали минимальную целевую концентрацию пропофола в крови и только после достижения TOF 75% останавливали инфузию его. После восстановления адекватного по газоанализу самостоятельного дыхания у больного удалялась лярингеальная маска или проводилась экстубация. Через одну-две минуты больной начинал ориентироваться и уже был в состоянии вспомнить номер своего домашнего телефона. Ни в одном случае при переводе на дыхание окружающим воздухом SpO2 не снижалось ниже 95%. Состояние больных после операции было настолько удовлетворительным, что позволяло после часового пребывания в палате пробуждения переводить их, минуя отделение интенсивной терапии в палату общехирургического отделения. В послеоперационном периоде в течение 2-3 часов сохранялась сонливость, но голова, по словам больных «была светлой». Только у двух больных отмечена тошнота, а у одного однократная рвота.
Практическая работа с ИЦК показала, что применение венозной канюли 20G — иногда создаёт высокое сопротивление с появлением алярма — окклюзия.
При отсутствии одноходового клапана необходимо подсоединять «Diprifusor» TCI через трёхходовой краник, одеваемый непосредственно на внутривенную канюлю для минимизации мертвого пространства и возможного неточного вычисления концентрации препарата в крови во время прерывания инфузии при смене флакона(14).
Довольно важным критерием любой анестезии является её стоимость. На Российском рынке при стоимости ампулы дипривана около 7 долларов, один час анестезии ИЦК стоит более 15 долларов в час. “Более” является следствием кванта пропофола в 50 мл. Если Вам необходимо на всю анестезию 52 мл пропофола, Вы должны использовать две ампулы- шприца «Diprivan» Pre-Filled Syringe.
Динамика артериального давления и частоты пульса была характерной для анестезии пропофолом. Даже растянутая индукция с низкой целевой концентрацией пропофола сопровождалась снижением артериального давления на 20-30 мм рт. ст. и уменьшением частоты сердечных сокращений на 10-15 уд в мин. Интубация или установка лярингеальной маски вызывали подъём давления на 10-15 мм рт. ст.. Через 15-20 минут после интубации давление стабилизировалось на уровне 10-15 мм рт. ст. ниже исходного уровня. Артериальное давление возвращалось к исходному только с окончанием анестезии.
Индукция пропофолом по целевой концентрации сопровождалась увеличением спектральной мощности в частотных диапазонах от 1 до 10 Гц, появлением характерной бимодальности спектра мощности ЭЭГ и уменьшением частоты правого края без изменения средней частоты. Такие характерные для анестезии пропофолом изменения спектральных характеристик были описаны нами ранее (1995 г 24). Однако впервые стало возможным сопоставить эти изменения с концентрацией пропофола в крови и мозгу. Проведенный корреляционный анализ по массиву данных после выключения инфузии пропофола (6 пациентов,146 пар сравнения) СV1 и СVЭ с параметрами спектрального анализа ЭЭГ показал, что наиболее значимый коэффициент корреляции (r=-0.64) имеется между СVЭ и частотой правого края. Эта отрицательная зависимость наглядно представлена на рисунке 4.
Рис. 4. Динамика частоты правого края спектра мощности ЭЭГ и вычисленной (СV1) и эффективной концентрации (СVЭ) пропофола у больной Г. (и/б 402524) во время анестезии пропофолом по целевой концентрации.
Однако на всём массиве данных, когда концентрация может увеличиваться до значений 3.5 мкг/мл, зависимость частоты правого края от эффективной концентрации (СVЭ) пропофола линейна только при значениях концентрации от 0 до 2.0 мкг/мл (Рис 5).
Рис 5. Зависимость частоты правого края от эффективной концентрации пропофола.
Обсуждение и заключение
Таким образом, тотальная внутривенная анестезия с инфузией пропофола по целевой концентрации — это легко управляемая анестезиологом, комфортная для больного анестезия. Определённой проблемой остаётся гипотензивная реакция во время индукции. Стратегия управления для минимизации гипотензивного действия пропофола во время индукции складывается из объёмной нагрузки для компенсации возможного венодилятирующего действия пропофола. У наших больных после премедикации, на фоне несомненного потенцирующего действия фентанила (22) первичная целевая концентрация пропофола должна быть снижена до 3 мкг/мл. Индукцию рекомендуется удлинить до 5 минут. После засыпания больного целевую концентрацию пропофола сразу нужно уменьшить до значений эффективной концентрации плюс 10%.
Поддержание анестезии при ИЦК основывается на выборе анестезиологом целевой концентрации пропофола на основе фармакодинамической реакции пациента. В основном это управление по динамике артериального давления, частоты пульса или движениям больного при анестезии без релаксантов. Однако анализ зависимости частоты правого края спектра мощности ЭЭГ от эффективной концентрации пропофола позволяет предположить, что глубина сна после достижения пропофолом концентрации в мозгу около 2.5 мкг/мл далее по мере увеличения её не изменяется. Увеличивая целевую концентрацию пропофола, анестезиолог увеличивает концентрацию препарата на рецепторах системы кровообращения и блокирует гипертензионную реакцию, используя определённое депрессивное действие пропофола на гемодинамику. Использование высоких доз фентанила возможно, но теряется все преимущество комфортного, быстрого выхода из анестезии характерного для ИЦК. Определенные надежды связываются с появлением короткодействующего мощного опиоида — ремифентанила. Первые проведенные нами анестезии с инфузией пропофола по целевой концентрации 3 мкг/мл и ремифентанила со скоростью 15 мкг/кг/час наряду с высокой стабильностью кровообращения характеризовались быстрым пробуждением больных без депрессии дыхания. Сейчас многими фирмами ведутся работы по созданию комплексных систем инфузии ряда препаратов по целевой концентрации. Фирма Braun (Германия) предполагает в апреле 1999 года выпустить автоматический шприц для инфузии по целевой концентрации пропофола, ремифентанила и мивакрона. Все это свидетельствует о перспективности дальнейшей работы в области применения систем ИЦК и необходимости внедрения их в практику Российского Здравоохранения.
Библиография:
1. Roberts F.L. et al.: Induction and maintenance of propofol anaesthesia: a manual infusion scheme. Anaesthesia 1988; 43 (Supplement): 14-7.
2. Milligan K.R. et al.: Propofol anesthesia for major thoracic surgery. J Cardiothorac Anest 1990;4:323-5.
3. Cartwright D.P.: Propofol in patients susceptible to malignant hyperpyrexia [Letter]. Anaesthesia 1989;44:173. 1.
4. Trapp D. et al.: Input of volatile anaesthetics into the atmosphere and their fate. Br J Anaesth 1998; v 80 (Suppl. 2): A1.
5. Трекова Н.А.: Анестезиологические аспекты профилактики цитогенетических эффектов ингаляционных анестетиков. Дисс. докт., Москва, 1986.
6. Brown B.R.: Inhalational anaesthetics and hepatotoxicity: an update. Acta Anaesthesiol Scand 1991;35:42-3.
7. Frink E.J. et al.: Plasma inorganic fluoride with sevofluran anesthesia: correlation with indices of hepatic and renal function. Anesth Analg 1992;74:231-5.
8. Breheny F.X.: Inorganic fluoride in prolonged isoflurane sedation. Anaesthesia 1992;47:32-3.
9. Raftery S., Sherry E.: Total intravenous anaesthesia with propofol and alfentanil protects against postoperative nausea and vomiting. Can J Anaesth 1992;39:37-40
10. Sear J.W.: Continuous infusions of hypnotic agents for maintenance of anaesthesia. In: Kay B, ed. Total intravenous anaesthesia. (Monographs in Anaesthesiology, Vol.21). Amsterdam: Elsevier Science Publishers,1991:15-55.
11. Kanto J., Gepts E.: Pharmacokinetic implications for the clinical use of propofol. Clinical Pharmacokinetics 1989; 17:308-26.
12. Schuttler J, Schwilden H, Stoeckel H.: Pharmacokinetics as applied to total intravenous anaesthesia. Anaestesia 1983; 38(suppl): 53-6.
13. Gentry W.B. et al.: Effect of infusion on thiopental dose response relationship: assessment of a pharmacokinetic- pharmacodynamic model. Anesthesiology 1994; 82: 316-24.
14. Engbers F.: Practical use of » Diprifusor» systems. Anaesthesia 1998; (Suppl. 1): 28-34.
15. Davidson J.A. et al.: The effective concentration 50 for propofol with and without 67% nitrous oxide. Acta Anaestheiol Scand 1993;37:458-64.
16. Engbers F.: Target controlled infusion in practice. Eur J Anaesth 1995; 12(suppl 10):88-90.
17. Ausems M. et al.: Comparison of a computer-assisted infusion versus intermittent bolus administration of alfentanil as a supplement to nitrous oxide for lower abdominal surgery. Anaesthesiology 1989; 71:A273.
18. Chaudri S. et al.: Induction of anaesthesia with propofol using a target-controlled infusion system. Anaesthesia 1992; 47: 551-3.
19. Grimaud J.C. et al.: Propofol anesthesia for colonoscopy: comparison of manual administration with target control infsion (TCI). Gastroenterology 1995;108:A16.
20. Russell D. et al.: Manual versus target controlled infusion: a comparison of the quality of anaesthesia achieved by the infusion of propofol using manual or target-controlled systems. Br J Anaesth 1995; 74: A275.
21. Newson C. et al.: Propofol sedation: use of infusion pumps versus manual administration. Anaesthesiology 1993; 97:A3.
22. Vuyk J.:TCI: Supplementation and drug interactions. Anaesthesia 1998; (Suppl. 1): 35-41.
23. Kenny G. N. C. and Sutcliffe N.P.: Target-Controlled Infusion: Stress Free Anesthesia?. J Clin Anesth 1996; 8 (3S) : 15S-20S.
24. Бунятян А. А., Флёров Е. В. и др.: Мониторно-компьютерная система анестезиолога на основе персонального компьютера (2-летний опыт разработки и эксплуатации). Анестезиология и реаниматология № 2 1995г. стр. 62-66.
Тотальная внутривенная анестезия на основе дипривана без ивл
Тотальная внутривенная анестезия (TIVA)
![]()
Тотальная внутривенная анестезия (англ. Total intravenous anesthesia, TIVA) — это метод проведения анестезии, использующий сочетание препаратов вводимых только внутривенным путем, без использования ингаляционных агентов (ингаляционная анестезия).
Невозможность проведения ингаляционной анестезии или ситуации, когда традиционные системы доставки анестетиков пациенту недоступны, непрактичны — разумные показания для проведения TIVA. Во всех других случаях TIVA может улучшить процедуру, сделав ее эффективнее и благоприятнее для пациента.
Тотальная внутривенная анестезия по сравнению с традиционной ингаляционной анестезией предлагает несколько потенциальных преимуществ.
- Снижение послеоперационной тошноты и рвоты.
- Снижение загрязнения окружающей среды.
- Предсказуемое и быстрое восстановление пациента.
- Гемодинамическая стабильность.
- Сохранение гипоксической легочной вазоконстрикции.
- Снижение внутрисосудистого давления.
- Снижение риска токсичности для органов пациента.
В последнее время TIVA становится более популярной, практичной и применяемой вследствие двух основных причин, приведенных далее.
- Улучшенные фармакокинетические и фармакодинамические свойства препаратов, таких как Пропофол, и новые опиоидные анальгетики короткого действия, которые делают их пригодными для внутривенного введения.
- Новые концепции фармакокинетического моделирования в сочетании с достижениями в области автоматизированной инфузии, которые позволяют использовать алгоритмы инфузии по целевой концентрации (TCI).
Простота и удобство использования для персонала, осуществляющего уход за больным, а также быстрое и комфортное востановление пациента являются неотъемлемыми преимуществами TIVA, проводимой при помощи инфузии по целевой концентрации (TCI) перед традиционной ингаляционной анестезией.
Комбинированные стратегии обезболивания могут быть применены, когда необходимо послеоперационное проведение анестезии. В таком случае проводниковая анестезия может использоваться до, а TIVA в послеоперационный период, чтобы ускорить восстановление пациента.
TIVA может проводиться как с одним, так и с комбинацией препаратов. Фармакологический профиль (фармакокинетика) препарата может прояснить его клинические аспекты и тем самым помочь в выборе лекарственного средства. Наиболее часто используемые группы препаратов — гипнотики и опиодные анальгетики короткого действия.
Открытие Пропофола в 70-е годы произвело революцию в использовании TIVA. На сегодняшний день это единственный вводимый внутривенно активный гипнотический агент, предназначенный для проведения и поддержания анестезии.
Преимуществами методик TIVA, основанных на пропофоле, являются: быстрое восстановление сознания и физикомоторных функций, ускоренная реабилитация пациента и низкая вероятность тошноты и рвоты в послеоперационный период.
Пропофол может использоваться в сочетании с опиоидами, мышечными релаксантами и нестероидными противовоспалительными средствами в зависимости от статуса пациента или процедуры, которую необходимо выполнить.
Опиоидные анальгетики короткого действия, такие, как Ремифентанил, предпочтительны при использовании методики проведения инфузии по целевой концентрации (TCI). Было замечено, что использование в плановой хирургии Ремифентанила и Пропофола при проведении TIVA с помощью TCI позволяет более эффективно контролировать оперативное вмешательство, и в тоже время ускорять процесс пробуждения пациента после анестезии. Также это подтвердилось и в амбулаторной хирургии.
Так как TIVA может проводиться только внутривенно, выбирать приходится между периферическим и центральным венозным доступом. Этот выбор чаще всего обусловлен состоянием пациента или количеством и типом препаратов, которые будут вводиться.
Для краткосрочных процедур, где нет необходимости в артериальном доступе, могут использоваться периферические венозные катетеры.
Для пациентов, которые нуждаются в послеоперационной инфузии (тяжелобольные пациенты) или пациентов, получающих несовместимые друг с другом препараты, рекомендуется использовать многоканальные катетеры. В неонатологии или педиатрии может использоваться игла-бабочка.
Метод проведения TIVA при помощи TCI в высокой степени зависит от выбранного лекарства или режима введения, что, в свою очередь, влияет на процесс приготовления лекарственного средства. Готовые к использованию препараты могут набираться сразу в шприц или через фильтр.
Для лекарств, требующих предварительного приготовления (смешивания), могут использоваться безыгольные устройства и пакеты для смешивания. В зависимости от выбора метода проведения инфузии или комбинации лекарственных препаратов могут быть доступны специальные процедурные наборы, включающие все необходимые устройства, пеленки и салфетки.
Такие наборы могут сделать процедуры более безопасными и эффективными.
Выбор устройства для введения препарата, также как приготовление лекарства и доступ к пациенту, зависят от метода и лекарства, которое будет использоваться в проведении TIVA. Для индукции или инъекции анальгезирующего средства до вводного наркоза может использоваться шприц. Анестезия при помощи TCI проводится с применением инфузионных насосов.
В последнее время инфузионные шприцевые насосы быстро развивались. На сегодняшний день автоматизированные инфузионные насосы имеют встроенные алгоритмы проведения TCI с широко используемыми в TIVA препаратами. Насосы совместимы со шприцами и удлинительными линиями, которые позволяют одновременно вводить более одного лекарственного средства.
Также для совмещения или разделения потоков применяются трехходовые краны.
Сама по себе TIVA не поддерживает послеоперационный контроль боли, однако продолжительная анальгезия может быть достигнута при комбинировании TIVA и регионарной анестезии.
Если регионарная анестезия не проводилась или послеоперационная боль может быть устранена при помощи внутривенных вливаний анальгезирующего препарата, то инфузионный насос может быть незамедлительно переведен в нужный режим, тем самым улучшая общее удовлетворение пациента.
- ‘Total Intravenous Anesthesia using a target controlled infusion – A pocket reference’, College of Anesthesiologists, Academy of Medicine Malaysia (retrieved 07.10.15).
- Campbell, L., Engbers, F. H., & Kenny, G. N. (2001). Total intravenous anaesthesia. CPD ANAESTHESIA, 3(3), 109-119.
- Ozkose, Z., Ercan, B., Ünal, Y., Yardim, S., Kaymaz, M., Dogulu, F., & Pasaoglu, A. (2001). Inhalation versus total intravenous anesthesia for lumbar disc herniation: comparison of hemodynamic effects, recovery characteristics, and cost. Journal of neurosurgical anesthesiology, 13(4), 296-302.
- Aunac, S., Carlier, M., Singelyn, F., & De Kock, M. (2002). The analgesic efficacy of bilateral combined superficial and deep cervical plexus block administered before thyroid surgery under general anesthesia. Anesthesia & Analgesia, 95(3), 746-750.
- Nora, Fernando Squeff. (2008). Total intravenous anesthesia as a target-controlled infusion: an evolutive analysis. Revista Brasileira de Anestesiologia, 58(2), 179-192. Retrieved October 07, 2015, from //www.scielo.br/scielo.php?script=sci_arttext&pid=S0034-70942008000200011&lng=en&tlng=en. 10.1590/S0034-70942008000200011.
- Absalom A & Struys M. An Overview of TCI & TIVA. Second Edition., 2011; Gent: Academia Press
- Hogue, C. W., Bowdle, T. A., O’Leary, C., Duncalf, D., Miguel, R., Pitts, M., … & Batenhorst, R. (1996). A multicenter evaluation of total intravenous anesthesia with remifentanil and propofol for elective inpatient surgery. Anesthesia & Analgesia, 83(2), 279-285.
Не вся продукция зарегистрирована и допущена для использования во всех странах или регионах. Показания к применению могут отличаться в зависимости от страны или региона. Пожалуйста, обращайтесь к местному представителю компании для получения информации о продукции. Изображения продукции приведены исключительно для получения общего представления
Источник: //www.bbraun.ru/ru/products-and-therapies/pain-therapy/total-intravenous-anesthesia-TIVA.html
Внутривенные анестетики: пропофол, тиопентал и кетамин. Что нового?
![]()
Внутривенные анестетики (неингаляционные анестетики) используются для вводного наркоза и поддержания анестезии, а также для проведения седации.
Современные препараты для внутривенной анестезии — пропофол, тиопентал и кетамин.
Сравнивая внутривенные анестетики с ингаляционными, приходится констатировать, что внутривенные анестетики менее управляемые с позиции анестезиолога.
Вопрос управляемости — это возможность контролировать концентрацию анестетика на всех этапах анестезии (индукция, поддержание и пробуждение). При этом концентрацию внутривенного анестетика можно измерить только в шприце (ампуле). У ингаляционных анестетиков концентрацию можно измерить в испарителе, на вдохе и выдохе пациента.
Внутривенные анестетики имеют и свои преимущества— они не требуют наличие дополнительной аппаратуры (например, газоанализатор). Кроме этого, пропофол не заменим при выполнении коротких хирургических манипуляций (перевязки, удаление дренажей и т.д.)
Подробнее о других препаратах в анестезиологии и реаниматологии читайте здесь…
Внутривенный анестетик Пропофол (диприван, diprivan, propofol)является наиболее часто используемым в настоящее время внутривенным анестетиком. Результатом работ начала 70-х гг.
прошлого столетия стала разработка 2,6-диизопропофола. Первое клиническое исследование, проведенное Kay и Rolly и опубликованное в 1977 г.
, подтвердило эффект пропофола как препарата для индукции в анестезию.
По причине анафилактоидных реакций, ассоциированных с кремофором в ранней химической формуле пропофола, препарат был преобразован в эмульсию.
Пропофол быстро начинает действовать и имеет дозозависимое окончание действия в течение 10 мин, если вводился в течение 3 ч, и менее чем за 40 мин, когда вводился в течение 8 ч.
Механизмом его действия, как полагают, является потенцирование действия γ-аминомасляной кислоты (ГАМК), что вызывает перемещение ионов хлора.
В терапевтических дозах пропофол умеренно угнетает дыхание. Он также вызывает дозозависимое снижение артериального давления, главным образом, за счет уменьшения сердечного выброса и системного сосудистого сопротивления.
Уникальным свойством пропофола является его противорвотное действие, которое проявляется в концентрациях, значительно меньше седативных. Индукционная доза, сопровождающаяся потерей сознания, составляет 1–2 мг/кг с поддерживающей скоростью инфузии 100–200 мкг/кг/мин.
Для продленной седации дозы от 25 до 75 мкг/кг/мин, как правило, достаточны. При скорости инфузии пропофола более 30 мкг/кг/мин, у пациентов развивается амнезия. По сравнению с мидазоламом, когда он используется в качестве основного препарата для седации, пропофол так же или лучше контролируем и обеспечивает более быстрое пробуждение.
Синдром инфузии пропофола является редким, но летальным осложнением, связанным с инфузией пропофола в дозе, равной или превышающей 4 мг/кг/ч в течение более 48 ч. Впервые он был описан у детей, но впоследствии наблюдался у тяжелобольных взрослых.
Клиническими признаками синдрома инфузии пропофола являются острая рефрактерная брадикардия, приводящая к асистолии, в присутствии одного или более из следующих признаков: метаболический ацидоз (дефицит оснований более 10 ммоль/л), острый рабдомиолиз, гиперлипидемия, увеличение печени или жировой гепатоз [Kam PC, Cardone D: Propofol infusion syndrome. Anaesthesia 62:690-701, 2007]. Другие признаки включают: кардиомиопатию с острой сердечной недостаточностью, скелетную миопатию, гиперкалиемию, увеличение печени и липемию [Kang TM: Propofol infusion syndrome in critically ill patients. Ann Pharmacother 36: 1453-1456, 2002]. Теории о причинах его развития включают митохондриальную токсичность, дефекты митохондрий, нарушение оксигенации тканей и дефицит углеводов. Основными факторами рискадля развитиясиндрома инфузии пропофола, вероятно, являются сниженная доставка кислорода к тканям, сепсис, тяжелое повреждение головного мозга и высокие дозы пропофола. В некоторых исследованиях было отмечено нарастание липемии, вероятно, связанное с нарушением печеночной регуляции вследствие сниженной оксигенации, низкого уровня глюкозы или сочетания этих факторов. В некоторых случаях рост липемии был первым признаком развития синдрома инфузии пропофола, в связи с чем она не должна рассматриваться как неопасный признак [Ahlen K, Buckley CJ, Goodale DB, Pulsford AH: The «propofol infusion syndrome»: The facts, their interpretation and implications for patient care. Eur J Anaesthesiol 23:990-998, 2006].
С целью седации пропофол рекомендован в интенсивной терапии. Однако существуют и альтернативы, например ингаляционная седация севофлураном или изофлураном с помощью устройства AnaConDa, подробнее читать здесь…
Внутривенный анестетик тиопентал был введен клиническую практику Waters и Lundy в 1934 г. и стал популярным из-за быстрого начала и короткой продолжительности действия, без возбуждающих эффектов.
Несмотря на критику препарата, как «идеальную форму эвтаназии в военно-полевой хирургии», барбитураты по-прежнему широко используются в клинической практике.
Тиопентал обеспечивает быстрое начало анестезии при болюсном использовании, но он быстро накапливается при длительном применении и ведет к замедленному восстановлению.
Барбитураты используют в виде натриевой соли на водной основе при щелочном рН. Так же как и пропофол, они оказывают гипнотический эффект в значительной степени путем воздействия на ГАМК-рецепторы. Барбитураты используются для вводного наркоза.
Для поддержания длительной анестезии применять тиопетал (как основного препарата) не рекомендуется.
Тиопентал вызывает умеренное дозозависимое снижение артериального давления (главным образом, в результате периферической вазодилатации) и респираторного драйва.
Барбитураты противопоказаныпациентам с порфирией.
Индукционная доза тиопентала составляет 4 мг/кг и вводится в течение 5–15 с. Существует меньшая вариабельность среди пациентов в ответ на дозу барбитуратов по сравнению с бензодиазепинами, для введения в наркоз, но значительная вариабельность дозировки тиопентала, требуемой для индукции в анестезию, все еще существует.
Внутривенный анестетик Кетамин (кеталар, калипсол) был синтезирован в 1962 г. Stevens и впервые был использован на людях в 1965 г. Corssen и Domino. Кетамин был выпущен для клинического использования в 1970 г. и до сих пор используется в различных клинических ситуациях.
Кетамин— производное фенциклидина, принципиально отличается от вышеперечисленных гипнотиков. Он вызывает диссоциативные состояния гипноза и аналгезии.
Кетамин отличается от большинства других препаратов, используемых для анестезии, наличием выраженного обезболивающего эффекта.
Кетамин не угнетает сердечно-сосудистую и дыхательную системы, но обладает неблагоприятными психологическими эффектами которые происходят во время восстановления сознания после анестезии кетамином и определяются как реакции пробуждения.
Общие признаки этих реакций, которые различаются по степени тяжести и проявлениям, включают яркие сновидения, ощущение выхода из телесной оболочки (чувство плавающего тела) и иллюзии (неправильная интерпретация реального, внешнего чувственного опыта).
Эти сновидения и иллюзии часто бывают связаны с волнением, спутанностью сознания, эйфорией и страхом.
Интерес к внутривенному анестетику кетамину увеличился в последнее время из-за его влияния на состояние гипералгезии и толерантности к опиатам, использования при хронических болевых синдромах, потенциального нейропротекторного действия.
Кетаминиспользуется для индукции и поддержания анестезии. Кетамин действует главным образом, через N-метил-D-аспартатные (NMDA-) рецепторы. Действие кетамина в высоких дозах связано с выраженными неблагоприятными психологическими последствиями и рядом других побочных эффектов.
На современном этапе он используется в первую очередь в качестве аналгетического компонента. Он имеет быстрое начало действия и относительно быстрое восстановление, даже после инфузии в течение нескольких часов. Он обладает симпатомиметическим эффектом, поддерживающим функцию сердца.
Кетамин оказывает минимальное влияние на дыхание и состояние вегетативной нервной системы. Индукционная доза кетамина составляет 2–4 мг/кг внутривенно. Инфузия кетамина обеспечивает аналгезию, и он может быть использован в сочетании с пропофолом для проведения тотальной внутривенной анестезии. Предоперационное введение кетамина в дозе 10–20 мг используется в качестве упреждающей аналгезии (0,15-0,25 мкг/кг в/в).
Источник: //anest-rean.ru/preparati/vnutrivennie-anestetiki/
Чурсин В.В. Внутривенная анестезия (методические рекомендации)
![]()
Интубация трахеи.
Показанием для использования именно Пропофола для индукции можно считать кратковременные операции или манипуляции, требующие интубации трахеи, например бронхоскопию. Рекофол показан для вводного наркоза больным с исходно высоким артериальным давлением, когда весь наркоз будет вестись с использованием этого гипнотика.
Если в качестве базисного гипнотика планируется применить другой препарат (диазепам, дормикум), то использование Пропофола не целесообразно даже с экономической точки зрения – есть другие не менее эффективные схемы индукции, например фентанил с диазепамом или дормикумом.
Не стоит использовать Пропофол у экстренно оперируемых больных, имеющих признаки гиповолемии – есть высокая вероятность значительного снижения артериального давления.
В зависимости от конкретной ситуации можно предложить несколько схем индукции.
1. Планируется кратковременная процедура, например бронхоскопия, длительностью 5-10 минут. Премедикация: атропин 0,3-0,5 мг, лучше подкожно (п/к), димедрол 10 мг внутривенно (в/в). Далее вводят калипсол в/в из расчёта 0,7 мг/кг (приблизительно 50 мг на 70 кг) и начинают болюсно, по 2-4 мл, вводить Рекофол из расчёта 1,5-2 мг/кг (приблизительно 100 мг на 70 кг) до утраты сознания и угнетения ресничного рефлекса. Затем вводят листенон, 1,5-2 мг/кг (приблизительно 100-150 мг на 70 кг). Вспомогательную вентиляцию маской начинают после утраты сознания, после наступления релаксации вентилируют 1 минуту кислородно-воздушной (40%) смесью и интубируют пациента. После интубации вводят ещё 20-40 мг (1-2 мл) Пропофола и начинают процедуру. Каждые 3-4 минуты вводят дополнительно по 20-30 мг Пропофола и, при необходимости, листенон по 50 мг.
После окончания процедуры больные просыпаются и могут быть экстубированы через 10-15 минут. Последействие препаратов сохраняется в течение 30-50 минут.
Применение малых доз калипсола объясняется необходимостью обеспечения анальгезии при интубации и выполнении процедуры.
Собственный опыт показывает, что отрицательные свойства калипсола (галлюцинации, головокружение, возбуждение при пробуждении) практически не проявляются.
2. Планируется полостная операция под общим обезболиванием.
Премедикация: атропин 0,3-0,5 мг, лучше п/к, димедрол 10 мг в/в, желательно промедол 10-20 мг в/в. Индукцию начинают не ранее чем через 10 минут – необходимо время для начала действия промедола.
Если промедол не используется, то перед началом введения Пропофола в/в вводят 0,1-0,2 мг фентанила или калипсол 50-100 мг.
В принципе, можно провести и моноиндукцию Пропофолом, но в сочетании с вышеперечисленными препаратами реже отмечается подъём АД во время интубации или сразу после неё, что более благоприятно для больных с сопутствующей патологией сердечно-сосудистой системы.
Обезболивание малых хирургических вмешательств с использованием Пропофола.
Примером таких операций может быть флебэктомия, аппендэктомия, аденомэктомия, ТУР, ортопедические, травматологические, косметологические, гинекологические операции.
При кратковременных или малотравматичных операциях обычно проводится в/в анестезия на спонтанном дыхании. Несмотря на кажущуюся простоту, эти наркозы сложны и опасны.
Анестезиолог не может отвлечься от больного ни на секунду – требуется контроль за дыханием, адекватность которого зависит от глубины наркоза, от положения головы и челюсти пациента.
Дозы вводимых препаратов должны не угнетать дыхание при достаточном обезболивании и обеспечить быстрое пробуждение.
Необходимо соблюдать все меры профилактики для предотвращения регургитации и аспирации, так как очень часто такие наркозы проводят по экстренным показаниям или в амбулаторных условиях. После приёма пищи должно пройти не менее двух часов, после приёма жидкости – один час.
Основное правило – опять же, слишком не углублять анестезию и седацию для сохранения гортанных рефлексов.
С особой ответственностью следует решать вопрос о возможности использования Пропофола в травматологии. Хотя нет литературных данных, но Пропофол, являясь жировой эмульсией, может спровоцировать или усугубить жировую эмболию. Не следует рисковать и использовать Рекофол при остеосинтезе в течение 5-7 дней после получения травмы.
Премедикация: димедрол 10 мг, атропин 0,2-0,5 мг, лучше п/к или медленно в/в. Для обеспечения анальгезии в течении нескольких часов после операции можно уже в премедикацию включить кетонал или ксефокам.
Желательно использовать промедол (10-20 мг) или стадол, обеспечивающие через 10-15 минут достаточную анальгезию.
Далее вводят калипсол в/в из расчёта 0,4 мг/кг (25 мг на 70 кг) и начинают болюсно, по 2-3 мл, вводить Рекофол до утраты сознания и угнетения ресничного рефлекса. Вводят ещё 25 мг калипсола.
Введение в наркоз при такой тактике может занимать до 10 минут, но зато мала вероятность угнетения дыхания. Начинают операцию. Дыхание обычно не угнетается.
Повторные дозы Пропофола – 1-2 мл вводят каждые 3-5 минут, калипсола (25 мг) – каждые 10 минут.
Для углубления анестезии можно использовать фентанил по 0,5-1,0 мл (0,025-0,05 мг) в промежутках между введением калипсола, т.е. каждые 5 минут вводят то калипсол, то фентанил. Можно в один шприц набрать 2 мл (100 мг) калипсола и 2 мл (0,1 мг) фентанила и вводить по 0,5 мл каждые 3-5 минут.
Двигательная активность обычно не свидетельствует о недостаточной анестезии, в этом плане лучше ориентироваться на гемодинамику. Для успокоения больного лучше ввести дополнительно Пропофол.
Наиболее частая ошибка в таких ситуациях – спешка, с которой начинают вводить всё подряд, стараясь обездвижить больного.
Необходимо помнить, что любой препарат действует не моментально, нужно 2-3 минуты, чтобы введённый калипсол, фентанил или Пропофол достигли точки приложения и успокоили больного. На это время можно попросить хирурга прекратить манипуляции.
Ввёденные же поспешно избыточные дозы угнетают спонтанное дыхание и гортанные рефлексы, создавая проблемы анестезиологу.
Рекофол можно вводить инфузоматом со скорость 4-8 мг/кг в час – это наиболее удобный способ введения. Часто используют и инфузию, разводя Рекофол 5% глюкозой.
При достаточном опыте длительность операций под таким обезболиванием может достигать 5-6 часов, например в косметологии.
В сознание больные приходят через 10-20 минут после последнего введения Рекофола, через час могут самостоятельно передвигаться. Малые дозы калипсола не вызывают выраженного последействия.
Но не следует злоупотреблять этим – пациенты должны оставаться под наблюдением медперсонала как минимум ещё 2-3 часа.
При использовании больших доз наркотиков время наблюдения пролонгируется как минимум до 12 часов.
Обезболивание объёмных хирургических операций с использованием Пропофола.
Рекофол с успехом можно применять при любых торакальных или абдоминальных операциях. С осторожностью следует использовать Пропофол у больных с гиповолемией и при большой кровопотере, т.к. он может значительно снизить артериальное давление.
Особые преимущества Пропофол будет иметь у больных с артериальной гипертензией, хронической сердечной или лёгочной патологией. Способствуя периферической вазодилятации, препарат уменьшает нагрузку на сердце.
Быстрое пробуждение уменьшает время аппаратного дыхания в послеоперационном периоде, что также благоприятно для этой категории больных.
Премедикация: димедрол 10 мг, атропин 0,2-0,5 мг, лучше п/к или медленно в/в. Если операция длится более двух часов, то атропин можно вводить повторно п/к для уменьшения саливации и снижения бронхиальной секреции. Для обеспечения анальгезии в течение нескольких часов после операции можно уже в премедикацию включить кетонал или ксефокам.
Желательно использовать промедол (10-20 мг), даже если основным анальгетиком будет фентанил. Это обеспечит более глубокую и ровную анальгезию.
Индукцию проводят по вышеприведённой схеме.
Поддержание анестезии фентанилом в дозе 6 – 10 мкг/кг/ в течение первого часа, 4 – 7 мкг/кг в последующие часы операции. При дополнительном использовании промедола 0,2 – 0,3 мг/кг/час или калипсола в дозе 2 – 3
мг/кг/час, дозы фентанила можно уменьшить на 15 – 20%.
Фентанил вводят с максимальным интервалом в 20 минут, оптимально каждые 10 – 15 минут. Разовая доза, в зависимости от веса пациента и, соответственно, расчётной дозы, от 1 до 4 мл. Например, пациенту весом 120 кг в течение второго часа операции фентанил необходимо вводить по 4 мл (0,2 мг) каждые 15 минут (7 мкг * 120 кг 800 мкг = 0,8 мг за час).
Седацию проводят введением Рекофола в дозе 6 – 12 мг/кг в час. В среднем уходит 2 ампулы (40 мл = 400 мг) препарата на час на обычного пациента (60 – 70 кг). Оптимальный способ введения – инфузомат. Болюсно – каждые 4 – 5 минут по 2 –4 мл (20 – 40 мг). Инфузия – через отдельную систему.
Дозу подбирают с учётом изменений гемодинамики. При подъёме АД и увеличении ЧСС увеличивают дозу до стабилизации показателей. Затем придерживаются этой скорости введения до окончания основного (болезненного) этапа операции. Потом дозу можно постепенно снижать.
Признаками передозировки является гипотония и брадикардия.
При неэффективности повышения дозировки Рекофола нет смысла дополнительно вводить другие седатики – диазепамы, дормикум, ГОМК.
Можно попробовать углубить обезболивание – ввести дополнительные дозы фентанила или калипсола. Если и это не помогает, необходимо искать другую причину повышения АД или тахикардии. Чаще всего это неадекватная ИВЛ.
Вне зависимости от длительности операции, при стабильном течении анестезии, больные просыпаются в течение 30-40 минут после окончания введения Пропофола. После декураризации их можно экстубировать сразу после пробуждения. Сонливость менее выражена, чем при использовании диазепамов.
При дефиците Пропофола можно использовать смешанную схему обеспечения седации. Индукцию и первую половину операции проводят с использованием диазепамов или дормикума, а затем переходят на Пропофол.
Рекофол начинают вводить через 30-40 минут после последнего введения диазепамов. Оптимальный эффект получают когда Пропофол начинают использовать за час-полтора до окончания операции. За это время прекращается действие введённых в начале операции диазепамов или дормикума.
Источник: //diseases.medelement.com/material/%D1%87%D1%83%D1%80%D1%81%D0%B8%D0%BD-%D0%B2-%D0%B2-%D0%B2%D0%BD%D1%83%D1%82%D1%80%D0%B8%D0%B2%D0%B5%D0%BD%D0%BD%D0%B0%D1%8F-%D0%B0%D0%BD%D0%B5%D1%81%D1%82%D0%B5%D0%B7%D0%B8%D1%8F-%D0%BC%D0%B5%D1%82%D0%BE%D0%B4%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5-%D1%80%D0%B5%D0%BA%D0%BE%D0%BC%D0%B5%D0%BD%D0%B4%D0%B0%D1%86%D0%B8%D0%B8/68851383298421
Тотальная внутривенная анестезия: принципы проведения, виды
![]()
Страх боли – один из самых древних и пугающих. Боль может лишить сознания, рассудка и привести к летальному исходу от болевого шока. Вопрос обезболивания перед человечеством встал в тот самый момент, когда начали проводиться различные манипуляции с телом, кожей, органами.
И если много лет назад анестезия была “дворовая” (отвлекали, позволяли кричать, давали убойную дозу алкоголя), то в наше время медицина шагнула вперед настолько, что методов обезболивания великое множество и с каждым новым открытием переносить новый метод анестезии все легче, а побочных эффектов у него все меньше.
Виды анестезии
Для лучшего понимания рассмотрим основные методы анестезии.
1) Местная анестезия.
Из названия понятно, что зона ее действия определяется локально. Человек остается в сознании, и побочных эффектов и нежелательных последствий у такого вида обезболивания немного. Чаще всего используется:
- Поверхностная (аппликационная) – используется в медицине (стоматология, оториноларингология, косметология, гинекология), когда нужно обезболить небольшой участок кожного покрова. Теряется чувствительность участка, пациент ощущает онемение. Анестетик может быть в виде геля, аэрозоля, спрея или раствора.
- Инфильтрационная – введение препарата, блокирующего нервные импульсы, производится подкожно, инъекционно.
- Проводниковая – препарат вводится в параневральное пространство, что вызывает блокаду импульсов по крупному нервному стволу. Это уже более серьезный вид местной анестезии, он используется при операциях на конечностях, щитовидной железе и проч.
- Спинальная – введение анестетика происходит в спинномозговую жидкость при помощи тонкой иглы. Теряется чувствительность нижнего сегмента живота и конечностей. Используется при проведении операций в поясничном отделе позвоночника, на ногах и др.
- Эпидуральная – анестезия, широко используемая при родах и кесаревом сечении. Отличие от спинальной – введение происходит при помощи катетера в эпидуральное пространство, и блокировка импульсов идет не на уровне корешков спинномозговых нервов, а блокируются полностью нервные окончания спинного мозга.
2) Общая анестезия.
При проведении общей анестезии полностью угнетается работа центральной нервной системы, человек находится без сознания, скелетные мышцы расслаблены, болевая чувствительность отсутствует.
Общая анестезия требует тщательного подбора препаратов врачом-анестезиологом, восстановление после нее труднее, зачастую требуется аппарат искусственной вентиляции легких для восстановления дыхания после общего наркоза. Виды общей анестезии:
- ингаляционная – анестетики вводятся через дыхательные пути, используются масочные, эндотрахеальные, эндобронхиальные аппараты;
- неингаляционная – введение происходит внутривенно, внутримышечно (зависит от количества вводимых препаратов и их комбинаций – мононаркоз, смешанный наркоз, комбинированный наркоз).
Для безопасности пациента и глобального обезболивания иногда применяют сочетание ингаляционного обезболивания и неингаляционного.
Рассмотрим подробнее один из наиболее распространенных видов неингаляционной анестезии – тотальная внутривенная анестезия, что это, как проводится и т. д.
Альтернатива ингаляционной анестезии
Сокращенно ТВВА – это вид общей анестезии, который используется для проведения операций, во время которых не требуется мышечное расслабление.
Особенностью данного метода является сочетание нескольких препаратов в меньших дозах, чем если бы каждый из них нужен был по отдельности. Таким образом, уменьшается негативное побочное воздействие на организм от каждого препарата.
Анестетики при ТВВА дополняются транквилизаторами, нейролептиками, гипнотиками, анальгетиками, в результате комбинация нескольких препаратов усиливает действие анестезии.
Остановить свое внимание именно на тотальной внутривенной анестезии приходится, потому что именно в России пока не может получить широкого распространения ингаляционный вид обезболивания. Причина – недостаток современных анестетиков и низкопоточных наркозных препаратов. Внутривенное введение анестезирующих препаратов помогает облегчить вывод из состояния наркоза, регулировать дозировку.
Преимущества метода
- Осуществить такой анестезию просто технически.
- Надежность, вводить анестетик внутривенно можно дозами дробно.
- Введение в состояние сна происходит быстро, почти мгновенно.
- Физиологичный сон.
- Благодаря совместному действию с транквилизаторами у пациента отсутствует фаза возбуждения (нет страхов и тревожности).
- Индивидуальный подход к каждому пациенту – можно рассчитать эффективную химическую структуру анестетика в каждом отдельном случае.
Книги о ТВВА
Книга “Тотальная внутривенная анестезия” Смита является хорошим качественным настольным пособием для анестезиологов. До момента появления русскоязычного издания подобных этой книг в российской медицине не было.
В своей книге Смит в соавторстве с Уайтом подробно и грамотно разобрал следующие темы:
- тотальная внутривенная анестезия – понятие, техника проведения, ее научные основы;
- история происхождения внутривенной анестезии;
- методики ТВВА;
- фармацевтический разбор препаратов, используемых при этом виде анестезии;
- преимущества и недостатки ТВВА;
- проведение и влияние ТВВА для отдельных групп больных;
- мониторирование действия анестетиков во время проведения анестезии;
- какое будущее ожидает внутривенную анестезию.
Подготовка к ТВВА
Тотальная внутривенная анестезия является одним из несложных видов наркоза, и подготовка к ней тоже достаточно примитивная. Требуется осмотр анестезиолога, опорожнение кишечника (или клизма).
Лучше перед наркозом (или накануне) не принимать пищу, чтобы не возник рвотный рефлекс.
Если требуется – проводится медикаментозная подготовка, пациенту даются или вводятся препараты, стабилизирующие психоэмоциональное состояние.
Подбор анестезирующего вещества, вспомогательных препаратов и их дозировки подбираются персонально и индивидуально анестезиологом. Расчет проводится всегда для каждого конкретного случая.
Техника проведения
При тотальной внутривенной анестезии используются два основных типа препаратов: гипнотик и анальгетик, поэтому существует несколько стратегий инфузии.
Для большинства операций техника такова: скорость инфузии гипнотика не меняется на протяжении операции, а анальгетика изменяют в зависимости от интенсивности хирургического вмешательства (также учитывается реакция больного).
Бывает, что действуют и наоборот: скорость инфузии анальгетика поддерживают на постоянном уровне, введение гипнотика изменяют.
У первого способа есть преимущество в виде быстрого пробуждения больного по окончании операции. Поэтому такая техника используется чаще, однако следует учитывать фармакокинетику препаратов и исходить из особенностей операции и состояния пациента.
Меры предосторожности
Как бы просто ни казалось применение внутривенной анестезии, относиться к выбору анестезиолога, подбору препаратов нужно максимально внимательно. К сожалению, не всегда все бывает просто.
Квалификация персонала, постоянное наблюдение за больным после окончания операции, правильно высчитанные дозировки, контроль систем гомеостаза помогут выйти из наркоза легко и без негативных последствий и воспоминаний.
Источник: //FB.ru/article/451944/totalnaya-vnutrivennaya-anesteziya-printsipyi-provedeniya-vidyi
|
К-Медицина на проспекте Мира
пр-т Мира, д. 105, стр. 1 |
пр-т Мира, д. 105, стр. 1 | ||||||
|
|||||||
|
Скандинавский Центр Здоровья на 2-й Кабельной
ул. 2-я Кабельная, д. 2, стр. 25, стр. 26, стр. 37 |
ул. 2-я Кабельная, д. 2, стр. 25, стр. 26, стр. 37 | ||||||
|
|||||||
|
Московский Доктор на Коктебельской
ул. Коктебельская, д. 2, корп. 1 |
ул. Коктебельская, д. 2, корп. 1 | ||||||
|
|||||||
|
Бест Клиник на Новочерёмушкинской
ул. Новочерёмушкинская, д. 34, корп. 2 |
ул. Новочерёмушкинская, д. 34, корп. 2 | ||||||
|
|||||||
|
МедЦентрСервис в Коньково
ул. Миклухо-Маклая, д. 43 |
ул. Миклухо-Маклая, д. 43 | ||||||
|
|||||||
|
МедЦентрСервис в Лефортово
ул. Авиамоторная, д. 41Б |
ул. Авиамоторная, д. 41Б | ||||||
|
|||||||
|
МедЦентрСервис в Солнцево
ул. Главмосстроя, д. 7 |
ул. Главмосстроя, д. 7 | ||||||
|
|||||||
|
МедЦентрСервис на Черняховского
ул. Черняховского, д. 8 |
ул. Черняховского, д. 8 | ||||||
|
|||||||
|
МедЦентрСервис в Марьино
ул. Новомарьинская, д. 32 |
ул. Новомарьинская, д. 32 | ||||||
|
|||||||
|
МедЦентрСервис на Ленинградском проспекте
Ленинградский пр-т, д. 67, корп. 1 |
Ленинградский пр-т, д. 67, корп. 1 | ||||||
|
|||||||
|
МедЦентрСервис в Отрадном
ул. Пестеля, д. 11 |
ул. Пестеля, д. 11 | ||||||
|
|||||||
|
МедЦентрСервис на ул. 1905 года
ул. 1905 года, д. 21 |
ул. 1905 года, д. 21 | ||||||
|
|||||||
|
Бест Клиник в Спартаковском переулке
Спартаковский пер., д. 2, стр. 11 |
Спартаковский пер., д. 2, стр. 11 | ||||||
|
|||||||
|
Бест Клиник на Ленинградском шоссе
Ленинградское шоссе, д. 116 |
Ленинградское шоссе, д. 116 | ||||||
|
|||||||
|
МедикСити на Полтавской
ул. Полтавская, д. 2 |
ул. Полтавская, д. 2 | ||||||
|
|||||||
|
Клиника Семейная на Героев Панфиловцев
ул. Героев Панфиловцев, д. 1 |
ул. Героев Панфиловцев, д. 1 | ||||||
показать еще 1 цену |
|||||||
|
Клиника Семейная на Хорошевском шоссе
Хорошевское шоссе, д. 80 |
Хорошевское шоссе, д. 80 | ||||||
показать еще 1 цену |
|||||||
|
Клиника Семейная на Каширском шоссе
Каширское шоссе, д. 56, корп. 1 |
Каширское шоссе, д. 56, корп. 1 | ||||||
показать еще 1 цену |
|||||||
|
Клиника Семейная на Университетском проспекте
Университетский пр-т, д. 4 |
Университетский пр-т, д. 4 | ||||||
показать еще 1 цену |
|||||||
|
Клиника Семейная на Сергия Радонежского
ул. Сергия Радонежского, д. 5/2, стр. 1 |
ул. Сергия Радонежского, д. 5/2, стр. 1 | ||||||
показать еще 1 цену |
|||||||
|
Клиника Семейная на Фестивальной
ул. Фестивальная, д. 4 |
ул. Фестивальная, д. 4 | ||||||
показать еще 1 цену |
|||||||
|
Клиника Семейная на Первомайской
ул. Первомайская, д. 42 |
ул. Первомайская, д. 42 | ||||||
показать еще 1 цену |
|||||||
|
Клиника Семейная на Ярославском шоссе
Ярославское шоссе, д. 69 |
Ярославское шоссе, д. 69 | ||||||
показать еще 1 цену |
|||||||
|
Клиника Семейная на Большой Серпуховской
ул. Большая Серпуховская, д. 30 |
ул. Большая Серпуховская, д. 30 | ||||||
показать еще 1 цену |
|||||||
|
Клиника Семейная на Госпитальной площади
Госпитальная пл., д. 2, стр. 1 |
Госпитальная пл., д. 2, стр. 1 | ||||||
показать еще 1 цену |
|||||||
|
МедЦентрСервис в Медведково
ул. Полярная, д. 32 |
ул. Полярная, д. 32 | ||||||
|
|||||||
|
Дельта Клиник в Наставническом переулке
Наставнический пер., д. 6 |
Наставнический пер., д. 6 | ||||||
|
|||||||
|
Дельта Клиник в Сыромятническом переулке
2-й Сыромятнический пер., д. 10 |
2-й Сыромятнический пер., д. 10 | ||||||
|
|||||||
|
Лечебный Центр на Тимура Фрунзе
ул. Тимура Фрунзе, д. 15/1 |
ул. Тимура Фрунзе, д. 15/1 | ||||||
показать еще 1 цену |
|||||||
|
МедЦентрСервис на Земляном Валу
ул. Земляной Вал, д. 38/40, стр. 6 |
ул. Земляной Вал, д. 38/40, стр. 6 | ||||||
|
|||||||
Общая внутривенная анестезия (TIVA)
 Общая внутривенная анестезия (TIVA) может быть определена как методика общей анестезии с использованием комбинации агентов, вводимых исключительно внутривенно, и в отсутствие всех ингаляционных агентов, включая закись азота. Внутривенный путь использовался для введения лекарств в течение сотен лет, а обеспечение анестезии исключительно внутривенным путем с использованием хлоралгидрата было зарегистрировано еще в 1870-х годах. Тиопентон был внедрен в клиническую практику в 1934 году и сделал популярным внутривенное введение анестезии.Пропофол был введен в клиническую практику в 1986 году и теперь, похоже, берет на себя эту роль. Он также стал широко использоваться как компонент TIVA.
Общая внутривенная анестезия (TIVA) может быть определена как методика общей анестезии с использованием комбинации агентов, вводимых исключительно внутривенно, и в отсутствие всех ингаляционных агентов, включая закись азота. Внутривенный путь использовался для введения лекарств в течение сотен лет, а обеспечение анестезии исключительно внутривенным путем с использованием хлоралгидрата было зарегистрировано еще в 1870-х годах. Тиопентон был внедрен в клиническую практику в 1934 году и сделал популярным внутривенное введение анестезии.Пропофол был введен в клиническую практику в 1986 году и теперь, похоже, берет на себя эту роль. Он также стал широко использоваться как компонент TIVA.
TIVA стала популярной, практичной и возможной только в относительно недавнее время. Для этого есть две основные причины. Во-первых, в отличие от других популярных внутривенных средств в прошлом, фармакокинетические и фармакодинамические свойства современных лекарств, таких как пропофол и новые синтетические опиоиды короткого действия, делают их очень подходящими для введения путем непрерывной инфузии.Во-вторых, новые концепции в фармакокинетическом моделировании и достижения в области компьютерных технологий позволили разработать сложные системы доставки, которые делают контроль анестезии, вводимой внутривенным путем, таким же простым и удобным для пользователя, как и обычные ингаляционные методы.
Внутривенное введение лекарств для обеспечения анестезии превратилось в популярную альтернативу ингаляционной анестезии. Этот эволюционный процесс является результатом улучшенного понимания фармакокинетики, фармакодинамики и взаимодействий, которые имеют место во время непрерывного приема лекарств.Понимание этих процессов облегчило разработку компьютеризированных драйверов шприцев, которые позволяют оптимизировать выбор и комбинации лекарств. Новые системы внутривенной доставки лекарств позволяют анестезиологам изменять глубину анестезии в ответ на клинические признаки интуитивно аналогично обычным летучим системам; тем самым упрощая введение внутривенной анестезии. Результатом является простая в использовании современная система обеспечения анестезии, которая позволяет быстро, точно и независимо контролировать амнезию, гипноз и анальгезию.
Фармакокинетика и TIVA
Фармакокинетика — потенциально сложный предмет, но понимание основных концепций, связанных с анестетиками, может помочь прояснить клинические последствия использования конкретного лекарства для TIVA и, таким образом, помочь в выборе оптимального лекарственного средства и комбинации.
 Фармакокинетика — это просто использование математики для описания того, как организм «обрабатывает» определенные лекарства. Данные могут быть собраны путем проведения анализов определенных лекарств в плазме после введения (однократной дозой или инфузией), чтобы изучить, как концентрация в плазме изменяется со временем.Существует математическая зависимость между введенной дозой лекарства и наблюдаемыми в результате изменениями концентрации в плазме. Это соотношение позволяет построить математические фармакокинетические модели, которые затем можно использовать для облегчения расчета режимов дозирования и для руководства фармакотерапевтическим лечением.
Фармакокинетика — это просто использование математики для описания того, как организм «обрабатывает» определенные лекарства. Данные могут быть собраны путем проведения анализов определенных лекарств в плазме после введения (однократной дозой или инфузией), чтобы изучить, как концентрация в плазме изменяется со временем.Существует математическая зависимость между введенной дозой лекарства и наблюдаемыми в результате изменениями концентрации в плазме. Это соотношение позволяет построить математические фармакокинетические модели, которые затем можно использовать для облегчения расчета режимов дозирования и для руководства фармакотерапевтическим лечением.
Система внутривенной доставки лекарств, используемая во время TIVA, должна способствовать достижению следующих целей: плавная индукция, надежное и титруемое поддержание и быстрое появление.Кроме того, логичной была бы система, использующая навыки, которые анестезиолог уже освоил при применении ингаляционных анестетиков. Устройства для контролируемой инфузии (TCI) были разработаны для удовлетворения этих требований.
Преимущества целевой контролируемой инфузии (TCI)
Ряд производителей инфузионных устройств представили «открытые» системы TCI для пропофола, ремифентанила и суфентанила. Эти новые устройства имеют маркировку CE. Если компания считает, что ее устройство соответствует так называемым «основным требованиям» производительности и безопасности, и если у нее есть утвержденная система качества, им не нужно отправлять свое устройство на внешнюю оценку в установленный законом орган.Правила в отношении медицинских устройств не требуют какого-либо сотрудничества между производителями устройств и лекарств, и можно утверждать, что это необходимо для обеспечения того, чтобы устройство содержало соответствующую фармакокинетическую модель. С ноября 2004 года в Великобритании единственным лекарством, разрешенным к применению TCI, является пропофол от Diprifusor TCI systems. Использование «открытых» систем TCI можно рассматривать как введение лекарств «не по назначению», хотя, если скорости доставки лекарств, достигаемые в режиме TCI, находятся в пределах тех, которые рекомендуются существующей маркировкой для (ручного) болюсного и инфузионного дозирования, можно утверждать, что доставка осуществляется в соответствии с предписывающей информацией.Компьютеризированные системы доставки
Внутривенное поддержание анестезии после индукции может быть достигнуто с помощью простых повторных доз. Это имеет недостаток в виде пиков и спадов концентрации лекарственного средства, которые могут привести, с одной стороны, к нежелательным токсическим эффектам, а с другой — к недостаточной дозировке. Следующим логическим шагом будет вводить лекарство путем непрерывной инфузии, но недостатком этого метода является задержка до достижения максимального эффекта, который эквивалентен четырем или пяти периодам полувыведения лекарства.Если ударная доза вводится в начале фиксированной скорости инфузии, то начальный пиковый эффект достигается быстрее, но при переходе от ударной дозы к поддерживающей происходит снижение концентрации из-за перераспределения лекарства. Это снова создает риск недостаточной дозировки. Чтобы избежать этой проблемы, поддерживающая схема должна учитывать снижение концентрации препарата. В ходе процедуры изменения глубины анестезии часто должны быть быстрыми, чтобы реагировать на вариации степени хирургической стимуляции.Хотя изменение скорости ручной инфузии вызовет предсказуемые изменения концентрации в крови, задержка в достижении новой более высокой концентрации обычно неприемлема. Для более быстрого увеличения концентрации в крови приращение болюса с последующим изменением скорости инфузии будет иметь более быстрое время начала, но вычисления, необходимые для выбора правильного болюса и новой скорости инфузии, довольно сложны. Их определенно было бы непрактично выполнять индивидуальным анестезиологом во время анестезии.Снижение дозы тоже имеет свои опасности; прекращение ручной инфузии может привести к непреднамеренному повторному включению.
 Одним из ответов на все эти проблемы является компьютерное инфузионное устройство, запрограммированное с определенными фармакокинетическими параметрами пропофола и используемое для достижения заданной целевой концентрации лекарственного средства в плазме. Множественные сложные вычисления, несомненно, являются прерогативой микропроцессора, который может сделать этот процесс проведения анестезии с помощью TCI аналогичным процессу управления летучей анестезией.Целевой уровень выбирается анестезиологом на инфузионном устройстве для индукции и впоследствии корректируется в ответ на клинические признаки для поддержания адекватной глубины анестезии. Нет необходимости вводить болюсную индукционную дозу, поскольку она включается в расчеты аппарата, когда анестезиолог сначала устанавливает начальную концентрацию в плазме. Глубину анестезии можно быстро изменить в ходе операции, просто выбрав новую целевую концентрацию в крови, концептуально аналогично настройке испарителя во время ингаляционной анестезии.Микропроцессор выполняет все необходимые вычисления приращения болюса или изменений скорости инфузии, которые требуются для достижения, поддержания и изменения концентрации в крови до любого целевого уровня, запрограммированного анестезиологом.
Одним из ответов на все эти проблемы является компьютерное инфузионное устройство, запрограммированное с определенными фармакокинетическими параметрами пропофола и используемое для достижения заданной целевой концентрации лекарственного средства в плазме. Множественные сложные вычисления, несомненно, являются прерогативой микропроцессора, который может сделать этот процесс проведения анестезии с помощью TCI аналогичным процессу управления летучей анестезией.Целевой уровень выбирается анестезиологом на инфузионном устройстве для индукции и впоследствии корректируется в ответ на клинические признаки для поддержания адекватной глубины анестезии. Нет необходимости вводить болюсную индукционную дозу, поскольку она включается в расчеты аппарата, когда анестезиолог сначала устанавливает начальную концентрацию в плазме. Глубину анестезии можно быстро изменить в ходе операции, просто выбрав новую целевую концентрацию в крови, концептуально аналогично настройке испарителя во время ингаляционной анестезии.Микропроцессор выполняет все необходимые вычисления приращения болюса или изменений скорости инфузии, которые требуются для достижения, поддержания и изменения концентрации в крови до любого целевого уровня, запрограммированного анестезиологом.
Разработка устройств для контролируемой инфузии
Преимущества TCI были признаны в течение некоторого времени, и системы с компьютерным управлением были описаны в литературе в конце 1980-х годов. Однако отсутствие коммерческой доступности препятствовало широкому использованию этих систем TCI.В случае пропофола различные прототипы TCI были разработаны на протяжении многих лет с использованием различных наборов фармакокинетических параметров.
Доступность сильнодействующих снотворных и анальгетиков короткого действия и современные системы TCI делают процесс введения TIVA в настоящее время практичной и простой альтернативой традиционной ингаляционной анестезии. В то же время улучшенное понимание кинетики, динамики и взаимодействий лекарств облегчило выбор оптимального лекарственного средства и метода введения, которые можно легко адаптировать к клиническим требованиям.Теперь возможно быстрое и точное титрование анестетиков для обеспечения плавного начала и короткого предсказуемого замещения лекарств. Это может быть выгодно в контексте экономичного медицинского обслуживания, стремящегося к сокращению продолжительности пребывания в стационаре и увеличению числа пациентов, проходящих лечение в дневном стационаре.
Растущая популярность TIVA является свидетельством простоты ее использования и очевидных преимуществ, а для современного анестезиолога она представляет собой новое направление в этой специальности с большими преимуществами.
Источники:
http: // www.sivauk.org/welcome.php
http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1390758
http://www.nature.com/npp/journal/v29/n3/full/1300364a. html
http://www.rila.co.uk/issues/full/download/51c2200970f1a38a5988b71b12d9f52f407682.pdf
http://bja.oxfordjournals.org/cgi/reprint/86/4/523.pdf
Джон Сэндхэм IEng MIET MIHEEM
.Анестезиологическое обеспечение при полной замене тазобедренного сустава
1. Введение
Перелом бедра — важная медицинская проблема, которая встречается у пожилых пациентов и чаще встречается в связи с увеличением продолжительности жизни, что приводит к увеличению экономического бремени. Наблюдается значительный рост переломов шейки бедра из-за увеличения заболеваемости возрастным остеопорозом, а снижение баланса приводит к падению. Переломы чаще встречаются у женщин, так как у женщин часто встречается остеопороз.Около 15–30% пациентов с переломом шейки бедра умирают через год. Помимо остеопороза, переломы бедра из-за метастазов в кости слишком высоки, чтобы ими можно было пренебречь. Текущее лечение заключается в том, чтобы как можно скорее обеспечить пациенту весовую нагрузку. Гемиартропластика и фиксация тазобедренных ногтей — первые методы хирургического лечения [1].
Наиболее частые проблемы, с которыми сталкиваются в клинической практике, следующие:
Растяжение надкостницы
Интрамедуллярная гипоксия
Инфильтрация и компрессия в нервных корешках
Рефлексный мышечный спазм
- 000 9000 образование
Прямая инвазия и разрушение кости
Боль из-за активации болевых рецепторов цитокинами (простагландинами и др.)), выделяемый остеокластами из-за разрушения кости
Ограничение движений из-за боли
Подавление костного мозга из-за давления спинного мозга и инфильтрации костного мозга
Нехирургическое лечение доступно только пациентам с плохим состоянием общие условия, которые слишком низки, чтобы переносить любой из методов анестезии. Лечение перелома бедра требует выбора метода лечения, который должен быть индивидуализирован на самом высоком уровне.Выбор лечения должен зависеть от хирурга, типа перелома, возраста пациента и состояния здоровья. Среди пожилых пациентов переломы шейки бедра из-за падения являются одной из первых причин смерти. Важным фактором, определяющим летальность при этих операциях, является пожилой возраст; 30% этих случаев относятся к возрасту старше 85 лет.
Осложнения при операциях по поводу перелома бедра:
2. Костный цемент
Костный цемент — это химическое вещество, состоящее из полимеров метилметакрилата, которое плотно прилегает к кости пациента, заполняя прорези губчатой кости.Экзотермическая реакция, за которой следует укладка цемента, вызывает затвердевание и расширение цемента. В результате в костномозговой ткани наблюдается давление выше 500 мм рт. Ст. Это давление вызывает жировую, костномозговую и воздушную эмболию глубоких бедренных вен. Кроме того, остаточные мономеры метилметакрилата вызывают расширение сосудов и снижают системное сопротивление сосудов. Высвобождение тканевого тромбопластина запускает агрегацию тромбоцитов, что приводит к образованию микротромбов в легких и нестабильности сердечно-сосудистой системы из-за циркулирующих вазоактивных веществ [2].
Клинические признаки осложнения, связанного с костным цементом, следующие:
Гипоксия (усиление легочного шунта).
Гипотония.
Аритмия (включая блокаду сердца и остановку синуса).
Легочная гипертензия (повышенное сопротивление легочных сосудов).
Пониженный сердечный выброс.
Эмболия чаще всего возникает при установке бедренного протеза.
Методы уменьшения осложнений, связанных с цементом:
Повышение концентрации кислорода на вдохе перед цементированием
Тщательный мониторинг жидкостного баланса пациента
Открытие отверстия в дистальной области бедренной кости ( вентиляционное отверстие)
Очистка диафиза бедренной кости промыванием под высоким давлением для удаления мусора
Использование протеза без цемента
3.Кровотечение
Хирургия бедра — это операция, приводящая к значительной кровопотере. Средняя потеря крови составляет около 1000–1500 мл. Причина кровотечения зависит от нескольких факторов. Это следующие факторы:
Опыт хирурга.
Хирургическая техника и тип протеза.
Контролируемая гипотензия может уменьшить интраоперационное кровотечение.
Некоторые исследования показали, что потеря крови при региональных методах (спинальных и эпидуральных), обеспечивающих одинаковое среднее кровяное давление, была на 30–50% меньше, чем при общей анестезии [3, 4].
Для контроля кровотечения могут применяться предоперационная эмболизация, аутологичные и аллогенные трансфузии и методы гемодилюции. Апротинин, эпсилонаминокапроновая кислота и транексамовая кислота предотвращают кровопотерю без увеличения риска тромбообразования [5].
4. Венозная тромбоэмболия
Факторы, повышающие риск тромбоэмболии, следующие:
Предыдущий анамнез тромбоэмболии
Предыдущий анамнез венозной хирургии и / или варикозной хирургии
0
- 2
Пожилой возраст
Злокачественные новообразования
Застойная сердечная недостаточность
Хронический разрыв нижней конечности
Иммобилизация
Ожирение
Транскрипция
Транскрипция крови
Региональная анестезия снижает частоту тромбообразования и тромбоэмболии легочной артерии [6].Davis et al. обнаружили, что тромбоз глубоких вен составлял 13% при спинальной анестезии и 27% при общей анестезии [7]. Другие подходы, снижающие риск тромбоэмболии, — это использование устройств, обеспечивающих периодическое сжатие ног и профилактику низкими дозами антикоагулянтов.
Легочная артерия и ее ветви закупорены венозным тромбом из системных вен. Существует тесная связь между тромбоэмболией легочной артерии (ТЭЛА) и тромбозом глубоких вен (ТГВ).
DTV отвечает за 90% PE.В 1856 году Вирхов описал клиническую триаду причин венозной тромбоэмболии:
Клиническое влияние ПЭ зависит от нескольких факторов:
Ширина ложа закупоренных сосудов
Гуморальные факторы, выделяемые серотонином и тромбоксаном A2
- 2
- Имеются ли у пациента сердечно-легочные нарушения или нет
Возраст пациента и общее состояние здоровья
4.1. Диагноз
Рентген грудной клетки
ЭКГ
Анализ газов артериальной крови:
Основные результаты включают гипоксемию, гипокапнию, респираторный алкалоз и повышение альвеолярно-артериального градиента (PO6 902a25 2 9022) .
Биохимические исследования: В то время как CPK-MB, D-димер, FDP, SGOT в норме, LDH и билирубин высокие.
Тесты респираторной функции:
Увеличиваются физиологическое мертвое пространство (VD) и дыхательный объем (VD / VT).
4.2. Обработка
Вентиляция 100% O 2 .
Гепаринизация.
Инотропные агенты.
Хирургическая эмболэктомия выполняется при большом эмболе.Маленький эмбол подвергается антикоагуляции. Лучшее лечение — это профилактика.
Следует избегать венозного застоя. Для этого следует приподнять ноги и обеспечить раннюю мобилизацию в послеоперационном периоде. Расширенный венозный застой вызывает тромбоз глубоких вен и тромбоэмболию легочной артерии.
5. Венозная воздушная эмболия
Низкое венозное давление и открытая вентиляция необходимы для поступления воздуха в венозную систему по сравнению с атмосферным давлением.
Чаще всего возникает при нейрохирургических операциях в сидячем положении.
Кроме того, неправильная хирургическая техника может усилить образование воздушной эмболии.
Факторы, влияющие на воздушную эмболизацию, следующие:
Медленное проникновение в небольшой пузырь воздуха обычно имеет минимальное физиологическое значение. В этом случае пузырьки венозного воздуха удаляются из легких на основе повышенного компенсаторного давления в легочной артерии (ДЛА). Если эта ситуация превышает возможности удаления легких, ДЛА увеличивается, сердечный выброс (СО) снижается и возникает сердечная недостаточность.Если сбалансировано, а именно, если венозный ввод воздуха равен легочному удалению, PAP выходит на плато.
Воздух объемом 300 мл для взрослых смертелен. В испытаниях на животных 1 мл / кг / мин вызывает признаки эмболии; 3–8 мл / кг вызывает смерть. Самый ранний признак — сердечно-сосудистый коллапс. Артериальное давление резко снижается; Внезапная гипотензия, тахикардия, аритмия и остановка сердца возникают последовательно. ЦВД увеличивается; металлический звук слышен с помощью прекардиального или пищеводного стетоскопа. При этом слышен характерный «звук мельничного колеса».Этот звук можно услышать во всем прекардиуме. Могут наблюдаться респираторные изменения, такие как учащение дыхания, нерегулярность и апноэ.
5.1. Диагностика
Допплеровский ультразвуковой расходомер
PAP
CO в конце выдоха 2
Другие методы. У этих пациентов следует применять непрерывное измерение артериального давления, ЦВД, CO 2 в конце выдоха, ультразвуковую допплерографию и стетоскоп пищевода.
6. Жировая эмболия
6.1. Этиология
Переломы костей
Разрывы печени и почек
Редко, после костной хирургии
6.2. Диагноз
При наличии свободного жира в мокроте и моче и при гистологическом исследовании диагностируются петехии и гиперлипидемия, при этом максимальный уровень свободного жира достигается через 3–4 дня [8].
6.3. Лечение
Необходимо лечить гиповолемию и шок.Клофибрат (атромид-S) и алкоголь следует применять при гиперлипидемии.
6.4. Оценка перед анестезией при артропластике
Личные данные.
Физический осмотр:
Оцениваются возраст пациента, вес, индекс массы тела и жизненно важные признаки (артериальное давление, частота пульса, частота пульса, температура тела, количество вдохов (глубина дыхания)) пациента. .
У этих пациентов основной этиологией в основном является остеоартрит или ревматоидный артрит.Поэтому осмотр шейных и поясничных позвонков особенно важен для анестезии.
Подвижность шейного отдела позвоночника должна быть проверена для оценки любых ограничений и оценена на предмет трудности интубации. Также, под наркозом и во время интубации следует избегать попыток чрезмерного разгибания шейного сустава.
Остеоартрит может привести к компрессии нервных корешков в позвоночнике. У пациентов с ревматоидным артритом могут поражаться шейный отдел позвоночника и височно-нижнечелюстной сустав.При наличии подвывиха атлантоаксиального сустава диагноз можно поставить рентгенологически. Во время интубации подвывих атлантоаксиального сустава может вызвать выпячивание большого затылочного отверстия в зубовидный отросток, снижение вертебрального кровотока и сдавливание спинного или головного мозга. Интубацию необходимо проводить путем стабилизации шеи. Некоторым пациентам может быть предпочтительнее использовать технику бдительной интубации. Этой группе пациентов может быть проще предпочесть региональную анестезию [9].
Из-за множественных поражений суставов при ревматоидном артрите это следует учитывать при установке внутривенных катетеров на руку, запястье, ступню и т. Д.
Поскольку большинство пациентов, перенесших артропластику, являются пожилыми, страдают сердечными, респираторными, церебральными, почечными и эндокринными заболеваниями, увеличивается периоперационная и послеоперационная заболеваемость и смертность. Поэтому оценка систем очень важна.
6.4.1. Оценка сердечно-сосудистой системы
MET (классификация метаболического эквивалента) означает, что 40-летний мужчина весом 70 кг потребляет кислород в состоянии покоя. По оценке MET, ему соответствует более 4 баллов, он может подниматься в гору, подниматься на 2 этажа по лестнице, идти прямо по дороге со скоростью 6 км / ч, бегать на короткие дистанции, выполнять тяжелую работу дома и участвовать в умеренных занятиях.Пациенты с МЕТ ≥4 считаются хорошими с точки зрения функциональных возможностей.
1 MET отдых, еда, туалет
3 MET легкая работа по дому, ходьба со скоростью 2–3 миль в час
4 MET 2-этажная лестница для подъема
7 MET тяжелая работа по дому
≥10 MET тяжелые спортивные способности
6.4.2. Оценка сердечно-сосудистого риска: индекс риска Ли является наиболее подходящим для ортопедических пациентов
Количество текущих рисков и частота сердечных осложнений
6.4,3. Сердечно-сосудистые препараты
Антигипертензивные препараты не следует отменять до утра перед операцией.
Бета-блокаторы нельзя прекращать до начала операции; Дозу препарата следует скорректировать так, чтобы ЧСС была ниже 65 / мин.
Аспирин снижает риск тромбоза глубоких вен и тромбоэмболии легочной артерии. Использование только аспирина обеспечивает неоптимальную защиту от тромбоэмболических событий, связанных с переломами бедра.Крайне важно продолжить прием аспирина при установке стентов, не содержащих скобок, без лекарств.
Тиенопиридин (клопидогрель и тиклопидин) в сочетании с двойным применением аспирина ассоциируется с использованием коронарного стента. Двойное применение увеличивает вероятность кровотечения на 0,4–1,0% по сравнению с лечением только аспирином. В зависимости от типа стента и времени вмешательства можно использовать три способа:
Двойное лечение продолжается без перерыва.
Может применяться переходная терапия с антитромботическими средствами (низкомолекулярный гепарин, ингибиторы гликопротеина II b / III a).
Лечение тиенопиридином прекращается за 10 дней до операции и возобновляется в безопасный период.
Антитромботические средства; фондапаринукс, нефракционированный гепарин (НФГ) и низкомолекулярный гепарин (НМГ).
7. Оценка проходимости дыхательных путей
Существует риск затрудненной вентиляции с помощью маски и трудной интубации из-за твердости шеи, ухудшения состояния зубов и дегенерации шейного сустава.
Гипоксия может быть связана с коллапсом легких и / или инфекцией.Предоперационная физиотерапия и спирометр могут быть полезны при послеоперационной гипоксии.
Смерть, пневмония, длительная экстубация и стойкий бронхоспазм могут наблюдаться у пациентов с ХОБЛ и курильщиков. Продолжительность пребывания в отделении интенсивной терапии больше. Частота послеоперационных легочных осложнений составляет около 25–90% (если ОФВ1 <65%, риск осложнений> 50%). Может быть проведен анализ газов артериальной крови. Если значение PaCO 2 выше 45 мм рт. Ст., Это серьезный фактор риска предоперационного легочного осложнения.В случае предоперационного использования ингаляторов, обострений дыхательных путей и наличия легочной инфекции необходимо обеспечить оптимальные условия для лечения антибиотиками и поддерживающей терапии.
8. Неврологическое обследование
В группе пациентов, которым запланирована артропластика, ослабление памяти, снижение когнитивных и интеллектуальных функций, уменьшение движений, ухудшение порядка сна, снижение зрительных, слуховых, вкусовых и обонятельных ощущений, вегетативная нервная система. системный дисбаланс, болезнь Паркинсона, депрессия и деменция — обычное явление.Если есть подозрение на психическое состояние пациента, можно запланировать тест психического статуса (Mini Mental Status Test).
9. Оценка состояния почек
Существует риск почечной недостаточности и предоперационной азотемии, связанный с возрастом. Преренальную азотемию следует корректировать гидратацией, включением пациентов в программу диализа, если это необходимо, и оптимизацией биохимических показателей.
10. Контроль гликемии
Вегетативная дисфункция, которая обычно вызывается сахарным диабетом в долгосрочной перспективе, является важным фактором регионарной анестезии и контроля периоперационной гемодинамики.Есть вероятность тихой ишемии миокарда. Оральные противодиабетические препараты следует прекратить как минимум за 24 часа до операции.
11. Контроль питания
Поскольку пациенты, перенесшие артропластику, являются гериатрами, необходимо оценить состояние питания до операции. Их статус питания оценивается с помощью мини-теста для оценки питания. Если альбумин <3,5 г / дл, пациента следует поддерживать. Следует учитывать снижение скорости клубочковой фильтрации из-за возраста. Следует исследовать мочевину, креатинин сыворотки и электролиты.
12. Обучение боли
Предоперационная подготовка, включая хирургические процедуры и протокол реабилитации, информирующая о предполагаемых преимуществах процедуры, уровне послеоперационной боли и методах обезболивания (внутривенная, эпидуральная анальгезия, контролируемая пациентом), полезна для уменьшения беспокойства пациентов, увеличения удовлетворенность пациентов и сокращение реабилитации и пребывания в больнице. Упреждающее введение опиоидных анальгетиков, ингибиторов НПВП и ЦОГ-2 может обеспечить эффективное послеоперационное обезболивание.Однако следует учитывать, что употребление опиоидов связано с повышенным риском послеоперационной тошноты и рвоты. Превентивная эпидуральная анальгезия с помощью эпидурального катетера перед артропластикой может обеспечить значительный послеоперационный контроль боли [10].
13. Доступ к онкологическим больным
Систематическая оценка онкологических больных важна. Пациентов спрашивают, получали ли они химиотерапию (ЛТ) или лучевую терапию (ЛТ). У этих пациентов могут наблюдаться ухудшение состояния здоровья и изменения кровеносных сосудов из-за угнетения костного мозга.
Алкилирующие агенты, такие как циклофосфамид, могут вызывать продление нервно-мышечной блокады.
Следует иметь в виду, что кислородная терапия в высоких концентрациях увеличивает интерстициальную пневмонию и интерстициальный фиброз из-за блеомицина.
Следует отметить кожные реакции, связанные с РТ и КТ. Сосудистый доступ может быть проблематичным. Большинство больных раком недоедают из-за болезней и побочных эффектов лечения. Часто наблюдаются потеря аппетита, кахексия, гиперпротеинемия и гипоальбуминемия.Следует оказывать предоперационную нутритивную поддержку. Считается, что иммунное питание полезно для снижения иммуносупрессии. Могут быть обнаружены метастазы в легких, нарушающие дыхательные функции. Кардиотоксические эффекты КТ и ЛТ могут распространяться на кардиомиопатию, перикардиальный выпот, перикардит и застойную сердечную недостаточность.
В гепатобилиарной системе наблюдаются гепатомегалия, ухудшение показателей функции печени и даже цирроз. Видно снижение факторов свертывания и коагулопатии.
В мочевыводящей системе можно увидеть лучевую нефропатию.
В кроветворной системе может наблюдаться нарушение иммунной системы.
Необходимо проводить многопрофильное обследование онкологических больных. После улучшения клинических и лабораторных показателей пациентов следует направить на операцию.
14. Анестезиологические методики при операциях с переломом шейки бедра
14.1. Общая анестезия
При операциях по поводу перелома бедра может быть возможно получить более безопасные результаты под общей анестезией.
При контролируемом дыхании можно получить альвеолярное давление кислорода пациента до уровней, отвечающих потребностям тканей в кислороде.
Инвазивные вмешательства, которые необходимо провести для лечения шока и наблюдения за пациентом, находящимся без сознания, могут быть выполнены легче и без проблем.
Это самый безопасный способ для пациентов с беспокойством и возбуждением из-за шока и боли из-за травмы оставаться неподвижными на операционном столе.
Общая анестезия имеет некоторые преимущества (лучший контроль гемодинамических параметров при более высокой концентрации кислорода по сравнению с региональной анестезией) [11].
Важные моменты общей анестезии:
Во-первых, необходимо заменить достаточный объем.
Индукция в соответствующих условиях мониторинга после хорошей предварительной оксигенации для снижения риска гипоксемии.
Снотворные, наркотические средства и ингаляционные средства со сбалансированной анестезией обычно сводят к минимуму потенциальные проблемы в периоперационном периоде.
Следует обращать внимание на положение пациента во время анестезии.
14.1.1. Ведение общей анестезии у пожилых пациентов
Учитывая, что подавляющее большинство операций по поводу перелома шейки бедра выполняется пожилым людям, у пожилых пациентов следует соблюдать рекомендации по общей анестезии. Вначале следует избегать премедикации, которая может вызвать угнетение дыхательных путей, или следует уменьшить дозу.
При выполнении замещения объема следует избегать сердечной нагрузки и поддерживать среднее артериальное давление.Угнетения дыхания можно избежать, минимизируя дозу опиоидов. Для лечения гипотонии могут потребоваться инотропные препараты. Также необходимо обеспечить сохранение функции почек.
Мы должны убедиться, что нервно-мышечный блок полностью выключен. Для послеоперационного обезболивания следует использовать методы регионарной анестезии и корректировать дозу.
14.2. Регионарная анестезия
Эпидуральная и спинальная блокада, а также использование этих вмешательств для снятия боли имеет долгую историю.Оба метода широко используются во всем мире. У них есть некоторые преимущества, такие как вмешательство регионарной анестезии, ранняя мобилизация, послеоперационное обезболивание и снижение риска ТГВ, гипоксии и проблем с сознанием [12]. Существует ряд исследований на гериатрических пациентах, которые указывают на превосходство регионарной анестезии при операциях с переломом шейки бедра.
Преимущества спинальной анестезии:
Недостатки:
Обеспечивают низкую дозу и токсичность.
Редко трясется.
Гипотония чаще возникает внезапно.
Распространенность постспинальной головной боли высока.
Верхний уровень блокировки может быть изменен и не может быть изменен.
Послеоперационное обезболивание невозможно.
Продолжительность эффекта не может быть увеличена.
Преимущества эпидуральной анестезии:
Желаемый уровень блока можно титровать с помощью катетера.
Продолжительность анестезии может быть увеличена за счет дополнительных доз.
Возможно получение послеоперационного обезболивания [13].
Головной боли нет.
Время действия длительное.
Глубина блокировки может различаться в зависимости от агента.
Нижняя граница может отличаться; крестцовое распространение ограничено.
Требуется высокая доза.
Часто присутствует тряска.
Комбинированная спинально-эпидуральная анестезия:
Она обеспечивает как спинальную, так и эпидуральную анестезию, как уже упоминалось выше, при абдоминальной хирургии, хирургии нижних конечностей и родовой анальгезии.
Возможно выполнение недостаточной спинномозговой анестезии.
Обеспечивает более длительное обезболивание опиоидами и / или местными анестетиками даже в послеоперационном периоде.
Частота возникновения головной боли из-за постдуральной пункции невысока, также предусмотрены инъекции аутогенной крови для лечения / защиты головной боли из-за случайной постдуральной пункции.
14.3. Блокада периферического нерва
Если нейроаксиальная блокада противопоказана, можно применить блокаду подвздошной фасции, блокаду бедренного нерва и блокаду седалищного нерва. Блокада периферических нервов особенно полезна у пациентов с опухолями, у которых развивается непереносимость опиоидов и которые принимают антикоагулянты.
Пояснично-крестцовые блоки, а также блоки бедренного и седалищного нерва могут быть использованы при эндопротезировании тазобедренного сустава у гериатрических пациентов. Эти блоки также обеспечивают послеоперационное обезболивание.Поскольку блокада периферических нервов не вызывает симпатической блокады, внезапная гипотензия не может возникнуть.
Преимущества:
Защита сознания пациента и нормальное дыхание.
Повышенная возможность обеспечения односторонней блокировки.
Дыхательная система не затронута.
Влияние на центральную нервную систему минимально.
Меньшая симпатическая блокада, чем регионарные методы.
Использование УЗИ при периферической закупорке:
Использование Стимуплекса может не понадобиться, количество ударов уменьшается, доза снижается, а время применения закупорки сокращается. Сосудистую систему нельзя предотвратить, продолжительность блокады не увеличивается у взрослых, а укороченная нейропраксия не уменьшается [14].
14.4. Обследование после операции при переломе бедра
Достойное послеоперационное обследование и уход после операции являются важными факторами для выздоровления пациента.Пост-анестезиологическая помощь включает периодическое наблюдение, если необходимо; лечение респираторной, сердечно-сосудистой и нервно-мышечной функций пациента; и мониторинг уровня в крови, температуры тела, интенсивности боли, тошноты, рвоты, дренажа, кровотечения и диуреза.
Дыхательная система контролируется пульсоксиметром. Это полезно для раннего выявления гипоксии. ASA рекомендует дополнительную кислородную терапию при риске гипоксемии, во время транспортировки и в пунктах сбора.Кислородная терапия продолжительностью до 24 часов особенно рекомендуется пожилым людям с риском ишемии миокарда, перенесшим операцию по поводу перелома бедра.
Сердечно-сосудистая система: ЭКГ и тонометр следует продолжать во время бодрствования и компиляции. Не следует забывать, что пациенты с артропластикой — люди пожилого возраста, могут быть выявлены сопутствующие сердечно-сосудистые заболевания и высок риск послеоперационных сердечных осложнений. Наиболее важным фактором, влияющим на смертность у гериатрических пациентов, являются текущие сопутствующие заболевания.Повышение уровня тропонина I важно для послеоперационного наблюдения из-за ишемии миокарда.
Оценка нервно-мышечных функций (NMF) проводится с помощью физического обследования и мониторов нервно-мышечной блокады.
Тепло тела: Сохранение нормотермии и периодические измерения температуры тела должны проводиться для предотвращения переохлаждения, а при необходимости должны использоваться обогреватели. Важны как восстановление после анестезии, так и комфорт пациента после операции. При лечении заболеваний щитовидной железы также могут использоваться такие агенты, как меперидин в низких дозах и трамадол.
Тромбоэмболы: Профилактические антикоагулянты, ранняя мобилизация, прерывистые пневматические компрессионные устройства, компрессионные носки и нейроаксиальная анестезия могут уменьшить тромбоэмболические осложнения. Пациентам пожилого возраста рекомендуется продолжить терапию ацетилсалициловой кислотой. Использование регионарной анестезии и антикоагулянтов по-прежнему вызывает споры.
Тошнота и рвота : Периодический контроль тошноты и рвоты важен для выявления осложнений.При лечении тошноты и рвоты могут использоваться антагонисты 5-HT3, транквилизаторы / нейролептики, скополамин, дексаметазон, антигистаминные препараты или метоклопрамид.
Функции почек: Задержка мочи — частое осложнение. Это особенно часто встречается после эпидуральной анестезии. Это осложнение не возникает при блокаде периферических нервов.
Когнитивные изменения : Когнитивные изменения после операций при переломе бедра часто встречаются у пожилых пациентов. Есть исследования, показывающие, что краткосрочные когнитивные изменения менее часты после спинальной анестезии.Однако в долгосрочной перспективе разницы не было.
15. Послеоперационные методы обезболивания в хирургии перелома бедра
Обезболивание при операциях с переломом бедра является мультимодальным. Комбинированное использование механических анальгетиков с различным действием обеспечивает меньшее обезболивание, что приводит к меньшему употреблению опиоидов и меньшим осложнениям [15].
Неадекватное послеоперационное обезболивание вызывает длительную госпитализацию и дополнительные злокачественные новообразования. Неадекватное обезболивание приводит к хронизации боли и снижению качества жизни пациента.
Интраоперационная анальгетическая обработка с помощью предоперационного эпидурального катетера гарантирует, что у пациента не будет боли в конце операции. Пациент может быстрее вернуться к повседневной деятельности. Техника обезболивания, контролируемого пациентом (PCA), часто используется для лечения послеоперационной боли. Его можно вводить через периферический внутривенный или эпидуральный катетер. Блокады периферических нервов также могут быть выполнены с помощью PCA с использованием катетера.
Протоколы бупивакаина и опиоидов.в основном используются в регионализированном СПС. Следует отметить, что опиоиды, вводимые эпидуральным путем, также могут вызывать седативный эффект.
Периартикулярная инъекция и комбинированная терапия пациентам с артропластикой тазобедренного сустава должны быть частью лечения [16]. Раствор для околосуставных инъекций включает: бупивакаин 0,5% 200–400 мг, сульфат морфина 4–10 мг, адреналин 300 мкг, метилпреднизолон 40 мг, цефуроксим 750 мг и 0,9% NaCl. Общий объем 60 мл.
Околосуставная инъекция вводится в переднюю капсулу, сухожилие подвздошно-поясничной мышцы и промежность перед репозицией.После репозиции применяется в отводящих, широкой фасции, snovia, большой ягодичной мышце и инсерциусе, задних капсулах, коротких внешних вращателях.
Продолжительность пребывания в больнице и скорая помощь : Средняя продолжительность пребывания в больнице составляет 3 дня при артропластике тазобедренного сустава. Среднее время после восстановления перелома бедра для пожилых пациентов составляет 20 дней. Несмотря на то, что существует множество исследований, подтверждающих, что нейроаксиальная анестезия является преимуществом для скорой помощи [17], есть исследования, подтверждающие неэффективность метода анестезии.
.Общая внутривенная анестезия | определение общей внутривенной анестезии Медицинским словарем
Общая внутривенная анестезия на основе пропофола связана с большей выживаемостью, чем дезфлурановая анестезия при хирургии рака толстой кишки. До тотальной внутривенной анестезии когнитивный балл в группе A составлял 30 баллов по шкале MMSE, а в группе B — также 30. Показанный успех при тотальной внутривенной анестезии остается одним. из наиболее многообещающих разработок, полученных за годы боевых действий. Группа TIVA Группа TIVA + DEX (n = 11) (n = 12) Возраст (лет) 65 [+ или -] 8 60 [+ или -] 6 Масса тела (кг ) 74 [+ или -] 13 77 [+ или -] 15 Рост (см) 164 [+ или -] 8 165 [+ или -] 10 Пол (женщина-мужчина) 4-7 4-8 Гипертоническая болезнь 10 12 CPB время (мин) 94 [+ или -] 22 89 [+ или -] 25 Время операции (мин) 299 [+ или -] 34 324 [+ или -] 35 Время экстубации (ч) 14 [+ или -] 3 14 [+ или -] 4 Отделение интенсивной терапии 4 [+ или -] 1 4 [+ или -] 1 раз (дни) Пребывание в стационаре (дни) 7 [+ или -] 1 8 [+ или -] 2 Пациенты перенесла операцию по аортокоронарному шунтированию в рамках мини-сердечно-легочного шунтирования (CPB) с использованием обычного тотального внутривенного введения эстезия (TIVA) отдельно или с дексмедетомидином (TIVA + DEX).Ранее упомянутый Центр TARGIT был создан для разработки методов и стратегий, которые приведут к развитию, исследованиям, обучению и внедрению тотальной внутривенной анестезии на поле боя и в суровых условиях. Хупфл и др. Продемонстрировали влияние аминофиллина на биспектральный индекс. во время ингаляционной и тотальной внутривенной анестезии, что было связано со значительным увеличением BIS до 10 мин после инъекции аминофиллина. Общая внутривенная анестезия дексмедитомидином и кетамином у детей.Цель: мы стремились сравнить анестезирующие характеристики между общей внутривенной анестезией (TIVA) с использованием пропофол-ремифентанила с целевым контролем инфузии (TCI) и летучей индукционной и поддерживающей анестезией (VIMA) с использованием севофлурана и суфентанила у пациентов, перенесших лапароскопическую холецистэктомию. комбинация пропофола и кетамина во время операции на коронарной артерии. Ежедневное прерывание седативного действия и нацеливание на легкие уровни седативного эффекта безопасны и, как было доказано, улучшают результаты для седативных пациентов ОИТ, когда эти подходы приводят к снижению воздействия седативных средств и облегчению возбуждения.[sup] [20] Тотальная внутривенная анестезия с системой TCI использовалась в клинической анестезии. [sup] [21], [22], [23], [24], [25], [26], [27], [28], [29], [30], [31] У отдельного пациента необходимо титрование целевого значения для достижения желаемой глубины седации, а простота и точность этого титрования обеспечивается системой TCI. .PPT — Презентация PowerPoint для тотальной внутривенной анестезии, скачать бесплатно
Общая внутривенная анестезия . นพ. ธีร วั ฒ น์ ภาค วิชา วิสัญญีวิทยา โรง
Уменьшение TIVA • Глобальное потепление • N2O • Снижение загрязнения от летучих веществ в операционной • Снижение риска у пациентов или операции: • Подозрение на ЗГ • Воздушная эмболия • Хирургия головного мозга • Больше подходит во время операции, чем трудно или невозможно эффективно использовать ингаляционную анестезию • Ларингоскоп, бронхоскопия • Торакальная хирургия • Гастроскопия или колоноскопия • Снижение риска ПОТР • Амбулаторная хирургия • Анестезия вне операционной
Сбалансированная анестезия Гипноз без сознания Амнезия — внутривенные анестетики — Ингаляционные препараты Подавление рефлекса Обезболивание Иммобилизация Расслабление мышц — миорелаксанты — Опиоид
Фармакокинетика и TIVA • Использование математики для описания того, как организм «обрабатывает» конкретное лекарство
Открытая трехкамерная модель
Группа тканей Состав Масса тела (%) CO (%) Богат сосудов Мозг, сердце, печень, эндокринные железы 10 75 Мышцы, мышцы, кожа 50 19 Жир Жир 20 6 Бедный сосудами Кость, связки, хрящи 20 0 Перфузия органов
Открытая трехкамерная модель
Контекстно-зависимый полупериод • Время, необходимое для снижения концентрации в плазме на 50% после прекращения инфузии.• При TIVA желательны короткие препараты CSHT.
Открытая трехкамерная модель
ke0: Описание доставки лекарственного средства к месту воздействия фармакокинетическая константа скорости, которая описывает скорость уравновешивания между концентрацией в плазме и местом воздействия.
Задержка эффекторного участка
Эффективная концентрация в крови • Эффективность • Летучие препараты: МАК (анестетик, необходимый для предотвращения грубых, целенаправленных движений у 50% пациентов в ответ на вредный раздражитель) • Пропофол: ED50 • пропофола и N2O было 4.5 мкг / мл, а ED95 — 4,7 мкг / мл. • пропофол составлял 6,0 мкг / мл, а ED95 составлял 6,2 мкг / мл.
Разработка систем доставки поддержание оптимального и стабильного состояния анестезии AIM 1st iv. болюсная инъекция: однократное, периодическое введение, в / в. капельный Инфузионный насос Шприцевой насос TCI 2-й 3-й
TIVA-TCI: Целевая контролируемая инфузия • TCI เป็น เทคนิค ที่ นำ เอา ข้อมูล ความ สัมพันธ์ การ ไหล ของ ยา และ ใน กระแส เลือด มา คำนวณ โดย คอมพิวเตอร์ เพื่อ ระดับ ยา ใน แต่ละ Отделение ให้ เป็น ไป ตาม ต้องการ
TIVA-TCI: Лекарства, подходящие для лечения гипноза Пропофол Дексмедетомидин (Этамидат не подходит из-за подавления стероидогенеза надпочечников) • Анальгетики • Ремень • Анальгетики фентанил не для длительного вливания • (морфин не подходит) • l Проверьте время пробуждения Propofol Cet 1.5–2,0 мкг / мл = пробуждение √ Проверить время пробуждения Пропофол Cet 1,5–2,0 мкг / мл = пробуждение √
Пропофол • เป็น ยา ใน กลุ่ม алкилфенол ซึ่ง เป็น ไขมัน ใน อุณหภูมิ ห้อง • ประกอบด้วย 1% пропофол , 10% соевого масла в виде длинноцепочечных триглицеридов, 2,25% глицерина и 1,2% очищенного яичного фосфатида มี 0,005% динатрия эдетата เพื่อ рост бактерий • Метаболизм • Быстрый метаболизм в печени путем конъюгации и глюкородирования • Почечная экскреция • Внепеченочный метаболизм; легкие, тонкий кишечник, почки
CNS • Снижение CMRO2, CBF, ICP • Противосудорожная терапия • Миоклоническая икота • CVS • Расширение вен, снижение PVR и CO -> гипотония • Более сильное CVS, чем тиопентальное • Дыхание • может быть преходящим апноэ • снижение TV, скорость
Фармакодинамическая изменчивость • Возраст • повышенная чувствительность пожилых людей к воздействию пропофола.ke0, следовательно, уравновешивание места воздействия плазмы не меняется с возрастом. • Эти свойства предполагают, что индукция у пожилых пациентов должна достигаться с более низкими концентрациями в плазме, чем у молодых людей, однако ее также следует титровать медленнее, чтобы избежать побочных эффектов.
Фармакодинамическая изменчивость • Системное заболевание • Часто предполагалось • пациентам со значительным заболеванием потребуется меньше анестетика • повышенная чувствительность центральной нервной системы к препарату • повышенная свободная фракция препарата вторична из-за снижения связывания с белками плазмы (тонкая фармакокинетика изменения)
ใน กรณี ไม่ ใช้ เครื่อง TCI การนำ ส ลบ ขนาด ส โดย ปกติ ใช้ 1-2.5 ม ก. / กก. โดย — ใน ผู้ใหญ่ ไม่ ได้ รับ опиоид หรือ бензодиазепин เป็น ยา премедикация ใช้ 2,25–2,5 ม ก. / กก. — แก่ อายุ มากกว่า 60 ปี ไม่ ได้ รับ опиоид หรือ бензодиазепин เป็น ยา премедикация ใช้ 1,75 ม ก. / กก. — เด็ก ไม่ ได้ รับ опиоид หรือ бензодиазепин เป็น ยา премедикация ใช้ 2-3 ม ก. / กก. การ ป้องกัน гипотония ใน ผู้ ป่วย ที่ ป่วย เรื้อรัง หรือ มา รับ การ ผ่าตัด หัวใจ ควร ค่อยๆ пропофол 10-30 ม ก. จนกระทั่ง ผู้ ป่วย ส ควร สาร น้ำ นำ ไป
ไม่ ใช้ เครื่อง TCI Поддерживающая доза — กรณี ฉีดยา เป็น ครั้ง คราว (прерывистый болюс) ให้ 10-40 ก.ทุกๆ 2-3 นาที — ใน กรณี หยด ยา อย่าง ต่อ เนื่อง (непрерывная инфузия) หลัง ให้ ยา นำ ส ลบ หยด ยา 140 ม ค ก. / กก. / นาที เป็น เวลา 10 นาที ต่อ ด้วย ด้วย 100 ม ค ก. / กก. / นาที โดย ให้ ร่วม фентанил 0,02 ม ค ก. / กก. / นาที альфентанил 0,25 ม ค ก. / กก. / นาที
TIVA-MCI: инфузия с ручным управлением Уменьшение боли с N2O без N2O Start 8 10 12> 10 мин. 5 7 9> 2 ч. 3 5 7 «используются для обозначения ручной регулировки скорости инфузии для шприцевых насосов для анестезии» «используются для обозначения ручной регулировки скорости инфузии для шприцевых насосов для анестезии» Начальная скорость инфузии 10 мин. Последующая регулировка для поддержания стабильного уровня анестезии Не легко контролировать Трудоемкий расчет Прерывание инфузии не компенсируется. Требуются навыки и опыт
ระยะ เวลา ของ การ ส ลบ ควร หยุด ยา ก่อน ให้ ตื่น 15 นาที 5 (3-8) นาที 30 นาที 7.5 (4-12) นาที 1 ชม. 10 (4-15) นาที 2 ชม. 12,5 (5-20) 3. 15 (6-23) นาที 4 ชม. 20 (8-33) นาที 5. 25 (9-43) นาที 6 ชม. 30 (20-47) นาที หยุด ยา ก่อน เวลา ที่ ให้ ป่วย ตื่น
TCI –концентрация пропофола • Целевая концентрация зависит от • уровня стимуляции • лекарственного взаимодействия • желаемой клинической конечной точки • времени уменьшения • индивидуальной вариабельности Cet 2-3 мкг / мл потеря рефлекса ресниц Cet 4-8 мкг / мл для анестезиологической процедуры Интубация, LMA CP50 2,7 — 3.4 мкг / мл потеря ответа на словесные или тактильные стимулы * Cet 2-3 мкг / мл потеря рефлекса ресниц Cet 4-8 мкг / мл для анестезиологической процедуры Интубация, LMA Target =? *: Vuyk J et al. Анестезиология 1992; 77: 3. Crankshaw DP et al. Anaesth Intensive Care 1994; 22: 481. Smith C et al. Анестезиология 1994; 81: 820.
TCI для индукции и интубации ↓ Cet 2–3 мкг / мл, ожидание следующего болезненного стимула ↑ Cet 4–6 мкг / мл для разреза кожи • Миорелаксант Ventilate 1.0-1,5 мин • Cet 4-8 мкг / мл для интубации • Вентиляция 1,0-1,5 мин • TTPE • MO 5-10 мг • Мидазолам 1-2 мг • TCI пропофола • Cet 2-3 мкг / мл • потеря реакции • Проверьте вентиляцию
Пропофол в различных липидах • Стандартный состав пропофола содержит 10% соевого масла в виде длинноцепочечных триглицеридов. • Боль при инъекции 14,7% • Триглицериды с длинной и средней цепью снижают частоту боли при инъекции до 2,7%.
Инфузионный синдром, связанный с пропофолом • Инфузия высокой дозы> 5 мг / кг / час в течение> 48 часов Внезапное начало глубокой брадикардии, липемической плазмы с метаболическим ацидозом, симптомов почечной недостаточности, ожирения печени, рабдомиолиза или миоглобинурии Факторы риска: плохая доставка кислорода, сепсис серьезное повреждение головного мозга Монитор: ацидоз, K +, функция почек
Благодарю за внимание
THIOBARBITURATE (THIOPENTAL) • Препарат • 2.5% бледно-желтый раствор pH 10-11 • бактериостатический • Механизм действия • Взаимодействует с рецептором ГАМК -> гиперполяризация мембраны • Окончание действия • Перераспределение -> ультракороткое действие • Метаболизм — печень
Выведение — почечная экскреция водорастворимого • Доза • 3-5 мг / кг в / в в зависимости от возраста, ASA: • Начало = 60 секунд • Восстановление = 5-10 минут
Фармакологические действия • ЦНС • Снижение ВЧД, CMRO2 , CBF • Противосудорожное средство 50–100 мг внутривенно • Защита головного мозга • Обеспечивает электрическую тишину; 15–40 мг / кг, затем 2–4 мг / кг / час • CVS • Расширение вен -> CO, ABP • Барорецепторный рефлекс • Повышение ЧСС • CO может заметно снизиться • Гиповолемия • Бета-блокатор • Перенесенное заболевание сердца • Респираторные органы • Медуллярный центр депрессии -> RR, TV • Апноэ • Обструкция верхних дыхательных путей • Рефлекс дыхательных путей • Бронхоспазм • Ларингоспазм
Побочные эффекты • Тромбофлебиты инъекция -> спазм • Аллергическая реакция (высвобождение гистамина) • Гипотензия • Подкожная инъекция -> некроз Противопоказание * ПОРФИРИЯ *
БЕНЗОДИАЗЕПИНЫ • Незначительный транквилизатор • Антивозрастной эффект, седативный эффект • Амнезия • Контролирующая мышечная судорога
9000ДИАЗЕПАМ (валиум) • Хорошо растворим в липидах • Нерастворим в воде • Механизм действия • Изменяет активность рецепторов ГАМК • Метаболизм -> печеночный • Выведение -> почечный • Показания • Премедикация: 0.05-0,1 мг / кг • Введение анестезии: 0,3-0,5 мг / кг • Внутривенная седация: 1-2 мг п.р.н. IV • Лечение приступа
МИДАЗОЛАМ (Дормикум) • pH <4--> Водорастворимый • Физиологический pH -> растворимый в липидах • Механизм действия • Изменяет активность рецепторов ГАМК • t 1/2 = 1 — 4 час. • Метаболизм -> печеночный • Выведение -> почечный • Показания • Премедикация: 0,07–0,15 мг / кг • индукция анестезии: 0,15–0,3 мг / кг • внутривенная седация: 0,5–1 мг, повторить действие
БЕНЗОДИАЗЕПИНЫ • ЦНС • Уменьшение CMRO2, CBF • Повышение ЧСС из-за лекарственного ваголиза • Тревога, амнезия (зависит от дозы) • Противосудорожные свойства • CVS • Незначительное снижение УВО, АД • Респираторные органы • Дозозависимое угнетение дыхания • Респираторный ответ на снижение CO2 • Снижение частоты апноэ • Тщательное титрование
ФЛУМАЗЕНИЛ (Anexate) • Антагонист бензодиазепина центрального действия • Доза 0.25 — 0,5 мг. • Наступает через 30 — 60 сек. • Продолжительность 1 час. • Метаболизируется в печени • Побочные эффекты • головокружение, беспокойство, тошнота, рвота, возбуждение
КЕТАМИН • Препарат • Водорастворимая рацемическая смесь • Механизм действия • Действует на рецептор NMDA • Действует на опиоидный и холинергический рецепторы • Вызывает диссоциацию • Метаболизм — печеночный • Норкетамин — эффективность кетамина 1/5 • Выведение — почечный
Показания • индукция анестезии • единственная анестезия • премедикация • ДОЗА • 1-2 мг / кг внутривенное введение • 3- 5 мг / кг в / м индукция • 0.2-0,8 мг / кг внутривенная седация -> 5-20 мкг / кг / мин • 15-45 мкг / кг / мин с поддержанием O2 / N2O
CNS • Увеличение CMRO2, CBF, ICP • Амнезия, анальгезия • ССС • Повышение САД, СО, ЧСС • При истощении катехоламинов или вегетативной • блокаде -> угнетении миокарда • Дыхании • Бронходилатации — симметрично • Относительное сохранение гортанных рефлексов
ПРОПОФОЛ (дрипиван) • 2, 6 диизопропилфенол; 1% раствор в • эмульсии лецитина яичного белка • Механизм действия • Может быть на рецепторе ГАМК • Метаболизм — печень • Выведение — почки
CNS • Уменьшает CMRO2, CBF, ICP • Противосудорожная терапия • Миоклоническая икота • ССС • Расширение вен, снижение ЛСС и сердечная недостаточность • депрессия -> гипотензия • ССС выше, чем у тиопентала • Дыхание • может быть преходящее апноэ • снижение TV, частота
Показание • Введение анестезии • Единственный анестетик для короткой процедуры • Лечение судорог • Доза • 2-2.5 мг / кг внутривенное введение • Поддержание 100-200 мкг / кг / мин • 25-100 мкг / кг / мин седативный эффект
ЭТОМИДАТ • Механизм • Может действовать на рецептор ГАМК в ретикулярной активирующей системе • Метаболизм — печеночный • Выведение — через почки • Доза • 0,2-0,4 мг / кг внутривенное введение • начало 30-60 сек. • Восстановление = 5 минут
CNS • может увеличить активность ЭЭГ у людей с • эпилепсией • Миоклонические движения (до лечения опиоидом) • CBF, ICP, CMRO2 снижение • CPP поддерживается • Повышение SSEP-ответа • CVS — СТАБИЛЬНЫЙ • Дыхание • Преходящее апноэ • Частота снижения и TV • Недостаток; Подавление надпочечников
